OPN 转染BMSCs 对高转移潜能肝癌细胞的影响
2015-12-31李天然蔡立杰赵绍宏魏正茂霍天龙卢光明
李天然,蔡立杰,赵绍宏,魏正茂,霍天龙,卢光明,宋 斌
1.福建医科大学福总临床医学院第一附属医院放射科,福建莆田351100;2.解放军总医院第一附属医院放射科;3.北京大学人民医院放射科;4.南京总医院放射科
自体干细胞移植对于治疗包括肿瘤在内的多种疾病具有潜在的应用前景[1]。然而,干细胞具有很多不确定性,是否对肿瘤具有长期有效的持续作用,以及移植干细胞的安全性仍需研究。通过现代基因工程技术对干细胞进行改造,使其具有特定的功能表达,又保持干细胞的基本特性,实现对肿瘤的干预效能的提升是值得探索的研究内容。已经证明,骨桥蛋白(osteopontin,OPN)在病理状态下,全身各个器官均有表达。在肝坏死动物模型中坏死区和感染区域的Kupffer 细胞、巨噬细胞和卫星细胞中有表达,OPN 有助于巨噬细胞向病灶区域迁移[2],血浆中OPN 表达水平与慢性肝病有密切的关系[3]。OPN 在各种癌症中均有表达,包括肝细胞癌(hepatocellular carcinoma,HCC),在肿瘤的生长、侵袭、转移、血管化和阻止肿瘤细胞凋亡中有重要作用[4-5],OPN 中含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列,RGD 可与整合素αv、β3受体结合,促进肿瘤的转移。基于OPN 生物学特性,本研究设计利用基因工程技术将OPN 基因转染骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),使BMSCs 表达OPN 上调,观察基因转染后BMSCs 对具有高转移潜能肝癌细胞(MHCC97-H)的影响。
1 材料与方法
1.1 细胞株 BMSCs 购自赛业(广州)生物科技有限公司,人MHCC97-H 购自上海复旦大学肝癌研究所。Transwell 小室(Millipore)。
1.2 OPN 基因转染BMSCs 方法
1.2.1 OPN 表达质粒构建:构建以人OPN 为靶向基因的mRNA 表达质粒,pLV. EX3d. P/neo-EF1A >OPN>IRES/eGFP,以绿色荧光蛋白(green fluorescence protein,GFP)为报告基因。
1.2.2 病毒包装和OPN 基因转染方法:取293FT 细胞,10 cm 的培养皿按5 ×106个细胞数接种,培养箱中过夜;更换培养液。将DNA-Lipofectamine 2000 复合物添加到293FT 细胞中,每天更换培养液,转染培养72 h,去除培养液,荧光显微镜下观察转染效果;若细胞转染率达到要求,扩增细胞送检PCR 检测。基因修饰前后BMSCs 免疫组织化学染色荧光检测。另取细胞,用PBS 洗涤细胞,甲醛固定,结晶紫染色液,去除染色液,PBS 洗涤细胞,计数被染成蓝色的克隆数目,计算病毒滴度。
1.3 MHCC97-H 与BMSCs/OPN 转染细胞的共培养实验
1.3.1 MHCC97-H 细胞侵袭能力检测:Transwell 侵袭小室技术是利用Matrigel 模拟天然基底膜结构,观察具有侵袭和迁移能力的细胞在趋化剂诱导下穿过多孔滤膜的情况。取BD 基质胶,用完全培养基稀释,按8.68 μg/cm2的浓度铺至Transwell 6 孔板的上室,37 ℃孵育2 h,吸去BD 基质胶。复苏肝癌细胞MHCC97-H 培养,常规培养48 h,换液,备用。BMSCs 或BMSCs/OPN 培养至第3 代,备用。实验组共分两组(BMSC s 组和OPN 基因转染BMSCs 组),将培养BMSCs 或BMSCs/OPN按1 ×106浓度接种于Transwell 共培养系统下室,再将Transwell 的上室置于孔中,在上室内接种MHCC97-H 细胞,使上下室的培养液相互融通,建立起BMSCs 或BMSCs/OPN 与MHCC97-H 细胞的共培养体系。对照组MHCC97-H 按1 ×106浓度接种于Transwell 共培养系统的上室,Transwell 下室加入单纯DMEM 培养基为对照。实验组与对照组实验细胞培养48 h,分别取出共培养上室,吸去上室的培养基,并用PBS 洗2 次;用预冷的多聚甲醛固定上室的细胞,室温固定30 min,吉姆萨染色30 min 后,用纯净水漂洗干净,计数上室迁移至Matrigel 膜下的细胞数,显微镜下随机选取5 个视野进行拍摄(200 ×),计数每个视野的平均细胞数量,细胞计数作为MHCC97-H细胞侵袭能力检测的指标。
1.3.2 MHCC97-H 增殖能力检测:采用Cell Counting kit-8 法(CCK-8)检测MHCC97-H 细胞增殖能力,实验分组同1.3.1。待下室细胞(BMSCs 或BMSCs/OPN)均贴壁后,96 孔板上室每孔2 ×103的细胞量进行接种MHCC97-H 细胞,共培养48 h 后,取出上室板,每孔加入8 μl 的CCK-8 溶液,37 ℃孵育4 h,孵育完毕后,进行吸光度值(optical density,OD)490 nm 读数。
1.4 实时定量基因扩增荧光检测系统qPCR 检测MHCC97-H 实验 实验分组同1.3.1。待下室细胞(BMSCs 或BMSCs/OPN)贴壁后,上室12 孔板每孔3 ×104的细胞量进行接种MHCC97-H 细胞,共培养48 h后,取上室MHCC97-H 细胞送检qPCR。
1.4.1 引物序列:引物设计序列由赛业(广州)生物科技公司合成。检测MHCC97-H 细胞与BMSCs 共培养前后转移相关的生物因子OPN、αv、β3及基质蛋白酶原2(matrix metalloproteinase-2,MMP-2)表达情况,以人肌动蛋白GAPDH 作为内参照物(见表1)。

表1 生物因子引物序列设计(F-正向引物,R-反向引物)Tab 1 Biological factors primer sequence design (F-Forward primer,R-Reverse primer)
1.4.2 qPCR 实验方法:(1)MHCC97-H 细胞的RNA提取,细胞裂解,加入200 μl 氯仿,14 000 × g 离心15 min;吸取400 μl 上层水相,加入500 μl 的异丙醇,14 000 ×g 离心10 min,去废液,加入1 ml 无水乙醇洗涤RNA 沉淀;12 000 × g 离心5 min,去废液;加入20 μl DEPC 水溶解RNA 沉淀。(2)合成cDNA:在去除了DNA 污染的RNA 样品中加入oligo (dT)18primer 1 μl,70 ℃孵育5 min;按照顺序加入:5 × reaction buffer 4 μl;10 mmol/L dNTP mix 2 μl;RiboLockTMRNase Inhibitor (20 u/μl)1 μl。37 ℃孵育温浴5 min;加入 RevertAidTMM-MuLV Reverse Transcriptase(200 u/μl)1 μl;42 ℃孵育60 min,70 ℃孵育10 min。(3)特异性引物聚合酶链反应(PCR)扩增相应的cDNA。PCR 条件:预变性95 ℃,5 min;变性94 ℃,30 s,退火58 ℃,30 s,延伸72 ℃,30 s,共40 个循环,最后72 ℃,10 min。PCR 产物电泳并经凝胶电泳处理系统扫描半定量分析。
1.5 统计学处理 采用SPSS 16.0 统计软件进行处理,组间比较采用F 检验,两组间比较采用独立样本t检验,P <0.05 为差异有统计学意义。
2 结果
2.1 OPN 基因转染BMSCs 实验结果 荧光显微镜结果显示,OPN 基因转染BMSCs 成功,细胞形态与未经转染的BMSCs 细胞形态学上无差别。qPCR 法检测OPN 基因转染BMSCs 前后OPN 基因表达,以正常BMSCs 为对照组,OPN 基因转染BMSCs 后,OPN 表达明显高于对照组(2. 79 ±0. 96 vs 0.72 ±0. 50,P <0.05),表明基因转染成功(见图1)。
2.2 OPN 转染BMSCs 对MHCC97-H 增殖的影响以MHCC97-H 细胞作为对照组,OD 值检测结果显示,MHCC97-H 与BMSCs 细胞共培养后,MHCC97-H增殖能力增强,与对照组比较,差异有统计学意义(0.57 ±0.21 vs 0.34 ±0.16,P <0.05);OPN 基因转染的BMSCs 细胞对MHCC97-H 细胞增殖无明显作用,与对照组比较,差异无统计学意义(0. 41 ±0. 11 vs 0.34 ±0.16,P >0.05)。

图1 OPN 基因转染的BMSCs 细胞形态学 A:荧光显微镜示细胞发出绿色荧光,GFP 是基因转染载体的报告基因(200 ×);B:细胞排列规则,细胞形态呈长形、梭形(100 ×)Fig 1 Cells morphology of OPN gene transfected BMSCs A:BMSCs cells showed green fluorescence under fluorescence microscope,and GFP as a reporter gene (200 ×);B:cells arranged regularly,and BMSCs cells tended to be long and spindle shape(100 ×)
2.3 OPN 转染BMSCs 对MHCC97-H 侵袭能力的影响 以MHCC97-H 细胞作为对照组,结果显示,MHCC97-H 与BMSCs 细胞共培养后,侵袭能力变化不明显,细胞侵袭数量与对照组比较,差异无统计学意义(61.2 ±4.56 vs 67.4 ±8.24,P >0.05);OPN 基因转染的BMSCs 细胞对MHCC97-H 细胞侵袭具有明显的促进作用,与MHCC97-H 和BMSCs 共培养组比较,差异有统计学意义(92.4 ±10.4 vs 61.2 ±4.56,P <0.05)。
2.4 MHCC97-H 细胞与BMSCs 共培养后转移相关因子的表达 以MHCC97-H 作为对照组,与对照组比较,MHCC97-H 与BMSCs 共培养后,MHCC97-H 细胞OPN、αv、β3表达变化不明显,差异无统计学意义(P >0.05),而MMP-2 表达差异有统计学意义(P <0.05)。MHCC97-H 与经DPN 转染的BMSCs 细胞共培养后,MHCC97-H 细胞OPN 表达明显降低,而αv、β3、MMP-2表达明显升高,与对照组比较,差异有统计学意义(P <0.01,见表2)。
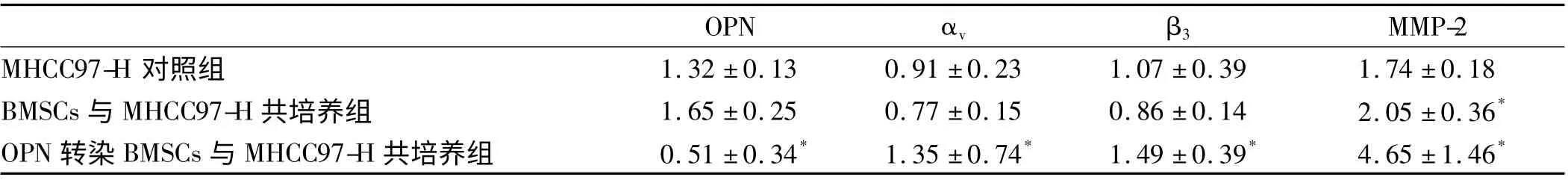
表2 MHCC-97 细胞与转基因转染前后BMSCs 共培养相关生物因子表达比较Tab 2 Comparison of biological factors expressions of MHCC97-H co-culture with BMSCs before and after transfected OPN gene
3 讨论
原发性肝癌侵袭和转移是影响肝癌预后的两大因素。近年来生物治疗成为肝癌治疗的新技术,然而基于干细胞技术的生物治疗目前尚未取得一致的意见[6]。本研究主要是利用基因工程技术对BMSCs 进行修饰,观察经基因修饰的BMSCs 对肝癌细胞转移潜能的影响情况,为干细胞的生物治疗进行探索性基础研究。
OPN 是与转移相关的生物因子,通过与整合素αv、β3相结合而促进肿瘤的转移[7]。基于BMSCs 是基因良好载体这一特性,通过基因修饰技术OPN 转染BMSCs,使之过表达OPN,观察经基因修饰的BMSCs对MHCC97-H 的影响。研究中采用Gateway 克隆技术设计构建质粒作为载体,eGFP 作为报告基因,转染BMSCs 细胞,通过直接观察目的细胞中eGFP 的表达确定目的基因表达情况。结果显示OPN 转染BMSCs成功,PCR 检测证明OPN 在转基因BMSCs 中高表达。
本研究结果表明,BMSCs 具有促进MHCC97-H 细胞增殖的作用,而经OPN 基因修饰的BMSCs 细胞对MHCC97-H 细胞无明显作用,提示BMSCs 具有促进肝癌细胞增殖的作用,该结果与上海复旦大学研究结果相一致[8]。Fierro 等[9]认为BMSCs 对肿瘤细胞的作用可能是通过旁分泌机制而实现的,BMSCs 分泌碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF)等而起到促进肿瘤增殖的目的。BMSCs 自身缺乏特异性,具有多样分化潜能和分泌功能,它在一定情况下可分化成各种基质细胞,形成肿瘤细胞生长的微环境,有利于肿瘤的生长。Djouad 等[10]认为这是因为BMSCs 存在免疫抑制,促进了肿瘤细胞生长。本课题组前期研究结果也显示,BMSCs 具有促进肝癌细胞TGFβ1 表达而起到促进细胞增殖的作用[11]。
MHCC97-H 侵袭实验结果显示,MHCC97-H 与经OPN 基因修饰BMSCs 细胞共培养后,侵袭能力明显增强,PCR 结果显示外源性OPN 抑制MHCC97-H 细胞释放内源性OPN 因子。OPN 是一种分泌型细胞外基质蛋白,其分子中含有RGD (Arg-Gly-Asp)三肽序列,RGD 可通过与细胞膜表面受体αv、β3整合素结合产生促进转移的作用[12]。BMSCs 产生的外源性OPN 与MHCC97-H 细胞膜表面的αv、β3整合素受体结合,竞争性地抑制肝癌细胞内源性OPN 的释放,肝癌细胞αv、β3表达增高也佐证了竞争性结合的存在。实验表明,外源性OPN 可以促进肝癌细胞的侵袭,可能的机制与3 个方面因素有关:(1)增加瘤细胞与胞外基质相互作用;(2)帮助肿瘤细胞逃避宿主免疫系统的监控,易化侵袭和转移过程;(3)OPN 与整合素αv、β3结合促进组织芽状结构的形成,在肿瘤细胞中可诱导表达VEGF,对促进肿瘤血管生成方面有重要作用,可促进血管形成从而在肿瘤的发生、发展、侵袭及转移中发挥重要作用[13-14]。也有研究认为OPN 诱导整合素的表达变化而起到促进和抑制肿瘤转移的作用[15]。本研究也证实经基因转染的BMSCs 细胞与MHCC97-H共培养后,MHCC97-H 细胞的MMP-2 表达明显增加。有研究认为OPN 通过IκB/IKK 信号激活加快肿瘤细胞周围型胶原等细胞外基质降解,同时激活MMP-2酶原,促进肿瘤转移[16]。因此,有理由相信外源性OPN 表达增加,通过激活IκB/IKK 和增加MMP-2 表达,MMP-2 对促进ECM 降解而发生肿瘤细胞的侵袭、转移。
综上,BMSCs 具有促进MHCC97-H 细胞增殖的作用,OPN 基因转染的BMSCs 细胞具有促进MHCC97-H细胞侵袭的作用。外源性OPN 抑制内源性OPN 表达,外源性OPN 可能通过激活MMP-2 活性而促进肿瘤侵袭的作用。
[1] Niess H,Bao Q,Conrad C,et al. Selective targeting of genetically engineered mesenchymal stem cells to tumor stroma microenvironments using tissue-specific suicide gene expression suppresses growth of hepatocellular carcinoma[J].Ann Surg,2011,254(5):767-774.
[2] Kawashima R,Mochida S,Matsui A,et al. Expression of osteopontin in Kupffer cells and hepatic macrophages and stellate cells in rat liver after carbon tetrachloride intoxication:a possible factor for macrophage migration into hepatic necrotic areas[J]. Biochem Biophys Res Commun,1999,256(3):527-531.
[3] Wang Y,Mochida S,Kawashima R,et al. Increased expression of osteopontin in activated Kupffer cells and hepatic macrophages during macrophage migration in Propionibacterium acnes-treated rat liver[J].J Gastroenterol,2000,35(9):696-701.
[4] Gotoh M,Sakamoto M,Kanetaka K,et al. Overexpression of osteopontin in hepatocellular carcinoma[J]. Pathol Int,2002,52(1):19-24.
[5] Pan HW,Ou YH,Peng SY,et al. Overexpression of osteopontin is associated with intrahepatic metastasis,early recurrence,and poorer prognosis of surgically resected hepatocellular carcinoma[J]. Cancer,2003,98(1):119-127.
[6] Choi D,Kim JH,Lim M,et al. Hepatocyte-like cells from human mesenchymal stem cells engrafted in regenerating rat liver tracked with in vivo magnetic resonance imaging[J]. Tissue Eng Part CMethods,2008,14(1):15-23.
[7] Zohar R,Lee W,Arora P,et al. Single cell analysis of intracellular osteopontin in osteogenic cultures of fetal rat calvarial cells[J]. J Cell Physiol,1997,170(1):88-100.
[8] Sun BS,Ye QH,Liu DY,et al. DNA vector-mediated RNAi inhibiting the expresion of osteopontin and invasion of human hepatoma cells[J].Chin J Exp Surg,2006,23(8):940-942.孙冰生,叶青海,刘道永,等. DNA 载体介导的RNAi 抑制肝癌细胞的骨桥蛋白表达及侵袭性[J]. 中华实验外科杂志,2006,23(8):940-942.
[9] Fierro FA,Kalomoiris S,Sondergaard CS,et al. Effects on proliferation and differentiation of multipotent bone marrow stromal cells engineered to express growth factors for combined cell and gene therapy [J]. Stem Cells,2011,29(11):1727-1737.
[10] Djouad F,Plence P,Bony C,et al. Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals[J].Blood,2003,102(10):3837-3844.
[11] Li TR,Du XK,Song B,et al. Experimental study of TGFβ1 transfected hMSC intervene MHCC97-H[J]. Chin J Gastroenterol Hepatol,2013,22(7):615-619.李天然,杜湘珂,宋斌,等. TGFβ1 转染hMSC 对MHCC97-H 影响的实验研究[J]. 胃肠病学和肝病学杂志,2013,22(7):615-619.
[12] Sodek J,Zhu B,Huynh MH,et al. Novel functions of the matricellular proteins osteopontin and osteonectin/SPARC[J]. Connect Tissue Res,2002,43(2-3):308-319.
[13] Akutagawa N,Nishkawa A,Iwasaki M,et al. Expression of vascular endothelial growth factor and E-cadhern in human ovarian cancer:association with ascites fluid accumulation and peritoneal dissemination in mouse ascites model [J]. Jpn J Cancer Res,2002,93(6):644-651.
[14] Le QT,Sutphin PD,Raychaudhuri S,et al. Identification of osteopontion as a prognostic plasma marker for head and neck squamous cell carcinomas[J]. Clin Cancer Res,2003,9(1):59-67.
[15] Apte UM,Banerjee A,McRee R,et al. Role of osteopontin in hepatic neutrophil infiltration during alcoholic steatohepatitis[J]. Toxicol Appl Pharmacol,2005,207(1):25-38.
[16] Rangaswami H,Bulbule A,Kundu GC. Nuclear factor-inducing kinase plays a crucial role in osteopontin-induced MAPK/I kappa B alpha kinase-dependent nuclear factor kappa B-mediated promatrix metalloproteinase-9 activation [J]. J Biol Chem,2004,279 (37):38921-38935.
