TGF-β1 通过cyclin D3 对肝细胞癌增殖能力的双重调控作用机制
2015-12-31徐桂芳刘韬韬沈锡中
王 轶,徐桂芳,张 斌,刘韬韬,沈锡中
1.南京大学医学院附属鼓楼医院消化科,江苏 南京210008;2.复旦大学附属中山医院消化科
转化生长因子β(transforming growth factor-β,TGF-β)是一种高度保守的基因,人与小鼠的TGF-β 具有高度同源性[1-2]。TGF-β 具有3 种同源异构体,分别为TGF-β1、TGF-β2 和TGF-β3,在这3 种同源异构体中以TGF-β1 的研究最为透彻。TGF-β1 一直是肿瘤研究领域的热点,目前认为在肿瘤形成早期TGF-β1对肿瘤具有抑制作用,但在肿瘤形成晚期TGF-β1 又可以促进肿瘤的进展[3]。既往研究表明包括肝癌在内的多种恶性肿瘤细胞具有分泌TGF-β1 的功能,因此明确TGF-β1 如何调控肝细胞癌的增殖对恶性肿瘤的治疗具有重要意义。
细胞周期素cyclin D3 在调控细胞增殖过程中具有重要作用,是肿瘤细胞由G1期进入S 期的重要调节因子[4]。本研究发现TGF-β1 对肿瘤的增殖具有双重调节作用,阻断其下游Smad 信号通路时肝细胞癌的增殖能力显著增强,表明TGF-β1 对肝细胞癌具有抑制作用;而下调肝细胞癌细胞TGF-β1 表达后则导致细胞周期阻滞,细胞增殖能力减弱。利用Western blotting 对细胞周期素进行检测表明TGF-β1 具有双重调控cyclin D3 表达的作用。因此cyclin D3 有可能是TGF-β1 对肝细胞癌细胞产生双重调节作用的重要作用位点,TGF-β1 及其下游的信号通路有可能成为肝细胞癌治疗的潜在靶点。
1 材料与方法
1.1 材料
1.1.1 细胞系:人肝细胞癌细胞株PLC/PRF/5 及小鼠肝细胞癌细胞株Hepa 1-6 购自中科院上海细胞库,人肝细胞癌细胞株Huh-7 由复旦大学附属中山医院内科学实验室惠赠。
1.1.2 主要试剂:DMEM 培养基和胎牛血清购自美国Gibco 公司,TGF-β1 一抗及Alexa-488 标记荧光二抗购自美国Santa Cruz 公司,TGF-β1-knockdown 慢病毒颗粒购自上海吉玛公司,TGF-β1 受体磷酸化酶抑制剂LY-364947 购自德国Merck 公司,细胞周期检测试剂盒购自美国BD 公司。
1.1.3 仪器设备:荧光显微镜购自德国蔡司公司,FACS Calibur 流式细胞仪为美国BD 公司产品,Western blotting 电泳仪购自美国Bio-Rad 公司。
1.2 方法
1.2.1 免疫荧光检测:肝细胞癌细胞以1 ×105/孔浓度铺于24 孔板中,24 h 后取出爬片丙酮固定后PBS洗2 次,10% 山羊血清封闭1 h,加入TGF-β1 一抗(1∶200 稀释),4 ℃孵育过夜,PBS 洗2 次,加入Alexa-488 标记荧光二抗室温孵育2 h,荧光显微镜检测TGFβ1 在细胞中的表达情况。
1.2.2 建立TGF-β1 下调肝细胞癌细胞株:细胞以1 ×105/孔浓度铺入24 孔板中,24 h 后用含有6 μg/ml polybrene 的0.5 ml 新鲜培养基替换原有培养基,并加入40 μl 病毒颗粒,4 h 后加入0.5 ml 新鲜培养基稀释,24 h 后换液,3 d 后使用含有2 μg/ml 嘌呤霉素的新鲜培养基筛选细胞72 h,筛选完成后扩增细胞并real-time PCR 检测干扰效率。
1.2.3 克隆形成实验:消化并计数Hepa 1-6、scramble、shRNA-TGF-β1-Hepa 1-6 3 株细胞,6 孔板中以103/孔浓度铺板,部分孔内加入5 μmol/L LY-364947以阻断TGF-β1 下游Smad 信号通路,每3 d 更换培养基1 次,14 d 后弃上清,4%多聚甲醛固定并0.5%结晶紫染色。
1.2.4 细胞周期实验:消化细胞并计数Hepa 1-6、scramble、TGF-β1-knockdown Hepa 1-6 3 株细胞,6 孔板中以0.2 ×105/孔浓度铺板,部分Hepa 1-6 细胞培养基中加入5 μmol/L LY-364947,培养24 h 后胰酶消化收集细胞,PBS 清洗2 遍后加入PI 染料,室温孵育30 min 后流式细胞检测细胞周期,结果使用Modfit 软件拟合。
1.2.5 Western blotting 实验:Hepa 1-6、scramble、TGFβ1-knockdown Hepa 1-6 3 株细胞以3 × 106/瓶(25 mm2普通培养瓶)的浓度进行铺板,2 d 后收集蛋白,免疫印迹法分别检测cyclin-D3 蛋白表达情况。
1.3 统计学分析 采用SPSS 14.0 软件进行数据分析,使用t 检验对两组间数据进行比较,P <0.05 为差异有统计学意义。
2 结果
2.1 肝细胞癌细胞分泌TGF-β1 能力测定结果 为明确肝细胞癌细胞分泌TGF-β1 的能力,本实验随机选取Huh-7、PLC/PRF/5、Hepa 1-6 3 株肝细胞癌细胞进行免疫荧光检测,结果表明上述3 株细胞均具有分泌TGF-β1 的能力(见图1)。
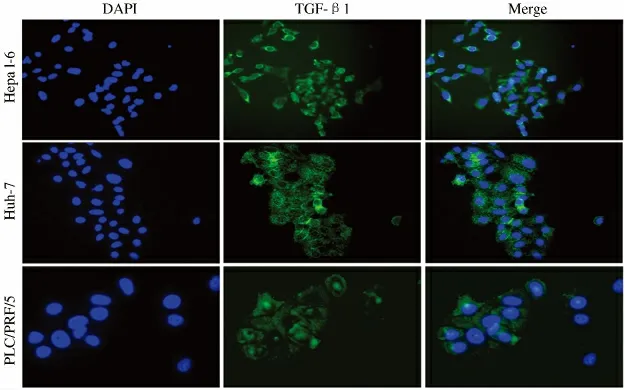
图1 免疫荧光检测肝细胞癌细胞株表达TGF-β1 的能力(200 ×)Fig 1 The ability of the expression of TGF-β1 in hepatocellular carcinoma cell by immune flouorescence (200 ×)
2.2 下调及阻断TGF-β1 对肝细胞癌细胞克隆形成能力的影响 我们首先建立了TGF-β1-knockdown Hepa 1-6 肝细胞癌细胞及其随机对照序列scramble组,real-time PCR 验证结果表明75%左右的TGF-β1 mRNA 被敲除(见图2A)。利用上述细胞及TGF-β1受体磷酸化酶抑制剂LY-364947 进行克隆形成实验,结果表明敲除TGF-β1 后Hepa 1-6 细胞克隆形成能力显著减弱,而使用5 μmol/L LY-364947 干预后可以显著抑制TGF-β1 对细胞增殖的抑制作用(见图2)。

图2 Hepa 1-6 细胞克隆形成能力 A:real-time PCR 检测慢病毒介导的RNA 干扰效率;B:5 μmol/L LY-364947 干预后的Hepa 1-6细胞;C:对照组Hepa 1-6 细胞;D:干扰了TGF-β1 后的Hepa 1-6 细胞Fig 2 The clone formation of Hepa 1-6 A:real-time PCR was used to detect the RNA interfering efficiency;B:Hepa 1-6 cells cultured with 5 μmol/L LY-364947;C:Hepa 1-6 cells of control group;D:knock-down Hepa 1-6 cells
2.3 下调及阻断TGF-β1 对肝细胞癌细胞周期的影响 使用LY-364947 阻断TGF-β1 下游信号后G1期细胞明显减少[(29. 73 ± 0. 01)% vs (36. 03 ±0.02)%,P <0.05],S 期细胞较对照组明显增多[(63.28% ±0.02)% vs(57.09 ±0.01)%,P <0.05]。与之相反,下调TGF-β1 后G1期细胞则显著增多[(43.75±0.02)% vs(35.95 ±0.02)%,P <0.05],出现G1期阻滞,而处于S 期的细胞则明显减少[(54.64 ±0.01)%vs(61.29 ±0.01)%,P <0.05](见图3)。
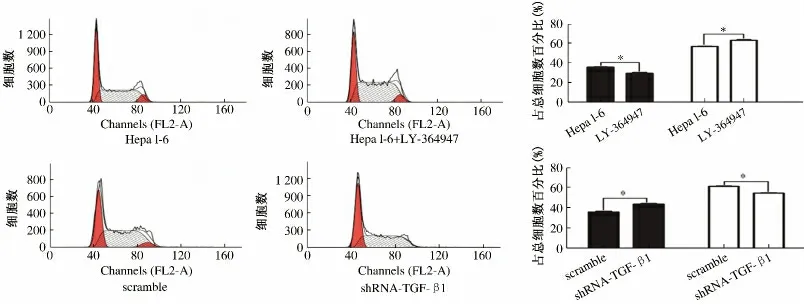
图3 Hepa 1-6 细胞周期的变化 A:细胞周期直方图;B:加用5 μmol/L LY-364947 阻断TGF-β1 下游信号后Hepa 1-6 细胞G1 期减少S 期增多,而下调TGF-β1 以后G1 期细胞增多,S 期细胞减少Fig 3 The cell cycle of Hepa 1-6 cells A:Histogram;B:cultured with 5 μmol/L LY-364947 leaded to G1 phase arrested and S phase increased,but knock-down TGF-β1 had an opposite
2.4 TGF-β1 信号通路对cyclin D3 基因表达的影响
Western blotting 检测发现:与对照组相比,LY-364947 干预48 h 后Hepa 1-6 肝细胞癌细胞的cyclin D3 表达量较对照组增加约1.8 倍,而干扰了TGF-β1表达后cyclin D3 蛋白的表达仅为scramble 对照组的0.3 倍,差异有统计学意义(P <0.05,见图4)。

图4 Western blotting 检测不同干预条件下cyclin D3 表达变化Fig 4 Western blotting detected the expression of cyclin D3 in different conditions
3 讨论
肝癌是全世界范围内最常见的恶性肿瘤之一,由于我国乙肝高发,每年有近30 万患者死于肝癌及其相关并发症[5]。近年来得益于影像学以及相关诊断手段的进步,肝癌的早期诊断有了长足的进步,许多直径<3 cm 的肝癌被早期发现[6]。但即便是对接受肝癌切除手术的患者来说,其总体的5 年生存率仍不容乐观,仅占40%左右[7-8],大多数患者最终仍死于肿瘤的复发及转移。由于肝癌对化疗药物不敏感,因此中晚期肝癌患者的治疗手段有限,目前仅有肝动脉栓塞化疗及索拉菲尼被证明有效[9-10]。
TGF-β1 及其下游信号通路一直以来都被认为是肿瘤治疗的潜在靶点之一[11-12]。一方面TGF-β1 可以通过促进上皮细胞间叶化(epithelial-to-mesenchymal transformation,EMT)、促进血管生成以及抑制机体免疫监视作用来增强肿瘤的远处转移及侵袭能力[13];另一方面其对肿瘤细胞的增殖同样具有显著抑制作用,而这主要通过TGF-β1 激活下游Smad 信号通路来实现[14]。
与既往研究相同,在本实验中我们发现多株肝细胞癌细胞具有分泌TGF-β1 的能力[15-16]。通过克隆形成实验我们发现,下调TGF-β1 基因后肝细胞癌细胞形成克隆能力显著减弱。与此相反,阻断TGF-β1 下游Smad 信号则能显著促进癌细胞增殖,克隆形成能力增强。并且细胞周期实验表明阻断TGF-β1 后肝癌细胞G1期减少,而下调TGF-β1 则导致G1期阻滞。以上数据均表明虽然TGF-β1 对肝细胞癌细胞具有抑制作用,但在细胞的增殖过程当中却不可或缺。而Western blotting 结果表明阻断TGF-β1 下游信号能够促进cyclin D3 表达,该结果与细胞周期结果相吻合。因此仅阻断TGF-β1 下游信号通路有可能削弱TGFβ1 对肿瘤增殖能力的抑制作用,反而促进肿瘤进展。而cyclin D3 则有可能位于两条信号通路的交叉点,TGF-β1 有可能通过对其调控进而完成对肝细胞癌细胞增殖能力的的双重调控作用。
TGF-β1 一直以来都是肿瘤分子靶向治疗的热点之一,但鲜有药物成功应用于临床。这主要是由于TGF-β1 对肿瘤具有双重调控作用[17],既往临床试验多集中在阻断下游Smad 信号通路,这反而有可能削弱TGF-β1 对肿瘤的抑制作用。本实验证明仅阻断TGF-β1 下游Smad 信号通路反而增强了肝细胞癌细胞的增殖能力,但从根本上削弱肿瘤细胞分泌TGF-β1则能抑制癌细胞的增殖能力。因此今后的相关研究应该聚焦于TGF-β1 上游信号通路,明确肿瘤细胞高表达TGF-β1 的原因,并且给予相应的抑制剂,或许有可能从根本上削弱肿瘤细胞的增殖能力,从而达到对肝癌的治疗作用。
[1] Barton DE,Foellmer BE,Du J,et al. Chromosomal mapping of genes for transforming growth factors beta 2 and beta 3 in man and mouse:dispersion of TGF-beta gene family[J]. Oncogene Res,1988,3(4):323-331.
[2] Newfeld SJ,Wisotzkey RG,Kumar S. Molecular evolution of a developmental pathway:phylogenetic analyses of transforming growth factorbeta family ligands,receptors and Smad signal transducers[J]. Genetics,1999,152(2):783-795.
[3] Yang YA,Dukhanina O,Tang B,et al. Lifetime exposure to a soluble TGF-beta antagonist protects mice against metastasis without adverse side effects[J]. J Clin Invest,2002,109(12):1607-1615.
[4] Sankaran VG,Ludwig LS,Sicinska E,et al. Cyclin D3 coordinates the cell cycle during differentiation to regulate erythrocyte size and number[J]. Genes Dev,2012,26(18):2075-2087.
[5] Centers for Disease Control and Prevention. Progress in hepatitis B prevention through universal infant vaccination-China,1997-2006 [J].MMWR Morb Mortal Wkly Rep,2007,56(18):441-445.
[6] Qian LX,Liu YJ,Ding HG. Advances in imaging diagnosis of small hepatocellular carcinoma[J]. World Chinese Journal of Digestology,2010,18(5):479-486.钱林学,刘玉江,丁惠国. 小肝癌的影像学诊断进展[J]. 世界华人消化杂志,2010,18(5):479-486.
[7] Llovet JM,Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008 [J]. J Hepatol,2008,48 (Suppl 1):S20-S37.
[8] Fan J,Zhou J,Wu ZQ,et al. Surgical treatment of primary hepatocellular carcinoma:a 20-year experience in 7566 patients[J]. Chin J Dig Surg,2009,2(8):99-102.樊嘉,周俭,吴志全,等.原发性肝癌的外科治疗:20 年7566 例的临床经验[J].中华消化外科杂志,2009,8(2):99-102.
[9] Llovet JM,Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma:Chemoembolization improves survival[J]. Hepatology,2003,37(2):429-442.
[10] Palmer DH. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med,2008,359(23):2498-2499.
[11] Juárez P,Guise TA. TGF-beta in cancer and bone:implications for treatment of bone metastases[J]. Bone,2011,48(1):23-29.
[12] Connolly EC,Freimuth J,Akhurst RJ. Complexities of TGF-beta targeted cancer therapy[J]. Int J Biol Sci,2012,8(7):964-978.
[13] Cicchini C,Laudadio I,Citarella F,et al. TGFbeta-induced EMT requires focal adhesion kinase (FAK)signaling[J]. Exp Cell Res,2008,314(1):143-152.
[14] Derynck R,Akhurst RJ,Balmain A. TGF-beta signaling in tumor suppression and cancer progression[J]. Nat Genet,2001,29(2):117-129.
[15] SaccoR,Leuci D,Tortorella C,et al. Transforming growth factor beta 1 and soluble Fas serum levels in hepatocellular carcinoma[J]. Cytokine,2000,12(6):811-814.
[16] Shirai Y1,Kawata S,Tamura S ,et al. Plasma transforming growth factor-beta 1 in patients with hepatocellular carcinoma. Comparison with chronic liver diseases[J]. Cancer,1994,73(9):2275-2279.
[17] Akhurst RJ,Derynck R. TGF-β signaling in cancer-a double edged sword[J]. Trends Cell Biol,2001,11(11):S44-S51.
