启动子区甲基化和组蛋白乙酰化对人食管鳞癌细胞SFRP1 基因表达的影响
2015-12-31朱圣韬张澍田
孟 莹,朱圣韬,李 鹏,张澍田
首都医科大学附属北京友谊医院消化科,国家消化系统疾病临床医学研究中心,北京市消化疾病中心,消化疾病癌前病变北京市重点实验室,北京100050
分泌型卷曲蛋白家族(secreted frizzled-related proteins,SFRPs)是Wnt 信号途径的调节剂,可通过竞争性抑制Frizzled 受体而抑制Wnt 的活动,参与多种肿瘤的发生。近年来,多个研究发现SFRP1 基因启动子区高甲基化导致的基因沉默可能与肿瘤的发生有关[1-3]。本研究目的是观察SFRP1 基因表达及启动子区甲基化在食管鳞癌(esophageal squamous cell carcinoma,ESCC)中的表达情况,探讨DAC 及TSA 对SFRP1 基因表达的影响,从而进一步明确SFRP1 基因在ESCC 发病机制中的作用,为ESCC 的诊治提供新的可能的方向。
1 材料与方法
1.1 材料
1.1. 1 细胞:人类ESCC 细胞株EC109、EC9706、KYSE30、KYSE70、KYSE150、KYSE410、KYSE510、TE-1、TE-13 由中国医学科学院肿瘤研究所惠赠。Heec购自Sciencell(美国),Het-1A 细胞购自ATCC(美国)。1.1.2 主要试剂和药品:5-氮杂脱氧胞苷(DAC)和曲古抑菌素(TSA)购自Sigma 公司;Anti-acetyl-Histone H3 和H4 购自Millipore 公司;染色质免疫共沉淀试剂盒购自Millipore 公司。
1.2 方法
1.2.1 细胞培养:EC109、EC9706、KYSE30、KYSE70、KYSE150、KYSE410、KYSE510、TE-1、TE-13 细胞株经复苏后于含10%胎牛血清的RPMI 1640 培养基中培养并传代。Heec、Het-1A 复苏后于各自专用培养基中培养。
1.2.2 逆转录-聚合酶链反应(RT-PCR)检测SFRP1 mRNA 表达:按TRIzol 试剂说明书提取各细胞系总RNA,并按照逆转录试剂盒说明将RNA 逆转录成cDNA。PCR 反应条件为:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,共35 个循环,72℃延伸7 min。PCR 产物进行2%琼脂糖凝胶电泳,GAPDH 作为内参照,其引物及退火温度见表1。

表1 引物序列表Tab 1 Sequences for primers used in this study
1.2.3 DNA 提取及亚硫酸盐修饰:使用细胞基因组DNA 提取试剂盒(TIANGEN DP208,中国),按说明书进行。亚硫酸盐修饰采用CpGenome DNA 修饰试剂盒(Chemicon,CA,USA),按说明书进行。修饰好的DNA 用于进一步的测序和MSP 分析。
1.2.4 甲基化分析:甲基化特异性PCR 方法(methylation-specific PCR,MSP)分析组织SFRP1 基因甲基化状态。引物序列见表1,引物由上海生工生物技术有限公司合成。PCR 反应条件95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环,最后72 ℃延伸7 min。2%琼脂糖凝胶电泳,紫外凝胶成像系统观察PCR 产物条带的位置。
1.2.5 DAC 及TSA 处理EC9706 细胞:EC9706 细胞株保存于液氮中,临用前取出复苏,含10%胎牛血清的RPMI 1640 培养基,按常规方法置于37℃、5% CO2混合气体恒温培养箱中进行培养。细胞每1 ~2 d 换液一次。每2 ~3 d 以0.25%的胰蛋白酶消化,按1∶4传代,接种在新培养瓶内。
单独给药时,将EC9706 细胞株分别与去甲基化制剂DAC 10 μmol/L 及组蛋白去乙酰化酶抑制剂TSA 0.3 μmol/L、1 μmol/L 共同孵育24 h 和72 h。DAC、TSA 联合应用时,则将DAC 10 μmol/L 与EC9706 细胞株共同孵育72 h 后加用TSA 0.3 μmol/L、1 μmol/L与EC9706 细胞株共同孵育24 h。各浓度药物处理细胞后,每24 h 更换含药物的培养液一次。用倒置显微镜观察细胞生长情况及形态学变化,并且提取细胞总RNA 及用RT-PCR 方法检测SFRP1 mRNA 表达恢复情况。
1.2.6 染色质免疫共沉淀方法检测EC9706 细胞组蛋白乙酰化情况:采用ChIP 试剂盒进行检测,按说明书进行。计数大约3 ×106EC9706 细胞,甲醛交联组蛋白和DNA,超声破碎细胞和剪切DNA,用1%琼脂糖凝胶电泳鉴定超声破碎效果。加入乙酰化组蛋白H3 抗体或乙酰化组蛋白H4 抗体沉淀,收集抗体绑定的组蛋白-DNA 复合物,逆转组蛋白-DNA 交联,用蛋白酶K 处理和纯化DNA,设计SFRP1 启动子区域的引物,引物序列见表1,PCR 方法鉴定已纯化的DNA,并用2%琼脂糖凝胶电泳,回收琼脂糖凝胶PCR 产物,连接T 载体,进行产物转化及蓝白斑筛选,鉴定阳性重组子和测序确认。
1.3 统计学方法 采用SPSS 13.0 统计软件进行分析。计数资料用s 描述,两组间变量比较采用t 检验。率的比较采用χ2检验。P <0.05为差异有统计学意义。
2 结果
2.1 ESCC 细胞系及永生化食管上皮细胞系中SFRP1 mRNA 的表达 EC109、EC9706、KYSE30、KYSE70、KYSE150、KYSE410、KYSE510、TE-1、TE-13细胞株中均未见SFRP1 mRNA 表达,而Het-1A、Heec中可见其表达(见图1)。
2.2 ESCC 细胞株及永生化食管上皮细胞株中SFRP1 基因启动子区甲基化状态 MSP 方法检测ESCC细胞株及永生化食管上皮细胞株中SFRP1 基因启动子区甲基化状态(见图2)。EC109、EC9706、KYSE30、KYSE150、KYSE410、KYSE510、TE-1、TE-13均只见M 条带、U 条带未见;Het-1A、Heec U 条带亮,M 条带隐约可见;KYSE70 均可见U 和M 条带。

图1 ESCC 各细胞系及永生化食管上皮细胞系中SFRP1 基因的RT-PCR 电泳图Fig 1 Expression of the SFRP1 gene in ESCC cell lines,with GAPDH as a control

图2 MSP 方法示ESCC 各细胞株及永生化食管上皮细胞株中SFRP1 基因启动子区甲基化状态凝胶电泳图 U:非甲基化条带;M:甲基化条带Fig 2 Promoter hypermethylation of SFRP1 gene was shown in ESCC cell lines and two immortalized human esophageal epithelial cell lines (Het-1A and Heec) U:unmethylated;M:methylated
2.3 DAC 和TSA 干预对ESCC 细胞的影响 根据各株细胞SFRP1 表达水平及启动子区甲基化水平差异,选择高甲基化同时SFRP1 mRNA 无表达的EC9706 细胞株作为进一步研究对象。去甲基化制剂DAC 10 μmol/L 或组蛋白去乙酰化酶抑制剂TSA 0.3 μmol/L、1 μmol/L 分别单独与EC9706 细胞株共同孵育72 h 和24 h 后,用RT-PCR 检测细胞株中SFRP1 mRNA 表达恢复情况,结果发现EC9706 细胞株SFRP1 mRNA 无明显变化(见图3A)。DAC 10 μmol/L 和TSA 联合应用,即DAC 10 μmol/L 与EC9706 细胞株共同孵育72 h 后加用TSA 0.3 μmol/L、1 μmol/L 与EC9706 细胞株共同孵育24 h,再次检测细胞株中SFRP1 mRNA 表达恢复情况,结果可见EC9706 细胞株SFRP1 mRNA 恢复表达(见图3B)。
2.4 EC9706 细胞株中SFRP1 基因启动子区组蛋白乙酰化状态 采用染色质免疫共沉淀技术分析EC9706 细胞株中SFRP1 基因启动子区域组蛋白乙酰化状态。分别用乙酰化组蛋白H3 抗体、乙酰化组蛋白H4 抗体沉淀DNA 作为模板进行PCR,兔IgG 作为阴性对照,每次实验均带有内对照(Input)。PCR 鉴定结果进行琼脂糖凝胶电泳,结果如图4 所示。PCR 产物回收后进行连接测序,结果符合SFRP1 基因启动子区序列。
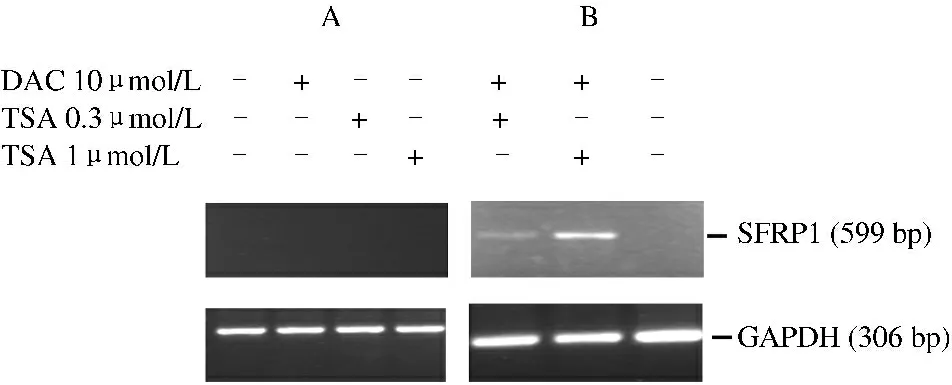
图3 DAC 和TSA 干预对EC9706 细胞株中SFRP1 mRNA表达影响的RT-PCR A:DAC 和TSA 单独干预EC9706 细胞株中后,未见EC9706 细胞株SFRP1 mRNA 表达恢复;GAPDH:内参照;B:DAC 10 μmol/L 与TSA 0.3 μmol/L、1 μmol/L 联合干预后,可见EC9706 细胞株SFRP1 mRNA 表达恢复Fig 3 Re-expression of SFRP1 mRNA in EC9706 after treatment with DAC and/or TSA by RT-PCR A:EC9706 cells were treated with DAC and TSA alone,with GAPDH as a control;B:EC9706 cells were treated with DAC and TSA together

图4 EC9706 细胞株中SFRP1 基因启动子区域组蛋白H3、H4 乙酰化状态ChIP 结果 H3Ac、H4Ac:实验对象;NAC:阴性对照;IN:内对照Fig 4 Histone modification analysis at CpG islands of the SFRP1 promoter region by ChIP assay H3Ac,H4Ac:experimental object;NAC:negative control;IN:internal control
3 讨论
SFRP1 基因位于染色体8p12-11.1,该位点在多种肿瘤中缺失,被认为可能是一个抑癌基因[4-5]。抑癌基因表达沉默是肿瘤发生过程中一个重要的发病机制,而DNA 甲基化是抑癌基因表达沉默的重要途径。Suzuki 等[2-3]研究认为启动子区高甲基化所介导的转录沉默是结直肠癌SFRP1 水平降低的主要机制;乳腺癌中也可见类似的研究结果。
本研究中我们发现SFRP1 基因作为一个可能的抑癌基因,在ESCC 细胞株中完全不表达,而在永生化食管上皮细胞中可以检测到该基因的明显表达,表明该基因存在转录水平表达改变,提示SFRP1 基因可能作为一个抑癌基因,在ESCC 发病机制中发挥一定作用。同时,MSP 研究发现,ESCC 肿瘤细胞系中存在SFRP1 基因启动子区高甲基化,而在永生化人类食管上皮细胞系中甲基化程度极低。提示启动子区甲基化可能与ESCC 中SFRP1 基因的表达异常相关。Ishii等[6]研究发现SFRP1 在ESCC、上皮内瘤变及正常组织中均存在启动子区高甲基化,甲基化程度呈逐渐降低趋势,这和我们的研究结果相一致。
研究表明DNA 高甲基化可被许多因素调控,去甲基化制剂是最常见的一种干预手段,可使部分表达沉默的抑癌基因表达恢复。5 氮杂脱氧胞苷是有效的甲基转移酶抑制剂,能时间和剂量依赖性地引起CpG 岛过甲基化的抑癌基因去甲基化,从而恢复其mRNA 和蛋白质的表达,在基因表达调控、DNA 修复、基因稳定等方面起重要作用[7]。TSA 是一种常用的组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂,能够抑制HDAC 活性,使组蛋白高度乙酰化,以此来调节基因表达。近年来,研究发现CpG 岛甲基化和组蛋白修饰既可独立存在,也能相互影响[8]。有研究认为,DNA 甲基转移酶抑制剂和组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂联合应用对恢复抑癌基因表达的作用可高于单独应用某一种[9-10]。
我们选择SFRP1 基因mRNA 不表达且同时存在基因启动子区高甲基化的EC9706 细胞株作为进一步研究对象,单独给予DAC 及TSA 处理,均未能恢复SFRP1 基因的表达;但联合DAC 和TSA 共同处理该细胞株后,SFRP1 基因表达却得到了恢复,表明基因启动子区甲基化和组蛋白乙酰化修饰可能共同参与了SFRP1 基因的转录调控。国内外其他研究也发现联合应用DAC 及TSA 可有效恢复Wnt 相关基因mRNA 再表达[11-12]。
为进一步说明组蛋白乙酰化和DNA 甲基化共同参与了SFRP1 在EC9706 细胞中的转录表达的调控过程,我们还用ChIP 方法以乙酰化组蛋白H3、H4 抗体免疫沉淀染色质片段,然后PCR 扩增SFRP1 基因启动子区,扩增出SFRP1 基因启动子区片段后进行克隆测序,测序结果证实为SFRP1 基因启动子区序列,从而表明SFRP1 基因启动子区结合有乙酰化组蛋白H3 及H4,进一步说明组蛋白乙酰化和DNA 甲基化共同参与了SFRP1 在EC9706 细胞中的转录表达的调控过程。
综上所述,本研究结果证实,ESCC 中存在SFRP1基因的表达下调和SFRP1 基因启动子区高甲基化及组蛋白乙酰化,去甲基化制剂DAC 和HDAC 抑制剂共同作用可恢复SFRP1 基因转录表达。从实验中我们可以进一步推测,SFRP1 基因作为一个可能的抑癌基因,其异常表达和启动子区高甲基化可能通过Wnt 通路参与了ESCC 的发病过程,未来可能为ESCC 患者的诊治提供新的方向,但仍需要进一步的实验及临床研究来证实。
[1] Valcz G,Patai AV,Kalmár A,et al. Myofibroblast-derived SFRP1 as potential inhibitor of colorectal carcinoma field effect[J]. PLoS One,2014,9 (11):e106143.
[2] Suzuki H,Gabrielson E,Chen W,et al. A genomic screen for genes upregulated by demethylation and histone deacetylase inhibition in human colorectal cancer[J]. Nat Genet,2002,31(2):141-149.
[3] Wang S,Dorsey TH,Terunuma A,et al. Relationship between tumor DNA methylation status and patient characteristics in African-American and European-American women with breast cancer[J]. PLoS One,2012,7(5):e37928.
[4] Armes JE,Hammet F,de Silva M,et al. Candidate tumor-suppressor genes on chromosome arm 8p in early-onset and high-grade breast cancers[J]. Oncogene,2004,23(33):5697-5702.
[5] Awakura Y,Nakamura E,Ito N,et al. Methylation-associated silencing of SFRP1 in renal cell carcinoma[J]. Oncol Rep,2008,20(5):1257-1263.
[6] Ishii T,Murakami J,Notohara K,et al. Oesophageal squamous cell carcinoma may develop within a background of accumulating DNA methylation in normal and dysplastic mucosa[J]. Gut,2007,56(1):13-19.
[7] Fulda S,Kufer MU,Meyer E,et al. Sensitization for death receptoror drug-induced apoptosis by re-expression of caspase-8 through demethylation or gene transfer [J]. Oncogene,2001,20 (41):5865-5877.
[8] Sarkar S,Horn G,Moulton K,et al. Cancer development,progression,and therapy:an epigenetic overview[J]. Int J Mol Sci,2013,14(10):21087-21113.
[9] Steele N,Finn P,Brown R,et al. Combined inhibition of DNA methylation and histone acetylation enhances gene re-expression and drug sensitivity in vivo[J]. Br J Cancer,2009,100(5):758-763.
[10] Cameron EE,Bachman KE,Myohanen S,et al. Synergy of demethylation and histone deacetylase inhibition in the re-expression of genes silenced in cancer[J]. Nat Genet,1999,21(1):103-107.
[11] Gotze S,Wolter M,Reifenberger G,et al. Frequent promoter hypermethylation of Wnt pathway inhibitor genes in malignant astrocytic gliomas[J]. Int J Cancer,2010,126(11):2584-2593.
[12] Qi J,Zhu YQ,Luo J,et al. The role of secreted Wnt-antagonist genes hypermethylation in early detection of colorectal tumor [J].Zhonghua Yi Xue Za Zhi,2007,87(28):1954-1957.
