植物提取物对反刍动物瘤胃发酵和甲烷产量的影响
2015-12-31李艳玲北京农学院动物科学技术学院北京102206
贾 淼,鲁 琳,李艳玲(北京农学院动物科学技术学院,北京 102206)
专论与综述
植物提取物对反刍动物瘤胃发酵和甲烷产量的影响
贾 淼,鲁 琳,李艳玲
(北京农学院动物科学技术学院,北京 102206)
植物提取物中含有丰富的挥发油、生物碱、萜类、皂苷等化学物质,具有抗菌、促生长、抗氧化和提高免疫力等功能,对反刍动物具有调节发酵模式、提高蛋白利用率、减少甲烷排放等功能,在反刍动物瘤胃调控方面发挥着积极作用。文章针对植物提取物对反刍动物瘤胃发酵和甲烷产量的调控进行了综述。
植物提取物;瘤胃发酵;甲烷产量
随着化学添加剂在饲料行业中应用的不断增加,使得动物产品中化学物质和抗生素等问题慢慢凸显,人们意识到这些物质在动物制品中的残留会对人类健康造成一定的影响,而植物提取物以其天然无残留的特性逐渐受到人们的广泛关注。植物提取物在反刍动物日粮中添加的比例很小,但其含有的活性物质在改善瘤胃发酵、提高反刍动物生产性能等方面发挥着重要作用[1]。近年来,使用天然植物提取物替代抗生素在动物生产中的应用逐渐成为国内外研究的焦点。
人类对于植物提取物的应用有着悠久的历史,然而直到20世纪初,科学家才发现植物精油具有抗菌特性,之后很多具有高抗生素活性的植物精油被研究[2]。近年来,植物提取物在动物营养方面的应用和研究也越来越多。在反刍动物上的研究表明,在饲料中添加植物提取物可以提高氮代谢、降低甲烷产量并改善瘤胃发酵等,从而有效改善动物的健康和生长效率[3]。本文将重点综述植物提取物对瘤胃发酵和甲烷产量的影响。
1 植物提取物
1.1 植物提取物的定义
植物提取物通常也称植物益生素或中草药,是通过物理、化学和生物学等手段从植物中提取的活性成分,其含量相对稳定、成分明确、可测定,对动物和人类无毒副作用。主要由少量植物的组成成分及其代谢产生的次级产物组成。次级代谢产物主要是指不参加与生殖生长有关的主要化学过程的一类低分子量化学产物。这类化合物有可能作为防御系统来抵御生理、环境、食物链上游和病原体的应激压力,使植物与周围环境和谐共存。除了少数有毒的化合物外,几种主要存在于植物中的次生代谢物在食品和哺乳动物代谢中都有积极的有益作用。
1.2 植物提取物的分类
到目前为止,植物次级代谢产物已经发现了数千种,但由于它们的合成途径、性质特点和作用机理相似,所以很难将它们明确分类。通常只是从化学结构的角度将它们分为皂苷、单宁和植物精油3大类[4]。
1.2.1 皂苷 皂苷(saponin)主要是植物产生的次生物质,一些低等海洋动物和细菌也可产生[5]。它们在水溶液中可像肥皂那样产生稳定的泡沫,因此将其命名为“皂苷”。它是一种高分子量的糖苷,是以三萜或甾体类的糖苷配基(皂苷元)与糖链相连而成,这些皂苷元含有一个或更多的C-C键,皂苷的化学结构见图1[6]。皂苷存在于植物的多个部位,例如根、块茎、表皮、叶、种子和果实。
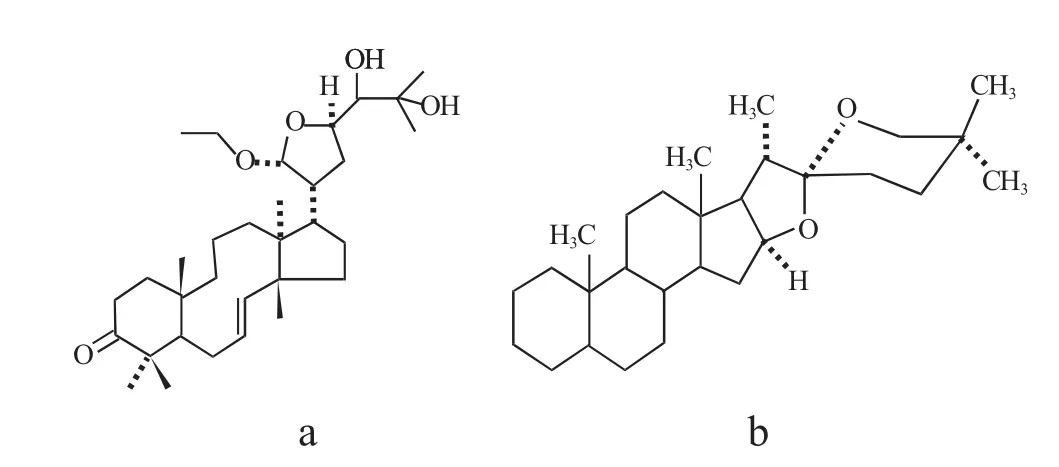
图1 皂苷的化学结构
1.2.2 单宁单宁(tannin)又称单宁酸、鞣质,是高分子量水溶性的多酚类化合物,其具有沉淀蛋白质的作用。单宁广泛分布于具有营养价值的饲用树、灌木、豆科植物和粮食作物中,而单宁的存在往往限制它们在饲料方面大量使用。按化学结构的不同,单宁可分为两类:一是可水解单宁,是没食子酸的衍生物,是没食子酸部分或全部酯化到一个核心的糖醇中,例如葡萄糖、葡萄糖醇、奎宁酸、栎醇和莽草酸[7];二是缩合单宁,可分为原花青素(两个、三个或聚合的花青素和/或黄烷-3-醇单元组成)和无色花色素(黄烷-3与4-二醇黄酮类化合物的二聚体)[7]。单宁的化学结构见图2。构成单宁的基本单元的数量不一,这决定了从2个、3个和4个黄酮类化合物到更高的低聚体的聚合程度。这种基本单元数量的不一,使得缩合单宁具有难以计数的各种化学结构,使不同单宁产生不同的生物学特性。
植物单宁主要存在于植物体的皮、根、叶、壳和果肉中。山竹果皮、番石榴、暹罗尼姆树叶中含11.4%到16.8%的浓缩丹宁。缩合丹宁在世界许多植物中都有发现。
1.2.3 植物精油和皂苷、单宁一样,植物精油(essential oil)是一类存在于植物中并具有芳香气味、可随水蒸气蒸馏出来但又不溶于水的挥发性油状物质的总称,它是从植物的花、叶、茎、根或果实中,可以通过一系列物理方法将其中的挥发性芳香物质提炼萃取出来,是植物提取物中重要的活性成分之一[8]。
植物精油最重要的活性化合物主要包括2种化学基团(化学结构见图3):第一种是萜类化合物(萜类化合物、倍半萜类化合物),第二种是苯丙素类化合物。由于初级代谢的前体物质不同,导致这两种化合物的产生,它们通过不同代谢途径进行合成。在植物的次生代谢产物中,萜类化合物的种类繁多,其中有文献记载的就约有15 000种。这些化合物都具有5碳的基础结构(C5H8),通常被称为异戊二烯单元,这些化合物分类取决于它们骨架中这些单元的数量。而在萜类化合物当中,植物精油中最重要的组成部分大多属于单萜或者倍半萜类家族。苯丙类化合物的生成主要来自莽草酸代谢途径(仅在微生物和植物才有的功能)[4]。苯丙素类化合物虽然在某些植物当中的含量很高,但它并不是植物精油中最常见的成分[8]。
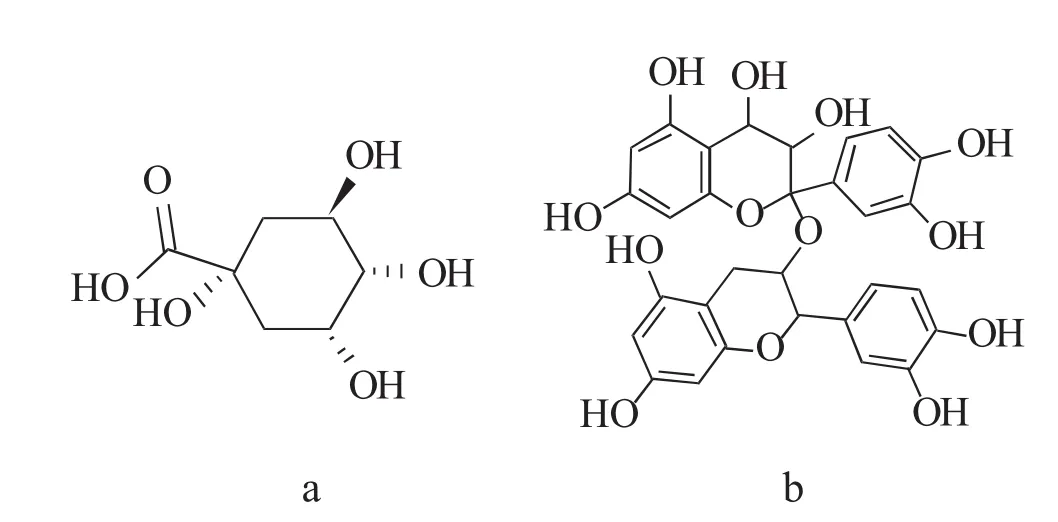
图2 单宁的化学结构
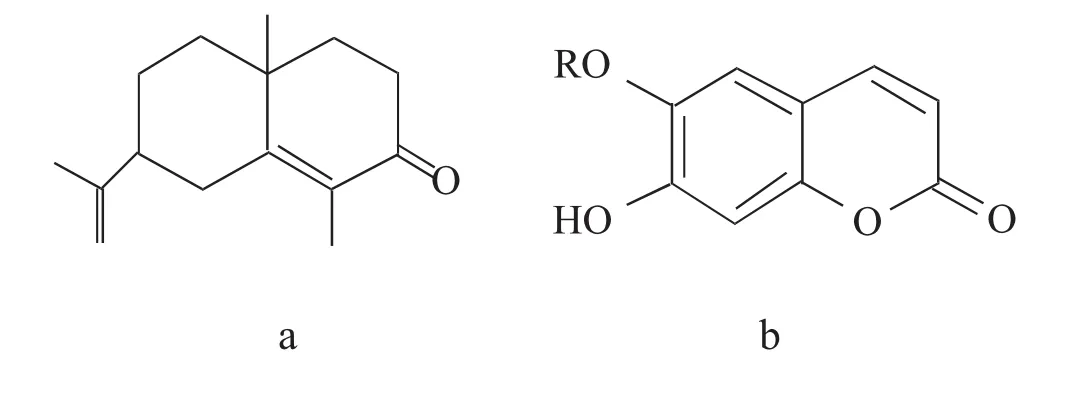
图3 植物精油化学结构图
2 植物提取物对反刍动物瘤胃发酵和甲烷产量的影响
2.1 对挥发酸产量的影响
反刍动物瘤胃发酵产生的挥发性脂肪酸是其重要的能量来源之一,是反刍动物吸收能量的60%~80%,而其中乙酸、丙酸、丁酸是3种主要挥发酸约占总挥发酸的95%[9]。植物提取物能改变瘤胃发酵产生的挥发酸组成,从而影响瘤胃发酵模式。植物提取物正效应主要是由于降低乙酸∶丙酸的比例,提高了丁酸的含量。降低乙酸与丙酸比例可以在一定程度上维持反刍动物葡萄糖代谢平衡。
有报道称,补充浓缩丹宁使总挥发酸的产量下降,并显著减少乙酸比例和乙酸与丙酸比例。Metha等[10]的研究中,补充植物油使总挥发酸产量明显降低,辅以缩合丹宁和皂苷时,总挥发酸产量显著增加。植物精油的独特作用在于可以提高挥发酸中丁酸的比例,这种趋势表明其作用机制与莫能菌素改变瘤胃发酵模式的机制有较大的差异。
在日粮中添加植物精油对挥发酸浓度的影响,由于不同试验中添加的精油种类、主要成分、用量不同,发酵底物与饲料的精粗比也有所不同,所以在日粮中添加植物精油对挥发性脂肪酸浓度的影响也有所区别。有研究表明,底物精粗比7∶3时添加0.3~3.0mg/L肉桂醛提高总挥发酸浓度;BusquetM等[11]将不同浓度的薰衣草精油作为添加剂,体外培养发酵24 h后,总挥发性脂肪酸浓度均有所提高,与以上试验结果相吻合。Devant等[12]给高精料饲养的荷斯坦公牛饲喂适量的洋蓟、刺五加和葫芦巴混合物的提取物,与对照组相比,提高了瘤胃丙酸比例,且这种效果在高精料饲喂的情况下更显著。米热古丽·伊马木等[13]试验证明,在高精条件下添加不同剂量的薰衣草精油可以提高总挥发酸、乙酸摩尔比例,降低丁酸、戊酸的摩尔比例。金恩望等[14]的试验中,添加100mg/L的留兰香油和肉桂油对挥发酸浓度和乙酸丙酸比例无显著影响,但随发酵时间延长,添加1 500mg/L肉桂油显著降低总挥发酸、乙酸和丙酸浓度。
2.2 对瘤胃微生物的影响
2.2.1 对细菌的影响 关于皂苷对细菌影响的相关研究较少,不同研究人员所得到的结论也有所差异。Goel等[15]研究发现,田菁皂苷和葫芦巴籽皂苷可使产琥珀酸丝状杆菌(Fibrobacter succinogenes)的数量分别提高45%和42%,而飞廉属植物皂苷和葫芦巴籽皂苷可使黄色瘤胃球菌(Ruminococcus falvefaciens)的数量提高40%。体外研究发现,瘤胃液中添加茶皂苷可减少真菌数量[16],而体内试验研究表明,饲喂绵羊含3 g茶皂苷的日粮21 d和72 d,其瘤胃真菌数量均减少[17-18]。
单宁可以有效抑制瘤胃微生物的生长,特别是对瘤胃蛋白降解菌的作用显著。单宁通过与细菌细胞壁及细胞膜形成复合物,导致细胞壁被破坏和胞外酶的分泌达到抑制细菌的效果[19-20]。
不同类型的植物精油对瘤胃细菌的影响不同。有研究显示,植物精油可能会对瘤胃中超级产氨菌起到抑制作用,导致氨基酸的脱氨作用降低[21]。Duval等[22]研究表明,向精粗比40∶60的绵羊日粮中添加110mg香精油对淀粉降解菌的数量没有显著影响,但纤维降解菌群落不受香精油的影响[23]。
2.2.2 对真菌的影响 单宁对瘤胃真菌的影响取决于其化学结构。Muhammed等[24]通过研究单宁酸、鞣花酸、没食子酸、儿茶酸对瘤胃真菌(Neocallimastix frontalis)的影响,发现上述化合物都能抑制纤维素酶的活性。相比于单宁酸,鞣花酸、没食子酸、儿茶酸更能有效地抑制纤维素酶。然而单宁抑制瘤胃真菌纤维降解的效果并不明显[23]。Paul等[25]研究指出,当浓度由10 g/L提高到20 g/L时单宁能够促进瘤胃真菌的生长。由于单宁可显著抑制瘤胃蛋白降解菌的生长,因此将单宁应用于反刍动物生产可增加过瘤胃蛋白量,提高日粮利用率。植物精油对瘤胃真菌影响的研究还很少,而植物精油对单胃动物真菌影响的研究表明,植物精油能够抑制真菌的生长。
2.2.3 对原虫的影响 由于饲喂条件和生理因素的不同,反刍动物瘤胃内原虫的种类和数量会有所变化,因此这种变化可以作为评定瘤胃内环境状况的指标。有关植物提取物对瘤胃原虫影响的报道很多。
有试验证明,皂苷或者富含皂苷的植物提取物对于瘤胃原虫有抑制作用。叶均安[26]研究发现,体外培养瘤胃液中添加茶皂素,随培养时间的延长显著抑制瘤胃原虫生长及改善瘤胃发酵参数。Hu等[27]通过体外产气试验发现,每30mL发酵液中添加8mg茶皂素可明显减少79%的瘤胃原虫数量。体外培养瘤胃液中添加0.3%茶皂素和0.03%丝兰皂苷混合物提高细菌与原虫的比值,且差异极显著[28]。李国祥等[29]的试验证明,在体外培养瘤胃液中添加丝兰提取物,随添加水平的增加,培养液的原虫数量逐渐减少。此外,还有试验显示,添加富含皂苷的植物如田箐和无患子同样可以减少绵羊瘤胃原虫的数量[30]。
关于单宁对瘤胃原虫数量影响的报道结果不尽相同。有研究表明,植物单宁可以降低瘤胃原虫数量,也另有研究表明其对瘤胃原虫无影响。Makkar等[31]研究表明,白坚木单宁可以显著减少内毛虫及全毛虫的数量,同时有助于提高瘤胃微生物蛋白质的合成。然而Newbold等[32]报道,印度田菁叶中的单宁没有抗原虫作用。
近些年关于植物精油对原虫数量的影响结果也不尽相同[1,33-34]。研究发现,当薰衣草精油添加量为100μL/L和150μL/L时,瘤胃体外培养发酵液中原虫降低,而添加量为150μL/L时原虫数量反而增加,但与对照组相比差异不显著。还有体外研究表明,生姜、大蒜和洋葱提取物可以使原虫总数量增加,但还无法证实原虫总量增加是不是因为提取物中含有香精油[35]。
2.3 对瘤胃氮代谢的影响
评价反刍动物饲料蛋白利用率的重要标志就是瘤胃中氮存留率,提高氮存留率可以提高反刍动物对饲料蛋白的利用效率,同时减少粪氮和尿氮的排出。氨是瘤胃中微生物生长的氮源之一,因此评价瘤胃氮存留率应结合氨氮浓度[36]。
Alexander等[37]将辣木籽(皂苷含量40.9 g/kg DM)以2mg/mL添加到白三叶底物中进行体外发酵,经24 h发酵后,和对照组比较,氨态氮浓度降低了13.6%,同时微生物蛋白质合成量提高了44%。氨态氮浓度降低的原因可能是微生物提高了对氨态氮的摄取和利用。
单宁对于单胃动物来说是一种抗营养物质,它能与蛋白质和消化酶形成难溶解于水的复合物,并且影响蛋白质的消化和吸收,它的苦涩味也会限制动物对饲料的采食,但单宁对于反刍动物来讲却有一定的营养作用。在pH值5~7的瘤胃环境内,单宁可与饲料蛋白形成稳定的复合物,不易被微生物降解,并且在流经真胃和小肠时,蛋白质与单宁分开,经胃蛋白酶和胰蛋白酶的分解,形成容易吸收的小分子物质,在某种程度上起到了过瘤胃蛋白的作用[38]。
米热古丽·伊马木等[39]在试验中添加不同剂量的薰衣草精油,体外培养24 h后,各试验组氨态氮浓度均有所提高,氨态氮浓度均在8.75~9.67mg/100mL,各试验组均符合瘤胃微生物最佳生长所需的氨氮浓度(6~30 mg/100mL)。此外,还有试验显示,薄荷油、丁香油、茴香油、大蒜素、百里香油和茶树油等均降低体外发酵瘤胃液氨氮浓度,其中百里香油和薄荷油的效果最显著[38]。其研究者认为,这类挥发油提取物降低氨氮的机制在于抑制瘤胃中氨化菌的繁殖。有大量体外试验显示,丁香油、百里香油、薄荷油、茶树油、茴香油、香芹油等提取物均具有降低体外发酵瘤胃液氨氮和支链脂肪酸浓度的能力,其中百里香油与薄荷油效果最为突出,说明这些物质可有效抑制饲料蛋白在瘤胃内的降解[11,40-41]。也有报道表明添加植物精油对瘤胃氮代谢无影响。
2.4 对瘤胃甲烷产量的影响
甲烷是温室气体组成的重要部分,随着全球环境变暖,反刍动物排放的大量甲烷已经成为环境学家及动物科学家共同关注的重点。每年仅反刍动物就会产生约7.7×107t甲烷,占大气中甲烷总量的15%[3],产生甲烷的同时也使反刍动物消化碳水化合物及氨基酸时损失大量能量,其中有6%~15%的饲料能量以甲烷的形式被损耗[44]。
有试验证明,单宁可以在长期应用的基础上减少反刍动物瘤胃甲烷的产生。还有研究显示,在山羊日粮中添加不同浓度的浓缩单宁(从胡枝子中提取),在各浓度梯度下浓缩单宁均有降低山羊瘤胃甲烷产量的趋势[4]。浓缩单宁降低甲烷的产量可能与直接抑制甲烷菌和原虫的活性有关。
研究发现,在反刍动物的饲料中添加适量的植物精油有助于降低瘤胃甲烷产量。有试验证明,在体外培养试验中添加400mg/L的百里香酚可以有效抑制甲烷产量,但同时使乙酸和丙酸的浓度降低。米热古丽·伊马木等[43]添加不同浓度葡萄籽精油进行体外瘤胃发酵试验,结果证明,添加低浓度和中浓度的葡萄籽精油可以有效降低体外发酵液甲烷产量,并提高乙酸比例和乙酸与丙酸比例,但高浓度组结果相反。金恩望等[44]试验证明,肉桂油降低甲烷体积分数的程度与添加的剂量呈正相关,茶树油、丁香油、肉桂醛降低甲烷体积分数的26.9%~67.8%。Jahani-Azizabadi等[45]报道,在批次培养试验中添加1 000mg/L的肉桂油可以降低36.4%的甲烷产量。另外有试验表明,添加500m l/L的肉桂油可以降低26%的甲烷产量。有试验证明,利用体外产气法对茴香、苜蓿、大蒜等的乙醇提取物可以抑制瘤胃甲烷气体的生成,试验证明大蒜的乙醇提取物可降低64%的甲烷产量,并且对饲料消化率没有降低作用。米热古丽·伊马木等[39]的试验证明,将适量的薰衣草精油添加在高精饲料中可以减少甲烷的产生,说明在高精条件下一定浓度的薰衣草精油对甲烷生成有抑制作用。以上试验表明,植物精油具有显著降低体外瘤胃发酵产生甲烷的作用,因此,适当浓度的植物精油被推荐用于调控瘤胃发酵并减少瘤胃甲烷的排放。
3 存在的问题
植物提取物虽然在改善瘤胃发酵并降低甲烷产量上有较好的效果,但在反刍动物饲料中广泛应用具有一定的局限性。植物提取物的有效成分和数量存在较大差异,很难实现标准化,并且由于组成成分不同,会影响植物提取物的营养机能。虽然大量研究表明,植物提取物在反刍动物瘤胃发酵和生产性能方面有很好的促进作用,但是对植物提取物功能性和作用机制中的研究甚少,大多只涉及动物生产性能方面。
目前,研究植物提取物的方法普遍采用体外培养法,而体内试验的相关资料极为缺乏。虽然通过体外培养法对植物提取物进行筛选是一种比较简单且重要的方法,但体外培养法与动物试验之间存在差异,所以为了更好地研究植物提取物对反刍动物瘤胃发酵和甲烷产量的影响,应迫切开展动物试验,研究包括植物提取物在饲粮中合适的添加剂量、对活体动物瘤胃发酵的调控效果以及对动物生产性能的影响等方面的问题。
[1] Wallace R J,Mc Ewan N R,McIntosh FM,et al.Natural products as manipulators of rumen fermentation[J].Asian-Australasian Journal of AnimalSciences,2002,15:1458-1468.
[2] 赵洪波,王志博,张永根.植物提取物对瘤胃发酵调控的研究进展[J].饲料工业,2012,33(23):53-57.
[3] BlakeDR,Rowland FS.Continuingworldwide increase in tropospheric methane[J].Science,1988,239:1129-1131.
[4] Castillejos L,SCalsamiglia,A Ferret,etal.Effectof dose and adaptation time of a specific blend of essential oil compounds on rumen fermentation[J].AnimalFeedScienceandTechmology,2007,132:186-201.
[5] YoshikiY,Kudou S,Okubo K.Relationship between chemicalstructuresand biological activities of triterpenoid saponins from soybean[J]. BioscienceBiotechnologyandBiochemistry,1998,62(12):2291-2299.
[6] FrancisG,Kerem Z,Makkar H PS,etal.Thebiologicalaction ofsaponinsin animalsystems:a review[J].British JournalofNutrition,2002,88(6):587-605.
[7] Haslam E.Plantpolyphenols:vegetabletanninsrevisited[M].Cambridge:CambridgeUniv Pr,1989.
[8] Rosenthal G A,Berenbaum M R.Herbivores:their interactionswith secondary plantmetabolites.The chemical participants[M].Manhattan:Academic Press,1991.
[9] Bergman EN.Digestion andmetabolism in the ruminant[C]//McDonald IW and Warner A C I.Australia:Univ of New England Publishing Unit,1975:292.
[10]MethaWanapat.Effects of plants containing secondary compounds and plantoilson rumen fermentationand ecology[J].Trop Anim Health Prod,2012(44):399-405.
[11]Busquet M,Calsamiglia S,Kamel C,et al.Effects of cinnamaldehyde and garlic oilon rumenmicrobial fermentation in a dual flowcontinuous culture[J].JournalofDairy Science,2005,88:2508-2516.
[12]DevantM,Anglada A,Bach A,etal.Effectsofplantextractsupplementation on rumen fermentation and metabolism in young Holstein bulls consuminghigh levelsof concentrate[J].Animal Feed Scienceand Technology,2007,137(1/2):46-57.
[13]Benchaar C,PetitH V,Berthiaume R,etal.Effects of essential oil supplements on ruminal fermentation,rumen microbial populations and in sacco degradation ofdrymatterand nitrogen in the rumen of lactating dairy cows[J].Canadian Journal of Animal Science,2003,83:637-638.
[14]金恩望,卜登攀,王加启,等.利用双流持续发酵系统研究植物精油对瘤胃发酵和甲烷生成的影响[J].动物营养学报,2013,25(10):2303-2314.
[15]Goel G,Makkar H P S,Becker K.Changes in microbial community structure,methanogenesis and rumen fermentation in response to saponinrich fractions from different plantmaterials[J].Journal of Applied Microbiology,2008a,105:770-777.
[16]Guo Y Q,Liu JX,Lu,et al.Effect of tea saponin onmethanogenesis, microbialcommunitystructureand expression of mcrA gene,in cultures of rumenmicroorganisms[J].Letters in Applied Microbiology,2008,47:421-426.
[17]Zhou Y Y,Mao H L,Jiang F,etal.Inhibition of rumenmethanogenesis by tea saponins with reference to fermentation pattern and microbial communities in Hu sheep[J].Animal Feed Science and Technology,2011,166:93-100.
[18]Mao H L,Wang JK,Zhou Y Y,etal.Effectsofaddition of tea saponins and soybean oil on methane production,fermentation and microbial population in the rumen of growing lambs[J].Livestock Science,2010,129:56-62.
[19]Heins Y,Tagari H,Volcani R.Effect of water extracts of carob pods,tannic acid,and their derivatives on the morphology and growth of microorganisms[J].Applied and Environmental Microbiology,1964,12:204-209.
[20]Smith A H,Zoetendal EG,Mackie R I.Bacterialmechanisms to overcome inhibitory effectsof dietary tannins[J].Microbial Ecology,2005,50:197-205.
[21]Evans JD,Mabtin S A.Effects of thymol on ruminalmicroorganisms [J].CurrentMicrobiology,2000,41:336-340.
[22]Duval SM,McEwan N R,Graham R C,et al.Effect of a blend of essentialoil compoundson the colonization ofstarch-rich substratesby bacteria in the rumen[J].Journal of Applied Microbiology,2007,103:2132-2141.
[23]McSweeney CS,Palmer B,Bunch R,et al.Effect of the tropical forage calliandra onmicrobialprotein synthesis and ecology in the rumen[J]. JournalofApplied Microbiology,2001,90:78-88.
[24]Muhammed S,Stewart C S,Acamovic T.Effects of tannic acid,ellagic acid,gallic acid and catchin on cellulose degradation by the rumen fungusNeocallimastix frontalisstrain RE1[J].AnimalScience,1995,60:550A(Abst)
[25]Paul SS,Kamra DN,Sastry V R B,etal.Effect of phenolicmonomers on biomass and hydrolytic enzyme activities of an anaerobic fungus isolated from wild nilgai(Baselophus tragocamelus)[J].Letters in Applied Microbiology,2003,36(6):377-381.
[26]叶均安.茶皂素对瘤胃原虫的抑制效果[J].中国饲料,2001(2):30-32.
[27]HuW L,Liu JX,Ye JA,etal.Effectof tea saponin on rumen fermentation invitro[J].AnimalFeed Scienceand Technology,2005,120:333-339.
[28]王洪荣.茶皂素和丝兰皂苷对山羊人工瘤胃发酵和瘤胃微生物的影响[J].中国农业科学,2011,44(8):1710-1719.
[29]李国祥,王梦芝,李世霞.丝兰提取物对山羊瘤胃发酵参数、原虫密度及甲烷产量的影响[J].饲料工业,2008,26(18):15-18.
[30]GoelG,Makkar H PS,Becker K.EffectofSesbania sesban and Carduus pycnocephalus leaves and fenugreek(Trigonella foenum-graecum L.)seeds and their extracts on partitioning of nutrient from roughage and concentrate based feeds to methane[J].Animal Feed Science and Technology,2008a,147:72-89.
[31]Makkar H PS,Blummel M,Becker K.In vitro effects and interactionbetween tannins and saponins and fate of tannins in the rumen[J]. Journalof the Scienceof Food and Agriculture,1995,69:481-493.
[32]Newbold C J,McIntosh FM,Williams P,etal.Effectsofaspecific blend ofessentialoilcompoundson rumen fermentation[J].Animal Feed Scienceand Technology,2004,14:105-112.
[33]McIntosh FM,Williams P,Losa R,etal.Effectsofessentialoilson ruminal microorganisms and their protein metabolism[J].Applied and EnvironmentalMicrobiology,2003,69:5011-5014.
[34]Benchaar C,Petit H V,Berthiaume R,etal.Effectsof essential oil supplements on ruminal fermentation,rumen microbial populations and in sacco degradation ofdrymatterand nitrogen in the rumen of lactating dairy cows[J].Canadian Journal of Animal Science,2003,83:637-638.
[35]Patra A K.Inhibition of ciliate protozoa and stimulation of fiber degradingmicrobes in the rumen of buffaloesby plantsecondarymetabolites [D].Izatnagar:Indian Veterinary Research Institute,2004.
[36]Bandle SV,Gupta BN.Rumen fermentation,bacterialand totalvolatile fattyacid(TVFA)production ratesin cattle fed on urea-molasses-mineralblock lickssupplement[J].Animal Feed Scienceand Technology,1997:275-286.
[37]AlexanderG,Singh B,Sahoo A,etal.In vitro screeningofplantextracts to enhance the efficiency of utilization of energy and nitrogen in ruminant diets[J].Animal Feed Science and Technology,2008,145(1 /2/3/4):229-244.
[38]林波,陆燕.植物提取物调控反刍动物瘤胃发酵的研究进展[J].饲料工业,2009,30(19):27-31.
[39]米热古丽·伊马木,王恬,刘敏,等.高精条件下薰衣草精油对体外瘤胃发酵和甲烷产量的影响[J].新疆农业科学,2012,49(4):743-747.
[40]Cardozo PW,Calsamiglia S,FreertA,etal.Screening for theeffetsof natural plant extracts at different pH on in vitro rumen microbial fermentation ofahigh-concentrate diet for beefcattle[J].Anim Feed Sci Technol,2008,145:259-270.
[41]Castillejos L,Calsamiglia S,Mari’in-Tereso J,etal.In vitro evaluation of effects of ten essential oilsat three doses on ruminal fermentation of high concentrate feedlot-typediets[J].Anim Feed Sci Technol,2008,145:259-270.
[42]Johnson K A,Johnson D E.Methaneemissions from cattle[J].Joumal ofAnimalScience,1995,73(8):2483-2492.
[43]米热古丽·伊马木,余雄,王改琴,等.葡萄籽精油对体外瘤胃发酵和甲烷生成的影响[J].畜牧与兽医,2012,44(1):4-7.
[44]金恩望,王加启,卜登攀,等.利用体外产气法研究植物精油对瘤胃体外发酵和甲烷生成的影响[J].中国农业大学学报,2013,18(3):120-127.
[45]Jahani-AzizabadiH,Mesgaran M D,Vakili A R,etal.Effectof various medicinal plant essential oils obtained from semi-arid climate on rumen fermentation characteristics of a high forage diet using in vitro batch culture[J].AfrMicrobiolRes,2011,5(27):4812-4819.
Effect of Plant Extractson Rum en Ferm entation and M ethane Production
JiaMiao,Lu Lin,LiYanling
(CollegeofAnimalScienceand Technology,Beijing University ofAgriculture,Beijing102206,China)
Plantextracts are rich in volatile oils,alkaloids,terpenoids,saponins and other chemical substances,with characteristicsofantibacterial,growth-promoting,anti-oxidation and immunity-improving.For ruminantanimals,itplaysan active role,including regulating the fermentation pattern,improving theprotein utilization rate,reducingmethaneemissionsand other functions. Thispaperhave summarized the effectofplantextractson the rumen fermentation andmethane production in the rumen of ruminants.
plantextracts;rumen fermentation;methaneproduction
S816.15
A
2095-3887(2015)04-0059-06
10.3969/j.issn.2095-3887.2015.04.019
2015-04-20
国家自然基金(31302000);北京市现代农业产业技术体系奶牛创新团队
贾淼(1990-),女,硕士研究生。
李艳玲(1973-),女,副教授,博士后。研究方向:动物营养与饲养科学。
