转化生长因子β1及其受体在血管损伤后内膜增殖中的作用
2015-12-30林志鸿,吴可贵,李庚山等
转化生长因子β1及其受体在血管损伤后内膜增殖中的作用
林志鸿1吴可贵1,2李庚山3谢良地1,2蔺佩鸿
(福建医科大学附属第一医院急诊科,福建福州350005)
摘要〔〕目的探讨转化生长因子β1 (TGF-β1)及其受体对血管损伤后内膜增殖的作用及机制。方法培养SD大鼠正常及损伤颈动脉血管平滑肌细胞,应用逆转录PCR(RT-PCR)及蛋白印迹(Western印迹)方法分别检测血管平滑肌细胞(VSMCs)生物学标记物SM22α,Matrix Gla,Osteopontin;TGF-β1,纤维连结蛋白(FN)及TGF-β1 Ⅰ型和Ⅱ型受体(TGF-β1-RⅠ,TGF-β1-RⅡ)mRNA和蛋白质的表达。结果①TGF-β1呈浓度依赖性刺激损伤颈动脉VSMCs增殖;但在0.2%血清条件下,TGF-β1浓度依赖性抑制正常颈动脉VSMCs增殖;②正常组VSMCs SM22α mRNA表达水平明显高于损伤组VSMCs;而Matrix Gla及Osteopontin损伤组VSMCs的表达水平则显著升高;③损伤组VSMCs TGF-β1 mRNA和蛋白质的表达水平显著高于正常组,且FN的合成也较正常组显著增高;④损伤组TGF-β1-RⅠ mRNA和蛋白质的表达与正常组并无明显差别;但TGF-β1-RⅡ的表达水平损伤组却显著高于正常组。结论血管损伤后,VSMCs表型发生改变,呈现异常增殖,合成和分泌TGF-β1及FN明显增多;TGF-β1对损伤后VSMCs有显著促增殖效应;同时血管损伤后VSMCs TGF-β1不同受体亚型的表达也发生了变化。
关键词〔〕转化生长因子β1;血管损伤;平滑肌细胞
中图分类号〔〕R543.5〔文献标识码〕A〔
基金项目:福建省教育厅高校新世纪人才支持计划项目(No.NCETFJ-0609)
1福建省高血压研究所
2福建医科大学附属第一医院干部病房
3武汉大学人民医院心内科
第一作者:林志鸿(1970-),男,主任医师,副教授,硕士生导师,主要从事高血压、冠心病及心肺复苏的基础与临床研究。
血管成形术后再狭窄是血管平滑肌细胞(VSMCs)迁移、增殖及细胞外基质(ECM)分泌和堆积的结果。目前认为转化生长因子β1(TGF-β1)是促进ECM合成的主要因子之一。TGF-β1高表达与胶原、蛋白聚糖等的增加有明显的相关性〔1〕。现已证实Ⅰ、Ⅱ型受体是TGF-β1的信息传递分子,且其不同的浓度可介导TGF-β1不同的生物活性。TGF-β1可刺激培养的高血压大鼠(SHR)VSMCs的增殖及合成ECM,但抑制WKY大鼠VSMCs的增殖,研究表明此一异常现象与两种细胞上TGF-β1不同受体亚型的表达差异有关〔2〕。 与SHR相似,血管损伤后VSMCs也呈现异常增殖现象,但具体机制尚未完全阐明。本文探讨TGF-β1对损伤后VSMCs增殖及合成ECM的作用、血管损伤后TGF-β1受体表达的改变。
1材料与方法
1.1 材料体重约400~500 g的雄性SD大鼠,由福建医科大学实验动物中心提供,RPMI1640干粉(Gibco公司)、小牛血清(CS,上海华美生物工程公司)、胰蛋白酶(DIFCO公司)、TGF-β1(TGF-β1,Sigma)、3H-胸腺嘧啶核苷酸(3H-TdR,中国原子能科学研究院)、兔抗鼠多克隆的TGF-β1抗体(2 μg/ml,R﹠D System Inc,Minneapolis,MN),兔抗鼠多克隆TGF-β1Ⅰ型受体(TGF-β1-RⅠ)抗体(Santa Cruz Biotechnology),山羊抗鼠多克隆TGF-β1 Ⅱ型受体(TGF-β1-RⅡ)抗体(Santa Cruz Biotechnology)。
1.2 SD大鼠颈总动脉内膜的损伤SD大鼠氯氨酮40 mg/kg麻醉,固定。颈部消毒、分离右颈总动脉至动脉交叉处,结扎颈外动脉远端及分枝,同时暂时阻断颈总动脉近心端及颈内动脉血流。在离动脉交叉处远心端约0.5~1 cm处切开颈外动脉,插入2F的球囊导管(Baxter Healthcare)约2.0 cm,从导管注入0.08 ml的生理盐水扩张球囊,有明显阻力感后来回拖拉3次,确定造成血管壁损伤后退出球囊导管,在靠近动脉交叉处结扎颈外动脉,同时开放颈内及颈总动脉使血流再通后,缝合切口。术后给予青霉素80 mg连续肌注3 d预防感染,正常饮水摄食。
1.3 SD大鼠颈总动脉VSMCs的培养培养SD大鼠颈总动脉VSMCs;采用alpha smooth muscle actin单克隆抗体的免疫细胞荧光进行鉴定,细胞纯度达95%以上。实验用3~5代VSMCs。
1.4 TGF-β1对VSMCs增殖的影响3~5代的培养VSMCs,0.25%的胰酶消化后,调成约5×104cells/ml的细胞数,接种于24孔板,每孔1 ml,培养24 h贴壁后,换用无血清的RPMI1640培养基,继续培养24 h,使VSMCs处于G0/G1期,再进行干预实验。 0.2%CS、0.2%CS+ TGF-β1(0.01、0.1、1.0、10 ng/ml) 10%CS、10%CS+ TGF-β1(0.01、0.1、1.0、10 ng/ml)。
1.5进行VSMCs DNA合成率的测定在干预药物加入时,同时加入1 μCi/ml的3H-TdR,共育30 h后,0.25%的胰酶消化,在0.45 μm的微孔滤膜上负压抽滤,生理盐水和10%的三氯醋酸冲洗滤膜,室温凉干后置入闪烁杯中,加入ppo/popop/二甲苯闪烁液4 ml,静置过夜后,在液体闪烁计数器(Tri-carb 2300,Pakard Co,Lit.,USA)上进行放射性强度的测定。
1.6 逆转录聚合酶链反应(RT-PCR)应用TriPure分离试剂盒(BOEHRINGER MANNHEIM COMPANY),按照说明书要求提取细胞总RNA。在20 μl的总体积中,加入总RNA 1 μg,2.5 μmol/L的随机引物,5 mmol/L的MgCl2,Rasin inhibitor 40 U,逆转录酶(AMV,Life Science,St. Petersburg,FL,USA)5 U,1 mmol/L dNTP mix,10×PCR缓冲液2 μl,加DEPC处理水至总体积20 μl;30 ℃,10 min,42℃ 30 min,99 ℃孵育5 min灭活AMV,反转录成功的cDNA作为下一步PCR模板。采用18 S rRNA作为内参照物,PCR反应体系:cDNA 2.0 μl,10× PCR缓冲液2 μl,5 mmol/L的MgCl2,1 mmol/L dNTP混合液4.0 μl,上下游引物各0.2 μmol/L,TaqDNA聚合酶(Takara) 0.625 μl,加灭菌去离子水至总体积20 μl,置于PCR循环扩增仪上扩增30~35次循环。
PCR扩增后,各取10 μl产物,以溴芬蓝作为上样缓冲液,在1.5%琼脂糖凝胶上进行电泳检测。电泳约45~60 min后,在凝胶分析系统上(美国UVP公司),以18S rRNA作为内参照,进行产物电泳条带强度的半定量分析。
1.7 免疫印迹法(Western印迹)检测蛋白表达培养在6孔板的VSMCs加入裂解缓冲液,4 ℃,13 500 r/min离心10 min;取上清,加入400 μl的甲醇和100 μl的氯仿沉淀蛋白质,4℃,13 500 r/min离心10 min;去上清,加入100 μl的PBS溶解蛋白质沉淀。抽提的蛋白质测定含量,加入样本缓冲液,按每孔5 μg的蛋白质及20 μl的样本缓冲液,在8%聚丙烯酰胺凝胶中电泳。电转膜将电泳完毕的蛋白质转移至硝酸纤维素膜上,将膜用100%的Block Ace 4 ℃封闭过夜;最后将不同实验所得的纤维素膜分别与兔抗鼠多克隆TGF-β1抗体(2 μg/ml),兔抗鼠多克隆TGF-β1-RⅠ抗体(1∶400),山羊抗鼠多克隆TGF-β1-RⅡ抗体(1∶400)或小鼠抗大鼠α-Tublin单克隆抗体作为内参照(1∶1 000)室温孵育振摇3 h,振摇洗涤后,再分别与相应的过氧化物酶联的IgG二抗(1∶2 000)室温孵育振摇1 h;最后经ECL(Amersham Pharmacia Biotech)显影3~10 min,X线曝光显影。图像处理系统扫描胶片,测定感光区带的感光密度。
2结果
2.1 TGF-β1对SD大鼠正常及损伤颈动脉VSMCs增殖的影响在0.2%血清和10%血清条件下,0.01~10 ng/mlTGF-β1均呈浓度依赖性刺激SD大鼠损伤颈动脉VSMCs增殖和DNA合成(P<0.05);而在0.2%血清条件下,TGF-β1浓度依赖性抑制SD大鼠正常颈动脉VSMCs增殖(P<0.05);但在10%血清浓度,TGF-β1对正常颈动脉VSMCs增殖的抑制作用不明显,对DNA合成有轻微的刺激作用。见表1。
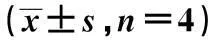
表1 不同浓度TGF-β1对SD大鼠颈动脉损伤后
与同一浓度正常组比较:1)P<0.05
2.2 血管损伤后颈动脉VSMCs表型的变化标记VSMCs收缩表型的SM22α,正常组VSMCs mRNA表达明显高于损伤组(0.66±0.07 vs 0.47±0.04,P<0.05);而标记VSMCs合成表型的Matrix Gla及 Osteopontin,损伤组VSMCs表达水平则显著升高(0.59±0.03 vs 0.06±0.01,P<0.01;0.4±0.01 vs 0.12±0.03,P<0.01)。见图1。

图1 颈动脉损伤后VSMCs表型标记物SM22α,Matrix Gla和Osteopontin mRNA表达水平的变化
2.3 血管损伤对SD大鼠颈动脉VSMCs FN,TGF-β1及其受体mRNA表达的影响血管损伤后,损伤组VSMCs,TGF-β1 和FN mRNA表达水平显著高于正常组(0.68±0.03 vs 0.5±0.03,P<0.01;0.35±0.03 vs 0.04±0.01,P<0.01)。血管损伤后,损伤组TGF-β1-RⅠ表达与正常组无明显差别(0.48±0.03 vs 0.39±0.05,P>0.05);但TGF-β1-RⅡmRNA的表达水平却显著高于正常组(0.85±0.09 vs 0.41±0.1,P<0.05),TGF-β1-RⅠ/ TGF-β1-RⅡ下降。见图2,图3。

图2 血管损伤对SD大鼠颈动脉VSMCs FN,TGF-β1 mRNA表达的影响

图3 血管损伤对SD大鼠颈动脉TGF-β1 受体mRNA表达的影响
2.4 血管损伤对SD大鼠颈动脉VSMCs TGF-β1及其受体蛋白质表达的影响血管损伤后,损伤组VSMCs TGF-β1及其受体亚型蛋白质的表达与相应mRNA的表达变化一致。血管损伤后,损伤组TGF-β1的蛋白表达水平增加,显著高于正常组(0.82±0.17 vs 0.32±0.12,P<0.05)。损伤组TGF-β1-RⅠ蛋白质表达与正常组并无明显差别(0.47±0.04 vs 0.54±0.05,P>0.05);但损伤组TGF-β1-RⅡ蛋白质的表达水平却显著高于正常组,是其的5.3倍(0.83±0.08 vs 0.16±0.05,P<0.01)。见图4,图5。

图4 血管损伤对SD大鼠颈动脉VSMCs TGF-β1蛋白质表达的影响

图5 血管损伤对SD大鼠颈动脉VSMCs TGF-β1 受体蛋白质表达的影响
3讨论
ECM主要是由增生的VSMCs和成纤维细胞所分泌,主要有胶原、弹力纤维、FN及层LN等。ECM的过量分泌和积蓄是损伤后内膜增厚的主要原因之一〔1〕。
本研究结果表明,血管损伤后,VSMCs中TGF-β1及FN的mRNA及蛋白质的表达明显增加;在体实验也证实血管损伤后4 w,在内膜显著增厚的同时,内膜中细胞外基质FN、LN和TGF-β1的含量较正常组明显增加〔3〕。表明血管损伤后,VSMCs合成和分泌TGF-β1及FN、LN增多,导致细胞外基质蛋白在内膜中沉积,引起内膜的增厚。
心血管系统中的TGF-β主要是TGF-β1,它可促进内皮再生和血管生长;促进成纤维细胞和VSMCs增生,使ECM的合成和分泌增加,而且还可抑制基质蛋白的降解。因此可能在机械性血管损伤和介入治疗后再狭窄的内膜增生过程中起重要作用〔4,5〕。
本研究结果表明,在0.2%血清时,TGF-β1表现为浓度依赖性抑制正常VSMCs的增殖,却显著促进了颈动脉损伤大鼠VSMCs的增殖;10%血清条件下,TGF-β1仍显著促进损伤大鼠VSMCs增殖,对正常组的VSMCs,TGF-β1的抑制作用并不明显。这种血管损伤后,TGF-β1对VSMCs的生物学作用发生根本性的变化,由抑制细胞增殖转为促细胞增殖,促进ECM的合成,其机制尚不明确,可能与血管损伤后VSMCs的表型发生了转变有关。有研究表明TGF-β1对VSMCs的增殖具有双重效应,可能与细胞密度、细胞表型、共同培养的因子及TGF-β1的浓度等有关〔6〕。
本研究也证实了血管损伤后,VSMCs的表型发生了变化,由原来未损伤前的收缩表型向损伤后的合成表型转变。血管损伤后,VSMCs收缩表型标记物SM22α mRNA表达明显下降,而标记合成表型的Matrix Gla及Osteopontin mRNA表达水平却显著增加。
因此,血管损伤后,由收缩表型转变为合成表型的VSMCs,除了本身合成更多的生长因子和血管活性物质外〔7〕,同时其对各种生长因子和血管活性物质,包括对TGF-β1的反应性也发生了变化,使TGF-β1由原来的抗增殖转变为促增殖作用,从而促进血管损伤后再狭窄的发生和发展。
除VSMCs的表型改变,有研究显示TGF-β1不同受体亚型的变化可能也参与TGF-β1促进VSMCs的异常增殖过程。在体研究也证实内膜剥脱损伤的血管,损伤处TGF-β1及TGF-β1-RⅡmRNA水平明显高于正常内膜处〔8〕。预先在损伤颈动脉增生的内膜注射重组可溶性的TGF-β1-RⅡ(TGF-βR:Fc),可明显减轻内膜肥厚和增加管腔面积〔9〕。
本研究结果显示血管损伤后,培养的VSMCs TGF-β1两种受体亚型的表达发生了变化,TGF-β1-RⅠ的表达水平在损伤前后的VSMCs无明显差异,而TGF-β1-RⅡ的表达水平则较正常组明显增加,其蛋白表达水平为正常的5.3倍。因此TGF-β1-RⅡ表达水平的增加可能参与了TGF-β1促进损伤大鼠VSMCs的异常增殖。
血管损伤后VSMCs呈现异常增殖现象,而TGF-β1在血管损伤后呈现持续的高表达,且促进损伤血管VSMCs的增殖和ECM合成,此一作用可能与血管损伤后VSMCs的表型改变及TGF-β1受体亚型的表达发生变化有关。预示TGF-β1及其受体有望成为预防和减轻血管损伤后内膜增殖,肥厚及再狭窄形成的重要靶点,有待于进一步研究证实。
4参考文献
1Khan R,Agrotis A,Bobik A. Understanding the role of transforming growth factor-beta1 in intimal thickening after vascular injury〔J〕.Cardiovasc Res,2007;74(2):223-34.
2Saltis J,Agrotis A,Bobik A. Regulation and interactions of transforming growth factor-beta with cardiovascular cells:implications for development and disease〔J〕.Clin Exp Pharmacol Physiol,1996;23(3):193-200.
3林志鸿,吴可贵,李庚山,等. 氟伐他汀抑制球囊损伤后兔血管内膜增殖〔J〕.中国病理生理杂志,2005;21(1):99-103.
4Yao EH,Fukuda N,Ueno T,etal.A pyrrole-imidazole polyamide targeting transforming growth factor-b1 inhibits restenosis and preserves endothelialization in the injured artery〔J〕.Cardiovasc Res,2009;81(4):797-804.
5Bobik A.Transforming growth factor-betas and vascular disorders〔J〕.Arterioscler Thromb Vasc Biol,2006;26(8):1712-20.
6Bray P,Agrotis A,Bobik A.Transforming growth factor-beta and receptor tyrosine kinase-activating growth factors negatively regulate collagen genes in smooth muscle of hypertensive rats〔J〕.Hypertension,1998;31(4):986-94.
7Rudijanto A.The role of vascular smooth muscle cells on the pathogenesis of atherosclerosis〔J〕.Acta Med Indones,2007;39(2):86-93.
8Spurgeon KR,Donohoe DL,Basile DP.Transforming growth factor-beta in acute renal failure:receptor expression,effects on proliferation,cellularity,and vascularization after recovery from injury〔J〕.Am J Physiol Renal Physiol,2005;288(3):F568-77.
9Smith JD,Bryant SR,Couper LL,etal. Soluble transforming growth factor-beta type Ⅱ receptor inhibits negative remodeling,fibroblast transdifferentiation,and intimal lesion formation but not endothelial growth〔J〕.Circ Res,1999;28;84(10):1212-22.
〔2013-12-03修回〕
(编辑安冉冉/曹梦园)
