Src同源2结构域转化蛋白和环氧化酶-2在大肠癌组织中的表达及意义
2015-12-30宫健,刘石,张博等
Src同源2结构域转化蛋白和环氧化酶-2在大肠癌组织中的表达及意义
宫健刘石张博李雪松张慧宇陈尔东王明涛李晓红张晓明
(齐齐哈尔医学院附属第三医院,黑龙江齐齐哈尔161000)
摘要〔〕目的探讨Src 同源 2 结构域转化蛋白(Shc)和环氧化酶(COX)-2在大肠癌的表达及意义。方法选择2010年1月至2013年10月在该院收治的资料完整的经病理学确认的大肠癌标本158例。采用免疫组化发检测大肠癌和癌旁组织的Shc和COX-2表达。结果Shc表达在大肠癌组织中的细胞质和细胞核,COX-2表达在大肠癌组织中的细胞质。分化程度越低、浸润越深、远处转移和淋巴结转移的Shc和COX-2表达均有差异(P<0.05),不同性别、TNM分期Shc和COX-2表达无差异(P>0.05),Shc在年龄较高者表达较高 (P>0.05),Shc和COX-2呈正相关(r=0.52,P<0.05)。结论Shc与COX-2可能通过某种机制相互促进功能,共同参与大肠癌的发生发展。
关键词〔〕Src同源2结构域转化蛋白;环氧化酶-2;大肠癌
中图分类号〔〕R735.3+4〔文献标识码〕A〔
基金项目:黑龙江省教育厅2012年度科学技术研究(面上)项目计划(No.12521618)
通讯作者:刘石(1978-),女,主治医师,博士,主要从事消化道肿瘤研究。
第一作者:宫健(1976-),男,副主任医师,博士,主要从事消化道肿瘤研究。
大肠癌的发生发展机制较复杂。Src 同源 2 结构域转化蛋白(Shc)和环氧化酶-2(COX-2)可能参与肿瘤发生〔1,2〕,Shc作为一种细胞质信号转导器,将炎症、分化、增殖和肿瘤形成的信号传递至下游效应器,COX-2可抑制肿瘤细胞凋亡,促进肿瘤浸润与转移。文旨在探讨大肠癌的Shc和COX-2表达和意义,为大肠癌的治疗提供参考。
1对象与方法
1.1对象选择2010年1月至2013年12月在我院收治的资料完整的经病理学确认的原发性大肠癌标本158例,所有患者治疗前均未接受过放化疗且未合并其他原发性肿瘤。大肠癌病人的一般情况见表1。
1.2试验方法
1.2.1标本保存和免疫组化技术检测选取新鲜冰冻组织,石蜡包埋、切片,按免疫组化试剂盒的说明,分别滴加Shc抗体(购于Santa Cruz,USA)稀释液和COX-2抗体(购于福州迈新生物技术开发有限公司),4℃孵育过夜,磷酸盐缓冲液(PBS)冲洗,分别滴加生物素标记羊抗兔的二抗IgG 37℃,孵育30 min,二氨基联苯胺(DAB)显色,阴性对照组使用PBS代替一抗反应,染色后200倍显微镜下观察。
1.2.2指标判断采用半定量积分法判定染色结果,0分:≤5%,1分:6%~25%,2分:26%~50%,3分:51%~75%,4分:>75%,0分:无着色,1分:浅黄色,2分:黄色,3分:棕黄色。染色强度阳性细胞百分数,“-”:0分,“+”:1~4分,“”:5~8分,“”:9~12分。由2名经验丰富的病理医师独立对免疫组化染色结果分别进行评分,取均值为该病例的终评分。
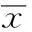
2结果
2.1Shc和COX-2在大肠癌组织和癌旁组织的表达Shc表达阳性呈棕色颗粒状,位于大肠癌组织中的细胞质和细胞核。与癌旁组织相比,Shc在大肠癌组织的表达较强(P<0.05);COX-2表达阳性呈黄色颗粒,位于大肠癌组织中的细胞质,与癌旁组织比较,COX-2在大肠癌组织的表达较强(P<0.05),见图1。
2.2大肠癌病人的一般病理资料与Shc和COX-2表达的关系分化程度越低、浸润越深、远处转移和淋巴结转移的Shc和COX-2表达均有差异(P<0.05),不同性别、TNM分期Shc和COX-2表达无差异(P>0.05),Shc在年龄较高者表达较高 (P>0.05),见表1。
2.3Shc和COX-2在大肠癌组织表达的的相关性Shc阳性132例中122例COX-2呈阳性表达,Shc阴性26例中18例COX-2呈阴性表达,Spearman相关性分析显示,Shc和COX-2呈正相关关系(r=0.52,P<0.05)。

图1 Shc和COX-2在大肠癌组织和癌旁组织的表达(×200)

参数n(%)Shc-+χ2值P值COX-2-+χ2值P值年龄(岁) ≥5084(53.2)62052619.3<0.0510482426.2>0.05 <5074(46.8)20243001834220性别 男118(74.7)16326644.1>0.0520603621.3>0.05 女40(25.3)1012162822100分化程度 高20(12.7)6102227.6<0.051082028.7<0.05 中70(44.3)16203221440142 低68(43.0)414482434300TNM分期 Ⅱ78(49.4)10253946.2>0.0510442224.9>0.05 Ⅲ52(32.9)8142821224160 Ⅳ28(17.7)8515061480浸润深度 黏膜层0(0.0)000021.1<0.05000021.9<0.05 肌层90(57.0)24244202450160 浆膜层68(43.0)220406432302远处转移 是28(17.7)6412631.2<0.052420232.2<0.05 否130(82.3)20407002678260淋巴结转移 是88(55.7)83044621.7<0.0584236220.1<0.05 否70(44.3)18361602040100
3讨论
Shc与大肠癌的关系:(1)Shc作为衔接分子能够激活Raf和MAPK信号通路,起到调控淋巴细胞活化的作用,在恶性肿瘤细胞的增殖、分化、转化及侵袭进程密切相关〔3〕,另外,Shc与生长因子受体蛋白(Grb)2耦联,激活受体蛋白酪氨酸激酶,从而进一步将信号传递给下游效应器,如炎症、分化、增殖。(2)Shc Tyr239/240位点磷酸化引起Rho-GTPase依赖的细胞骨架的重新组织,导致细胞能动性增强。(3)Shc基因座在进化上高度保守,编码3 种重叠蛋白,分子量分别为52、46和66 kD(p52Shc、p46Shc 和p66Shc),p52Shc和p46Shc基因均定位于1q21染色体上,此染色体区域与许多人类肿瘤的增殖相关联〔4〕。(4)Shc参与介导了由载体激素调控的细胞增殖和癌变过程中的络氨酸磷酸化信号与甾体信号之间的交互作用,Shc可感受应激上调细胞内活性氧簇(ROS),ROS升高又可诱导Shc位点磷酸化,进一步促进ROS产生,导致细胞增殖,移行甚至凋亡〔5〕。可见Shc蛋白表达参与大肠癌的发生发展过程,对大肠癌的治疗方案和预后判断具有重要作用〔6〕。
COX-2是完整的膜结合诱导型蛋白,是哺乳动物体内花生四烯酸合成前列腺素的限速酶,在正常组织中不表达或弱表达,但在多种肿瘤中表达较强,尤其在消化系统肿瘤中研究较多,虽然COX-2与肿瘤的确切机制尚不明确,但有研究显示:(1)COX-2可上调血管内皮生长因子(VEGF),VEGF表达增高可增加微血管的通透性,促进内皮细胞分裂增殖和迁移,诱导和调节肿瘤血管形成。(2)COX-2可促进前列腺素(E2)和组胺增加,诱导白细胞介素(IL)-10表达,抑制肿瘤坏死因子(TNF)-α和IL-12产生,使机体免疫监控能力降低,降低细胞杀伤能力,有利于肿瘤发生。(3)COX-2可促进细胞中膜金属蛋白酶(MMP)-2、尿激酶纤溶酶原激活物(μpa)和膜型金属蛋白酶(MT-MMP)1的表达,促进肿瘤的侵袭转移〔7~9〕。
Shc与COX-2的关系较为复杂。研究显示,磷酸酶和张力蛋白同源物(PTEN)为肿瘤抑制基因,Shc表达与PTEN呈负相关关系,CCRCC 细胞中 PTEN 通过其蛋白磷酸酶活性使 Shc 脱磷酸调控细胞迁移运动,当CCRCC 细胞转染PTEN 表达质粒,Shc表达下调,但转染磷酸酶活性缺失的 PTEN,Shc表达无变化,说明PTEN抑制细胞迁移通过抑制Shc 磷酸化达到的。COX-2表达与PTEN呈负相关关系,PTEN可通过调控Akt的表达而影响COX-2的表达,在PTEN突变的细胞中,Akt磷酸化水平较高的细胞COX-2表达较高,PTEN转染能抑制Akt磷酸化载体,下调COX-2表达〔10,11〕。
综上所述,相比于癌旁组织,Shc与COX-2在大肠癌组织中呈现高表达,Shc与COX-2在大肠癌的表达呈正相关关系,但Shc与COX-2均为具有肿瘤抑制作用的PTEN下游蛋白,目前证据尚不能证明两者具有因果关系,可能通过某种机制共同参与大肠癌的发生发展,Shc与COX-2的关系有待进一步的研究。
4参考文献
1Elfineh L,Classon C,Asplund A,etal.Tyrosine phosphorylation profiling via in situ proximity ligation assay〔J〕.BMC Cancer,2014;14:435.
2Kim HN,Kim DH,Kim EH,etal.Sulforaphane inhibits phorbol ester-stimulated IKK-NF-kappaB signaling and COX-2 expression in human mammary epithelial cells by targeting NF-kappaB activating kinase and ERK〔J〕.Cancer Lett,2014;351(1):41-9.
3Smith MJ,Hardy WR,Li GY,etal.The PTB domain of ShcA couples receptor activation to the cytoskeletal regulator IQGAP1〔J〕.EMBO J,2010;29(5):884-96.
4Harun RB,Smith KK,Leek JP,etal.Characterization of human SHC p66 cDNA and its processed pseudogene mapping to Xq12-q13.1〔J〕.Genomics,1997;42(2):349-52.
5郑天郢.IL-8对不同转移潜能肝癌细胞增殖和侵袭的影响以及肝癌和乳腺癌中IL-8与EGFR信号通路的关系〔D〕.山东:山东大学博士学位论文,2012
6张莉,田月,李鹏,等.结肠癌中雌激素受体和衔接蛋白p66Shc的表达和意义〔J〕.胃肠病学,2012;17(9):527-30.
7张明华,冯一中.环氧化酶-2、血管内皮生长因子在大肠癌中的表达及意义〔J〕.交通医学,2010;24(4):381-5.
8王芳,王翠莲,郭丽丽,等.COX-2,Survivin在大肠癌组织中的表达及意义〔J〕.长治医学院学报,2010;24(1):19-21.
9Shalaby MA,Nounou HA,Ms A,etal.Associations between single nucleotide polymorphisms of COX-2 and MMP-2Genes and colorectal cancer susceptibility in the saudi population〔J〕.Asian Pac J Cancer Prev,2014;15(12):4989-94.
10Liu S,Ma X,Ai Q,etal.NOTCH1 functions as an oncogene by regulating the PTEN/PI3K/AKT pathway in clear cell renal cell carcinoma〔J〕.Urol Oncol,2013;31(6):938-48.
11Huang YY,Xia MZ,Wang H,etal.Cadmium selectively induces MIP-2 and COX-2 through PTEN-mediated Akt activation in RAW264.7 cells〔J〕.Toxicol Sci,2014;138(2):310-21.
〔2014-04-12修回〕
(编辑袁左鸣/滕欣航)
