降钙素基因相关肽对维甲酸致老年骨质疏松大鼠OPG/RANKL信号通路的影响及疗效
2015-12-29陈光华,黄贵芝,林颢等
降钙素基因相关肽对维甲酸致老年骨质疏松大鼠OPG/RANKL信号通路的影响及疗效
陈光华黄贵芝林颢吴浩俊陈航
(广东医学院附属医院骨科中心,广东湛江524001)
摘要〔〕目的探讨降钙素基因相关肽(CGRP)对维甲酸致老年骨质疏松大鼠骨保护素(OPG)/核因子κB受体活化因子配体(RANKL)信号通路的影响及疗效。方法72只15月龄雄性SD大鼠随机分为对照组、维甲酸组、CGRP组和CGRP8-37(CGRP拮抗剂)组,每组18只;后3组用维甲酸80 mg·kg-1·d-1灌胃,1次/d,连续灌胃2 w。维甲酸组腹腔注射生理盐水1 ml,1次/d,6次/w;CGRP组腹腔注射1 ml CGRP(30 μg/kg),1次/d,6次/w;CGRP8-37组先腹腔内注射1 ml CGRP8-37(30 μg/kg),再向腹腔内注射1 ml CGRP(30 μg/kg),1次,6次/w;以上各组均干预2 w。采用双能X射线骨密度仪检测大鼠股骨骨密度(BMD);比较各组血清白细胞介素(IL)-6、IL-1、肿瘤坏死因子(TNF)-α、OPG和 RANKL水平;RT-PCR法检测各组大鼠骨组织OPG mRNA和 RANKL mRNA表达。结果与对照组比较,维甲酸组大鼠左、右股骨BMD明显降低(P<0.05);与维甲酸组比较,CGRP组大鼠左、右股骨BMD均显著升高(P<0.05);而CGRP8-37组大鼠左、右股骨BMD均明显低于CGRP组(P<0.05)。与对照组比较,维甲酸组大鼠血清OPG水平和骨组织OPG mRNA表达明显下降,而血清RANKL、IL-1、IL-6、TNF-α水平和骨组织RANKL mRNA表达明显升高(P<0.01);与维甲酸组比较,CGRP组大鼠血清OPG和骨组织OPG mRNA明显升高,而血清RANKL、IL-1、IL-6、TNF-α水平和骨组织RANKL mRNA表达显著降低(P<0.01);CGRP8-37组大鼠血清OPG水平和骨组织OPG mRNA明显低于CGRP组,而血清RANKL、IL1、IL-6、TNF-α水平和骨组织RANKL mRNA显著高于CGRP组(P<0.01)。结论降钙素基因相关肽可明显提高维甲酸老年骨质疏松大鼠股骨BMD,其作用可能与抑制机体IL-1、IL-6、TNF-α水平从而调节OPG/RANKL平衡有关。
关键词〔〕降钙素基因相关肽;维甲酸;骨质疏松;骨保护素;核因子κB受体活化因子配体
中图分类号〔〕R69〔文献标识码〕A〔
通讯作者:陈航(1964-),男,主任医师,主要从事创伤骨科、骨质疏松研究。
第一作者:陈光华(1980-),男,硕士,副主任医师,主要从事创伤骨科、骨质疏松研究。
骨质疏松临床以骨量减少和骨组织结构退化为病理特征,由于骨的脆性增加以致易于发生骨折,为骨科常见病,以中老年人多见〔1〕。目前骨质疏松的病因尚不十分清楚,如可能与降钙素、甲状旁腺素、性激素以及维生素等代谢异常关系密切。降钙素基因相关肽(CGRP)作为一种多生物活性神经肽,与降钙素在结构和功能上具有一定相似性,近年其对骨质疏松的作用受到广泛关注。人体破骨细胞和成骨细胞均有CGRP受体,CGRP能够与这些受体结合调节破骨细胞和成骨细胞的功能,从而对骨的生长、修复以及改建等方面发挥重要作用〔2〕。研究发现,CGRP在骨质疏松患者外周血中含量明显增高,且伴随骨密度(BMD)的降低CGRP含量逐渐升高〔3〕;因此,CGRP在骨质疏松的发生发展过程中可能起到重要调节作用;然而,关于CGRP直接干预治疗骨质疏松的相关研究鲜见报道。本研究采取大鼠维甲酸骨质疏松为模型,观察CGRP及其拮抗剂对股骨BMD的影响以及可能机制。
1资料与方法
1.1动物72只15月龄SPF级雄性SD大鼠,体质量260~300 g,由广西医科大学实验动物中心提供,许可证号:scxk桂2009-0002;大鼠分笼饲养,自由饮水进食,温度控制在(24±2)℃,相对湿度控制在(60±2)%,12 h/12 h明暗周期,实验前适应环境3 d。
1.2主要试剂与仪器CGRP和CGRP8-37(CGRP受体拮抗剂)购于Sigma公司,维甲酸(纯度99.12%)由陕西森弗生物技术有限公司生产,大鼠血清白细胞介素(IL)-6、IL-1、肿瘤坏死因子(TNF)-α、核因子κB受体活化因子配体(RANKL)、骨保护素(OPG)ELISA检测试剂盒由上海广锐生物科技有限公司提供,Trizol为美国 Invitrogen 公司产品,PCR引物购于大连宝生物公司,反转录和SYBR Premix Ex TaqTM PCR Kit 为日本 TaKaRa 公司产品;MEDI LINK双能X线骨密度检测仪,法国Osteospace公司生产;Model680型酶标仪为美国Bio-Rad公司产品;ABI7500荧光定量PCR仪为美国Life Technology公司产品。
1.3分组与造模〔4〕72只SD大鼠随机分为对照组、维甲酸组、CGRP组和CGRP8-37组,每组18只;后3组用维甲酸80 mg·kg-1·d-1灌胃,对照组给予等体积蒸馏水灌胃,1次/d,连续2 w,各组大鼠给予相应干预措施;对照组和维甲酸组:腹腔注射生理盐水1 ml,1次/d,6次/w。CGRP组:腹腔注射1 ml CGRP(30 μg/kg),1次/d,6次/w。CGRP8-37组:先腹腔内注射1 ml CGRP8-37(30 μg/kg),5~8 min后再向腹腔内注射1 ml CGRP(30 μg/kg),1次,6次/w。以上各组均干预2 w。
1.4大鼠股骨BMD测定大鼠均采取0.2%戊巴比妥钠溶液(0.01 ml/kg)腹腔注射麻醉,取大鼠左、右股骨,采用双能X线骨密度仪测定大鼠左、右股骨BMD。
1.5Elisa法检测大鼠血清指标大鼠均用0.2%戊巴比妥钠溶液(0.01 ml/kg)腹腔注射麻醉,取仰卧位固定,正中切口暴露心脏后采血,室温静置1 h,离心10 min,取上层血清,-80℃保存备用;检测指标包括血清IL-6、IL-1、TNF-α、RANKL和OPG,均严格按ELISA试剂盒操作说明进行。
1.6RT-PCR检测大鼠骨组织OPG和RANKL mRNA表达大鼠均采取0.2%戊巴比妥钠溶液(0.01 ml/kg)腹腔注射麻醉,取右下肢1 cm骨组织,充分匀浆,用Trizol法抽提总RNA;取2 μg RNA,行逆转录和PCR扩增反应;PCR反应条件:94℃预变性处理5 min,94℃变性处理40 s,56℃退火30 s,72℃进行35 s,共反应32个循环,72℃延伸8 min,采用β-actin为内参;OPG上游引物:5’-TGGCTGAGTGTYCTGGTGGA-3’,反义引物:5’TGACGGTmGGGAAAGTGG-3’,产物长度430 bp;β-actin上游引物:5’-CTACAATGAGCTGCGTGTGG-3’,反义引物:5’-CGTGAGAAGGTCGGAAGGAA-3’,产物长度527 bp;RANKL上游引物:5’-CTATGATGGAAGGTTCGTGGC-3’;反义引物:5’-CTTGGGATTTTGATGCTGGTT-3’,产物长度319 bp;反应结束后,扩增产物在琼脂糖凝胶上进行电泳,mRNA相对表达量采用2-ΔΔCT法计算。
1.7统计学方法应用SPSS17.0统计软件包进行t检验。
2结果
2.1各组大鼠双侧股骨BMD比较与对照组比较,维甲酸组大鼠左、右股骨BMD明显降低(P<0.05);与维甲酸组比较,CGRP组大鼠左、右股骨BMD均显著升高(P<0.05);而CGRP8-37组大鼠左、右股骨BMD均明显低于CGRP组(P<0.05),见表1。
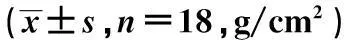
表1 各组大鼠双侧股骨BMD比较
与对照组比较:1)P<0.05;与维甲酸组比较:2)P<0.05;与CGRP组比较:3)P<0.05
2.2各组大鼠血清OPG和RANKL水平比较与对照组相比,维甲酸组大鼠血清OPG明显下降,而RANKL水平明显升高(P<0.01);与维甲酸组比较,CGRP组大鼠血清OPG明显升高,而RANKL水平显著降低(P<0.01);CGRP8-37组大鼠血清OPG水平明显低于CGRP组,而RANKL水平显著高于CGRP组(P<0.01),见表2。
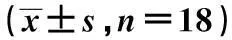
表2 各组大鼠血清OPG和 RANKL水平比较
与对照组比较:1)P<0.01;与维甲酸组比较:2)P<0.01;与CGRP组比较:3)P<0.01,下表同
2.3各组大鼠骨组织OPG和RANKL mRNA表达比较与对照组比较,维甲酸组大鼠骨组织OPG mRNA表达明显下降,RANKL mRNA表达明显升高(P<0.01);与维甲酸组比较,CGRP组大鼠骨组织OPG mRNA明显升高,RANKL mRNA表达明显下降(P<0.01);CGRP8-37组大鼠骨组织OPG mRNA明显少于CGRP组,RANKL mRNA明显高于CGRP组(P<0.01),见图1和表3。
2.4各组大鼠血清IL-1,IL-6和TNF-α水平比较与对照组相比,维甲酸组大鼠血清IL-1、IL-6和TNF-α均明显升高(P<0.01);与维甲酸组比较,CGRP组大鼠血清IL-1、IL-6和TNF-α水平均显著升高(P<0.01);CGRP8-37组大鼠血清IL1、IL-6和TNF-α水平均显著高于CGRP组(P<0.01),见表4。
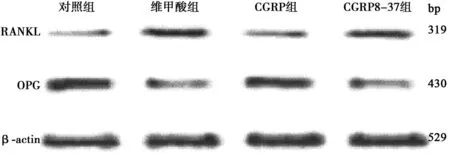
图1 CGRP对OPG和RANKL mRNA表达的影响
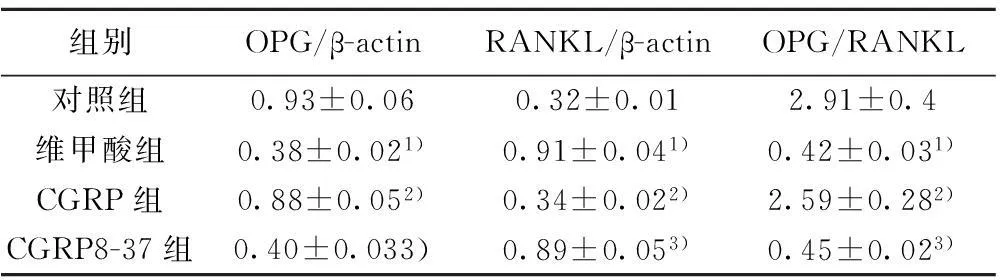
组别OPG/β-actinRANKL/β-actinOPG/RANKL对照组0.93±0.060.32±0.012.91±0.4维甲酸组0.38±0.021)0.91±0.041)0.42±0.031)CGRP组0.88±0.052)0.34±0.022)2.59±0.282)CGRP8-37组0.40±0.033)0.89±0.053)0.45±0.023)
表4 各组血清IL-1,IL-6和TNF-α水平比较
3讨论
骨重建过程包括两个过程,即破骨细胞激活骨吸收开始和成骨细胞激活骨形成终结,期间局部多种因子通过平衡破骨细胞和成骨细胞间的关系实现骨转换速度的调控〔5〕;OPG、RANKL、RANK均为TNF超家族成员,对骨的形成和吸收方面发挥了重要调节作用〔6〕。RANK作为RANKL目前唯一的已知受体,在破骨前体细胞和成熟破骨细胞表面大量表达,RANK与成熟破骨细胞表面RANKL结合能够直接引起破骨细胞的分化和活化〔7〕;而位于破骨细胞前体细胞表面的RANK,已被证实在破骨细胞分化及活化中起到关键作用〔8〕。OPG主要由成骨细胞谱系的各种细胞产生,常以分泌蛋白形式存在,作为RANKL的诱骗受体,竞争性抑制RANKL结合成骨细胞表面RANK,从而阻断其信号通路,抑制破骨细胞的生存、分化活化过程,相反促进成熟破骨细胞凋亡〔9〕;因此,在骨形成与骨吸收的动态平衡过程中,RANKL/OPG起到重要杠杆调节作用。
OPG和RANKL均由成骨细胞产生,也是破骨细胞和成骨细胞之间相互作用的局部调节因子之一;OPG/RANKL的比值受骨吸收与骨形成状况的影响,其高低是破骨细胞诱导分化的关键性因素〔10〕;抑制甚至阻止RANKL与破骨细胞表面RANK相结合,提高OPG/RANKL比值将抑制破骨细胞活化、分化及程度,从而实现骨质疏松防治目的〔10〕。
本研究结果表明,CGRP可能经调节OPG/RANKL比值的平衡,抑制破骨细胞活化、分化和成熟,从而阻断破骨细胞的骨吸收过程,达到治疗骨质疏松的作用。为了更好地证实上述结果,本研究在CGRP治疗前采取CGRP8-37进行干预,结果显示,在影响BMD水平和调节OPG、RANKL表达上明显低于CGRP组,且与对照组相比变化无显著差异。
以往通过选择性切断大鼠神经胫骨骨折模型研究表明,在骨折愈合过程中CGRP可通过平衡OPG/RANKL比值,间接调节破骨细胞活化、分化等达到治疗骨折愈合的作用〔11〕。CGRP也可促进OPG/RANKL比值升高,本实验与上述研究报道结果一致,进一步验证了本研究结果的可靠性,提示,CGRP能够经调节OPG/RANKL比值来调节RANKL-RANKL-OPG体系,进而调控骨的吸收与形成。那么CGRP是如何作用与OPG/RANKL杠杆的呢?本研究还进一步研究了CGRP对RANKL-RANKL-OPG体系的上游作用途径的影响;免疫应答因子IL-1、IL-6和TNF-α均能够诱导成骨细胞RANKL表达以及破骨细胞的产生、活化〔12〕;IL-1能够诱导破骨细胞TNF 受体相关因子6的表达,提高RANKL/RANK信号通路级联,直接促进破骨细胞的分化〔13〕;TNF-α经正向调节RANKL产生,进而使破骨细胞形成增多〔14〕。IL-6通过调节破骨细胞上RANK表达及成骨细胞上RANKL表达,经RANK信号通路促进破骨细胞分化〔15〕。
本研究显示,CGRP可能经抑制大鼠IL-1、IL-6和TNF-α蛋白表达,抑制OPG/RANKL体系,从而调节破骨细胞的作用,达到骨质疏松治疗作用。
我们知道,MAPK介导的信号途径是RANKL-RANKL-OPG体系向下游传递信号的主要通路,那么在CGRP抑制IL-1、IL-6和TNF-α蛋白表达,减弱RANKL-RANKL信号传递而增强OPG/RANKL系统的反应中,其对下游信号的调节又如何,有待于进一步探讨。
4参考文献
1刘东,孙远新,张克非,等.微创经皮椎弓根固定联合伤椎椎体成形术治疗中老年骨质疏松性胸腰椎骨折36例〔J〕.中国老年学杂志,2012;32(12):2641-2.
2Bo Y,Yan L,Gang Z,etal.Effect of calcitonin gene-related peptide on osteoblast differentiation in an osteoblast and endothelial cell co-culture system〔J〕.Cell Biol Int,2012;36(10):909-15.
3Notoya M,Arai R,Katafuchi T,etal.A novel member of the calcitonin gene-related peptide family,calcitonin receptor-stimulating peptide,inhibits the formation and activity of osteoclasts〔J〕.Eur J Pharmacol,2007;560(2-3):234-9.
4孙炜,赵效国,李小玲.骨质疏松模型大鼠骨磷、骨钙含量测定〔J〕.中国骨质疏松杂志,2010;16(7):490-2.
5廖二元,谭利华.代谢性骨病学〔M〕.北京:人民卫生出版社,2003:184-228.
6陈居铕,陈鸿辉.OPG/PANK/PANKL细胞信号通路在骨性关节炎中作用的研究进展〔J〕.中国矫形外科杂志,2011;19(5):395-7.
7Ostrowska Z,Ziora K,Owicimska J,etal.RANKL/RANK/OPG system and bone status in females with anorexia nervosa〔J〕.Bone,2012;50(1):156-60.
8Lee B,Kim TH,Jun JB,etal.Direct inhibition of human RANK+ osteoclast precursors identifies a homeostatic function of IL-1beta〔J〕.J Immunol,2010;185(10):5926-34.
9Dougall WC.Molecular pathways:osteoclast-dependent and osteoclast-independent roles of the RANKL/RANK/OPG pathway in tumorigenesis and metastasis〔J〕.Clin Cancer Res,2012;18(2):326-35.
10Chen B,Li XD,Liu DX,etal.Canonical Wnt signaling is required for Panax notoginseng saponin-mediated attenuation of the RANKL/OPG ratio in bone marrow stromal cells during osteogenic differentiation〔J〕.Phytomedicine,2012;19(11):1029-34.
11杨亚东,周娟,高辉,等.失神经支配在大鼠骨折愈合过程中降钙素基因相关肽对骨保护素/破骨细胞分化因子影响的实验研究〔J〕.中华手外科杂志,2012;28(4):233-7.
12Jurado S,Garcia-Giralt N,Díez-Pérez A,etal.Effect of IL-1beta,PGE(2) ,and TGF-beta1 on the expression of OPG and RANKL in normal and osteoporotic primary human osteoblasts〔J〕.J Cell Biochem,2010;110(2):304-10.
13Kim JH,Jin HM,Kim K,etal.The mechanism of osteoclast differentiation induced by IL-1〔J〕.J Immunol,2009;183(3):1862-70.
14Zupan J,Komadina R,Marc J.The relationship between osteoclastogenic and anti-osteoclastogenic pro-inflammatory cytokines differs in human osteoporotic and osteoarthritic bone tissues〔J〕.J Biomed Sci,2012;19(1):28.
15Yoshitake F,Hoh S,Narita H,etal.Intedeukin-6 directly inhibits osteoelast differentiation by suppressing receptor aetivatorof NF-kappaB signaling pathways〔J〕.J Biol Chem,2008;283(17):11535-40.
〔2014-06-15修回〕
(编辑安冉冉/曹梦园)
