温度对考马斯亮蓝法测定蛋白质浓度的影响
2015-12-28赵卓嵇雅茹籍浩天赵海荣郝锡联吉林师范大学生命科学学院吉林四平136000
赵卓,嵇雅茹,籍浩天,赵海荣,郝锡联(吉林师范大学生命科学学院,吉林四平136000)
蛋白质是构成生物体细胞组织的重要成分,在生命体内参与细胞构建、物质运转、营养代谢、激素调控和酶促反应等多种生命活动,在生物体发育过程中几乎参与所有重大生命事件[1-2]。因此,对蛋白质含量的测定,是生命科学研究领域中最常用检测手段,对其定性、定量分析是功能分析、食品检验、疾病诊断、临床检验中最基础的分析方法之一。目前,常用的蛋白质测定方法有凯氏定氮法、Folin-酚试剂法、紫外吸收法、双缩脲法、考马斯亮蓝染色法等[3-6]。鉴于每种蛋白质测定方法都有各自的局限性和优缺点,不能在任何条件下适用于各种蛋白质类型检测,需考虑到测定过程中的干扰物质、蛋白质性质、外界环境理化因子影响等多种因素,为提升蛋白质测定结果的精准性,需要对蛋白质不同的测定方法进行条件优化与筛选[7-8]。
自1976年Bradford发明快速测定微克量蛋白质的考马斯亮蓝法(G250)以来,考马斯亮蓝法便以灵敏、精准、便捷等测定优势得到迅速的推广和广泛的应用[9-11]。考马斯亮蓝染料在游离状态下呈棕红色,当与蛋白质结合后呈蓝青色,蛋白质含量为0~1 000 μg范围内时,蛋白质与色素结合物在595 nm下的吸光度与蛋白质含量成正比。考马斯亮蓝法测定蛋白质的优点在于:其一灵敏度高,据估计,考马斯亮蓝法比紫外吸收法灵敏10~20倍,比Biuret法灵敏100倍,比Lowry法约高4倍[10];其二,测定快速、简便,只需加一种染液,由于染料与蛋白质结合过程只需2 min即可完成蛋白质含量测定[11-12];其三,干扰物少提升了测定结果的精准性。所以,考马斯亮蓝法自问世以来对蛋白质含量测定得到学术界广泛接受和认同[12]。
蛋白质定量测定是科研、临床检验中的常见实验环节,测定精确与否对后续实验结果的影响至关重要。尽管考马斯亮蓝法测定蛋白质具有快速、灵敏度高、稳定以及测量结果准确等诸多优点,但在蛋白质的测定过程中仍存在很多因素影响蛋白质测定的准确性,诸如温度、光照等环境因子会对蛋白质测定产生不同程度的影响,研究显示,温度对蛋白质结晶具有重要影响[13]。目前未见有关温度与考马斯亮蓝法测定蛋白质浓度精准关系方面的研究报道。该研究以已知蛋白浓度为测试样品,研究温度在考马斯亮蓝法测定蛋白质浓度过程中的影响因子和作用程度,为今后科研工作中测定蛋白质浓度准确性提供建议和指导。
1 材料与方法
1.1 标准蛋白质的配制 称取牛血清白蛋白10 mg,溶于蒸馏水并定容至100 ml,制成100 μg/ml的蛋白质标准液,存放于棕色瓶中,4℃保存备用。
1.2 考马斯亮蓝的制备 称取G250染料100 mg,溶于50 ml 95%乙醇中,加入85%的磷酸100 ml,磁力搅拌至全部溶解后,蒸馏水定容至1 000 ml,过滤后置于棕色试剂瓶中,4℃保存备用。
1.3 标准曲线方程的建立 取6支试管,分别加入0.2~1.0 ml标准蛋白质溶液和蒸馏水混匀后,向各管中加入5 ml G250溶液。充分摇匀,混合后静置2 min左右,在595 nm波长处测定OD值。以蛋白质含量为横坐标,以吸光度为纵坐标绘制标准曲线,求得线性回归方程。
1.4 配置不同浓度的牛血清蛋白 准确配置浓度为100、75、50、25、5 μg/ml的牛血清蛋白,置于棕色瓶中,于 4 ℃冰箱中保存。
1.5 不同温度处理蛋白质浓度测定 取各浓度蛋白质溶液1 ml,加入5 ml G250 溶液混合后在 0、10、20、30、40、50 ℃条件下孵育,以蒸馏水为空白对照,分光光度计测定OD595值,每隔10 min测得数据。5次重复。
1.6 数据分析与绘图 根据标准曲线计算待测样品溶液中的蛋白质含量,试验所得数据用SPSS软件进行ANOVA分析,图中数据采用Mean表示,显著水平P≤0.05。
2 结果分析
2.1 不同温度处理下5 mg/ml蛋白质浓度动态变化 表1表明,当蛋白质浓度为5 mg/ml时,在温度为0℃时,蛋白质浓度测定值为10.95 μg/ml,与标准蛋白浓度比误差百分比达到118.93%;当温度为10~30℃时,蛋白质浓度测定值显著升高,与标准蛋白浓度比误差百分比达到156.8%以上;当温度为40~50℃时,蛋白质浓度测定值升高极显著,与标准蛋白浓度比误差百分比高达215%以上。此外,各温度条件下,蛋白质浓度测定值都会随孵育时间的延长显著增加,其中40℃孵育30 min和50℃孵育20 min后蛋白质浓度超出分光光度计测定范围。
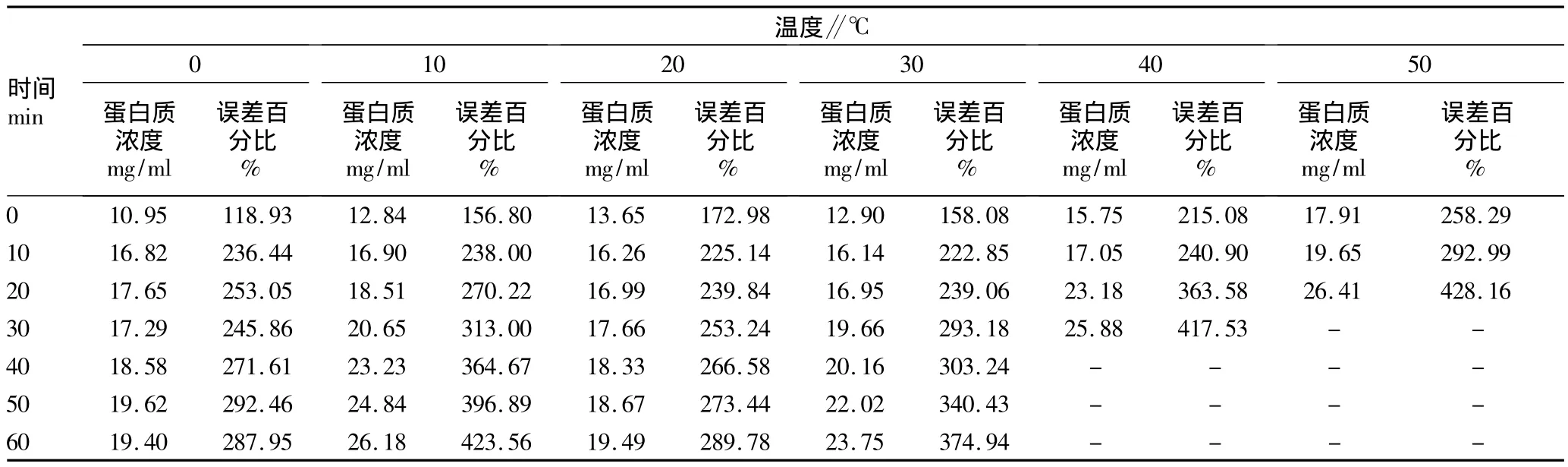
表1 不同温度对考马斯亮蓝法测定5 mg/ml蛋白质浓度的动态影响
2.2 不同温度处理下25 mg/ml蛋白质浓度动态变化 当蛋白质浓度为25 mg/ml时(表2),在温度为0℃时,蛋白质浓度测定值为20.13 μg/ml,与标准蛋白浓度比误差百分比为19.47%。当温度为10℃时,蛋白质浓度测定值仍较低,与标准蛋白浓度比误差百分比达到28.84%;当温度为20~30℃时,蛋白质浓度测定值显著升高,与标准蛋白浓度比误差百分比为9.65% ~11.24%;当温度为40~50℃时,蛋白质浓度测定值显著降低,与标准蛋白浓度比误差百分比为8.78% ~12.4%。此外,随着蛋白质与染料孵育时间延长,0~10℃时蛋白质浓度测定值显著降低、误差百分比显著增加,20℃时蛋白质浓度测定值降低、误差百分比出现先降低后增加的趋势,在30 min孵育时最接近标准蛋白浓度误差百分比仅为0.35%,30~50℃时蛋白质浓度测定值急剧下降、误差百分比显著增加,其中40和50℃孵育30 min后蛋白质浓度超出分光光度计测定范围。
2.3 不同温度处理下50 mg/ml蛋白质浓度动态变化 当蛋白质浓度为50 mg/ml时(表3),在温度为0℃时,蛋白质浓度测定值为52.52 μg/ml,与标准蛋白质浓度比误差百分比为5.04%。当温度为10℃时,蛋白质浓度测定值最接近标准蛋白浓度,与标准蛋白质浓度比误差为2.02%。当温度为20℃时,蛋白质浓度测定值升高,与标准蛋白浓度比误差百分比为3.91%。当温度为30~50℃时,蛋白质浓度测定值显著降低,与标准蛋白浓度比误差百分比在3.98% ~5.09%间波动。此外,随着蛋白质与染料孵育时间的延长,0~10℃和30~50℃时蛋白质浓度测定值显著下降、误差百分比显著增加,其中40和50℃孵育30 min后蛋白质浓度超出分光光度计测定范围。20℃时蛋白质浓度测定值随着孵育时间延长出现下降,但在孵育30 min时蛋白质浓度测定值最接近标准蛋白浓度,误差百分比为0.22%,此后误差百分比又逐渐升高。
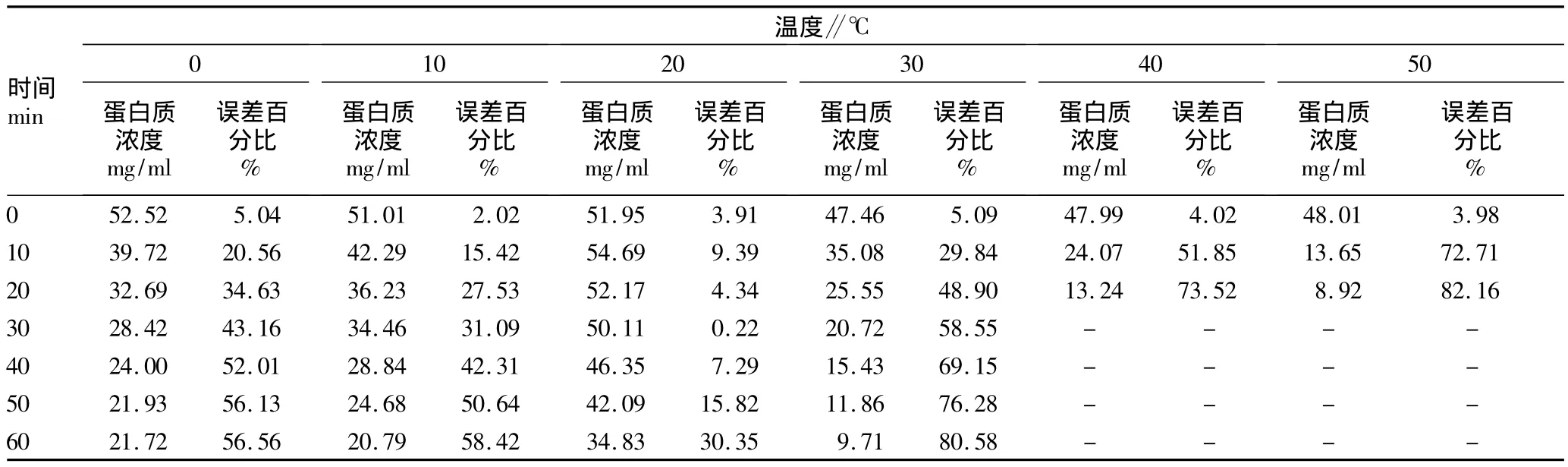
表3 不同温度对考马斯亮蓝法测定50 mg/ml蛋白质浓度的动态影响
2.4 不同温度处理下75 mg/ml蛋白质浓度动态变化 当蛋白质浓度为75 mg/ml时(表4),在0~50℃温度时,蛋白质浓度测定值与标准蛋白浓度比误差百分比在0.48% ~2.80%间波动,其中40℃时最接近标准蛋白浓度。随着蛋白质与染料孵育时间延长,0~10℃和30~50℃时蛋白质浓度测定值显著下降、误差百分比显著增加,其中40℃孵育30 min和50℃孵育20 min后蛋白质浓度超出分光光度计测定范围。20℃时蛋白质浓度测定值随着孵育时间延长出现下降,但在孵育20 min时蛋白质浓度测定值最接近标准蛋白浓度,误差百分比为1.13%,此后误差百分比又逐渐升高。
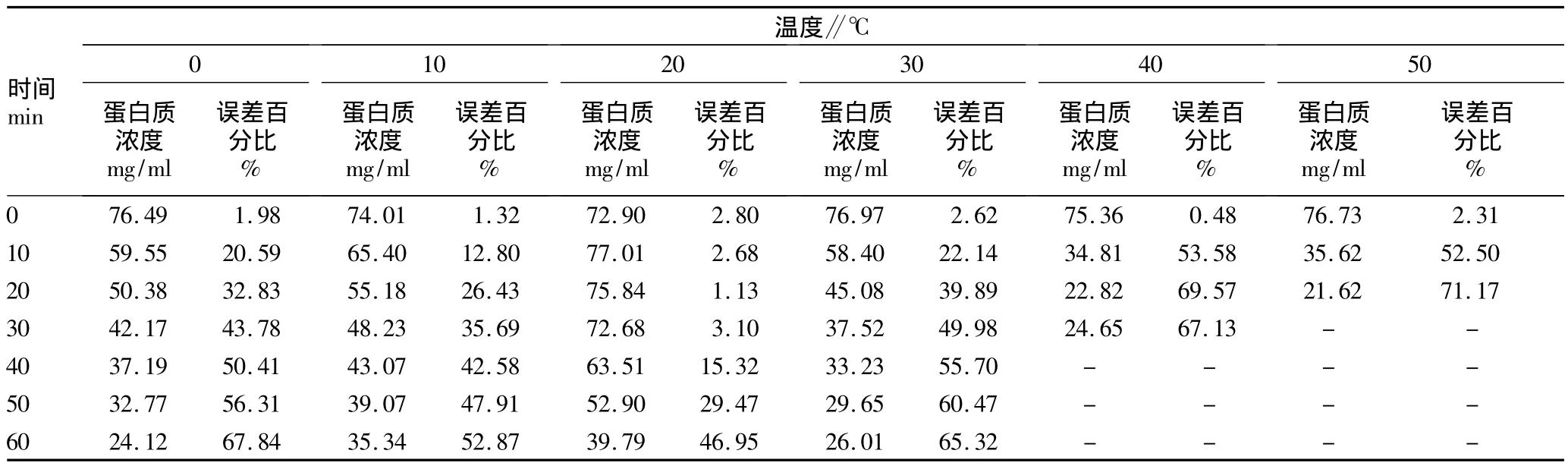
表4 不同温度对考马斯亮蓝法测定75 mg/ml蛋白质浓度的动态影响
2.5 不同温度处理下100 mg/ml蛋白质浓度动态变化 当蛋白质浓度为100 mg/ml时(表5),在0~50℃温度时,蛋白质浓度测定值与标准蛋白浓度比误差百分比在3.97% ~5.79%间波动,其中10℃时最接近标准蛋白浓度。随着蛋白质与染料孵育时间延长,0~10℃和30~50℃时蛋白质浓度测定值显著下降、误差百分比显著增加,其中40℃孵育30 min和50℃孵育20 min后蛋白质浓度超出分光光度计测定范围。20℃时蛋白质浓度测定值孵育0~20 min间比较稳定,孵育30 min时蛋白质浓度测定值下降但最接近标准蛋白浓度,误差百分比为2.18%,此后蛋白质浓度测定值和误差百分比又显著升高。

表5 不同温度对考马斯亮蓝法测定100 mg/ml蛋白质浓度的动态影响
3 讨论
考马斯亮蓝法已经广泛应用于各种生物材料的蛋白质含量测定,被众多科研工作者认为是一种传统的、稳定的和可靠的蛋白质测定方法。但该论文研究发现,温度、测定蛋白质浓度以及测定有效时间等影响因子都决定考马斯亮蓝法测定蛋白质浓度的精度以及后续蛋白质研究的准确程度。
从温度变化效应来看,无论蛋白质浓度高低,0~10℃低温组和30~50℃高温组考马斯亮蓝法测定的蛋白质浓度与标准蛋白浓度比较均有显著差异,20℃时测定的蛋白质浓度与标准蛋白浓度比较均差异最小。从蛋白质浓度效应来看,在该研究建立的蛋白质测定范围内(0~100 mg/ml),蛋白质浓度较低组(如5 mg/ml)采用考马斯亮蓝法测定结果极不稳定且误差率极大,而蛋白质浓度越高考马斯亮蓝法测定的蛋白质浓度与标准蛋白浓度相比越稳定,同时蛋白质浓度越高对温度变化引起的影响越小,其中蛋白质浓度在25~100 mg/ml各组中,20℃时考马斯亮蓝法测定的蛋白质浓度与标准蛋白浓相比差异最小。从测定时间效应来看,在0~10℃低温组中考马斯亮蓝法测定的蛋白质浓度随着孵育时间延长与标准蛋白浓度比较差异显著,在30~50℃高温组中考马斯亮蓝法测定的蛋白质浓度随着孵育时间延长与标准蛋白浓度比较差异极显著,尤其是在40~50℃高温时各浓度蛋白质孵育至30~40 min后超出分光光度计检测范围,但在20℃时测定的蛋白质浓度在孵育0~30 min过程中表现稳定,尤其是孵育20~30 min后蛋白质浓度与标准蛋白浓度比较均差异最小。
通过对考马斯亮蓝法测定蛋白质浓度的诸多影响因素的研究,得出最优化试验方案,在0~100 mg/ml蛋白质浓度标准曲线测定范围内,20℃是考马斯亮蓝染料最适温度,因此在测定蛋白质浓度过程中表现出稳定的结果,但是20℃时反应最佳时间在孵育20~30 min后才表现出来,推测考马斯亮蓝染料与蛋白质结合需要一定的时间才能达到最佳效果。同时待检测蛋白质浓度越高,考马斯亮蓝法测定蛋白质浓度过程中对各种因素影响的抵御能力越强,推测是较高浓度的蛋白质对考马斯亮蓝染料保护性较强,对外界环境影响具有较好的抵御能力,所以在蛋白质浓度测定中表现出稳定的结果。
综上所述,采用考马斯亮蓝法测定蛋白质浓度时,要注意试验环境温度、待测样品浓度范围以及染料与蛋白质孵育时间等互作效应,合理优化测定方案,旨在充分利用考马斯亮蓝法的优点准确测定蛋白质浓度,为进一步研究蛋白质性质和功能提供科学依据。
[1]TANG W,LUO X Y,VANESSA S.Analysis of protein interaction:probing the function of proteins with yeast two hybrid system[J].Forestry Studies in China,2002,4(1):49 -57.
[2]蒋英芝,贺连华,刘建军.蛋白质功能研究方法及技术[J].生物技术通报,2009(9):38-43.
[3]王芳,包怡红,于震.食品中蛋白质快速检测技术的研究[J].食品工业科技,2014,35(11):372 -375.
[4]WATERBORG J H.The protein protocols handbook[M].Germany:Springer-Verlag,2009:7 -10.
[5]杨玉芳.蛋白质含量测定方法[J].明胶科学与技术,2007,27(2):98-101.
[6]李宁.几种蛋白质测定方法的比较[J].山西农业大学学报,2006,26(2):132 -134.
[7]赵静,傅泽田,路勇,等.四种蛋白质分析方法在液态乳中的适应性研究[J].中国乳品工业,2010,38(6):43 -46.
[8]李存富.关于蛋白质测定中几个问题的理论分析与讨论[J].中国酿造,2004(9):29-30.
[9]许淑芳,朱江,刘邻渭.考马斯亮兰G-250法测定苹果浓缩汁生产中的蛋白含量[J].饮料工业,2005,8(1):45 -48.
[10]赵英勇,戴云,崔秀明,等.考马斯亮蓝G-250法测定草乌中可溶性蛋白质含量[J].云南民族大学学报,2006,15(3):235 -237.
[11]冯昕,王吉中,尧俊英,等.考马斯亮蓝法测定乳与乳制品中蛋白质的含量[J].粮食与食品工业,2010,17(3):57 -59.
[12]陈丽娜,王倩,尚玉奎,等.人类蛋白质结构互作网络——结构域对网络拓扑与蛋白质功能的影响[J].生物化学与生物物理进展,2010,37(5):517-526.
[13]鹿芹芹,解思晓,马晓亮,等.温度控制在蛋白质结晶中的应用[J].材料导报,2010,24(10):13 -21.
