紫荆果总黄酮清除自由基作用研究
2015-12-27孙秀青
孙秀青
(鹤壁职业技术学院,河南鹤壁458030)
紫荆果总黄酮清除自由基作用研究
孙秀青
(鹤壁职业技术学院,河南鹤壁458030)
筛选紫荆果总黄酮的最佳提取工艺条件,研究紫荆果总黄酮提取液对羟自由基(·OH)清除活性,为紫荆潜在应用价值的开发提供参考。采用乙醇浸提法提取紫荆果中总黄酮,初步探究乙醇浓度、料液比、浸提温度、浸提时间4个单因素对紫荆果中总黄酮提取率的影响,设计L9(34)正交试验确定紫荆果中总黄酮提取的较佳实验条件。通过与BHT的对照实验,初步探究了紫荆果中的总黄酮对羟自由基(·OH)的清除活性。实验结果显示:料液比为1.5∶60(g/mL),浸提时间为2.5 h,浸提温度为80℃,提取剂乙醇浓度为75%,此条件下总黄酮提取率可高达2.910%。对照实验结果显示紫荆果中的总黄酮对羟自由基(·OH)清除活性高于相同浓度的BHT。紫荆果中总黄酮含量较高,且对羟自由基(·OH)具有较强的清除活性。
紫荆果;总黄酮;提取率;清除活性;羟自由基
近年来,由于自由基生命科学的进展,使具有很强的抗氧化和消除自由基作用的黄酮类化合物受到空前的重视。黄酮类化合物是一类多酚类物质,广泛存在于高等植物及以植物为原料的食品中,是植物在长期自然选择过程中产生的一些次级代谢产物,参与了磷酸与花生四烯酸的代谢、蛋白质的磷酸化、钙离子的转移、自由基的清除、抗氧化活力的增强、氧化还原作用、螯合作用和基因的表达,是一类极具开发前景的天然药物[1-4]。
紫荆,属豆科植物,因“其木似黄荆而色紫,故名。又名:满条红、乌桑、箩筐树、紫金盘、扁头翁。根皮(紫荆根皮)、木部(紫荆木)、花(紫荆花)、果实(紫荆果)可供药用。研究发现,紫荆含有丰富的黄酮类化合物[5]。根据文献调研,徐美奕等从紫荆花中分离、纯化总黄酮,对其黄酮成分及含量进行了光谱分析,进行了紫荆花总黄酮提取工艺的优化研究[6]。李君玲对紫荆皮总黄酮超声提取工艺优化进行了研究[7]。到目前为止,鲜见有关紫荆果中总黄酮的研究报道,本研究对紫荆果中总黄酮的含量进行了测定,并以总黄酮得率为考察指标,优化其醇沉提取工艺,并初步探究提取物的抗氧化性质,即对羟自由基的清除活性,为紫荆在医药领域的潜在应用及综合开发利用提供数据参考。1 材料与仪器
紫荆果:采集于公园,洗净,烘干,粉碎(备用)。
无水乙醇、芦丁、二丁基羟基甲苯、水杨酸、氢氧化钠、硝酸铝、亚硝酸钠、硫酸亚铁、双氧水、氯化铁。均为市购,优级纯。
CP214C电子天平:德国赛多利斯;722N可见分光光度计:上海光学仪器厂;SHSG-3050型高速多功能粉碎机:上海硕光科技有限公司;202-0A电热恒温干燥箱:北京金志业仪器设备有限责任公司;HH.S11-Ni4电热恒温水浴锅:北京三二八科学仪器有限公司。
2 方法
2.1 总黄酮提取率的计算方法
[8]进行显色反应,用分光光度法测得吸光度值。吸光度与总黄酮浓度服从朗伯-比尔定律[9]。将所测吸光度值代入线性回归方程求出提取液中总黄酮浓度,按下式计算总黄酮提取率:
总黄酮提取率=C×V1M×V2×50×10-3×100%
式中:V1为第二次定容后提取液的体积50mL;V2从母液中量取的提取液体积0.50mL;C为提取液中总黄酮浓度;M为样品(紫荆果)质量。
2.2 总黄酮对羟自由基的清除作用
参照Fenton反应体系,利用H2O2与Fe2+混合后产生存活时间短,反应活性高的羟自由基(·OH)的性质,向反应体系中加入水杨酸,水杨酸能有效捕捉·OH并与其反应产生有色络合物,该络合物在波长为510 nm处有强吸收。若向该体系中加入总黄酮,与水杨酸竞争羟自由基,导致有色络合物产生量减少。固定反应时间,在510 nm波长处测紫荆果提取液的吸光度,与空白液对照,便能测定紫荆果中总黄酮对羟自由基的清除率。
3 结果与分析
3.1 最大吸收波长的选择
芦丁标准液的配制:芦丁标准样在干燥箱中干燥至恒温,用电子天平准确称取芦丁标准样品0.010 0 g,加70%乙醇溶液溶解,用相同浓度乙醇溶液定容到50mL容量瓶中,摇匀,即得0.2mg/mL的芦丁标准液。
最大吸收波长的选择:用最大刻度为1mL的吸量管准确吸取0.50mL的芦丁标准溶液于50mL容量瓶中,显色反应参考文献[9]。以试剂空白作参比,在460 nm~560 nm之间测定络合物吸光度,确定最大吸收波长。用最大刻度为1mL的吸量管准确吸取0.50mL紫荆果提取液于50mL容量瓶中,显色方法如前。以试剂空白作参比,在460 nm~560 nm之间测定络合物吸光度,确定最大吸收波长。
图1分别为芦丁标准溶液和紫荆果中总黄酮提取液的吸收光谱。

图1 芦丁标准溶液和总黄酮提取液的吸收光谱Fig.1 Theabsorption spectrum of diagram of Rutin solution and flavonoidsextracts
结果显示随着测定波长的增大,吸光度值越来越大,在510 nm处有最大吸收峰,而后随着波长增加,吸光度值反而逐渐减小,根据实验结果确定510 nm为黄酮类物质的最大吸收波长,此后的吸光度值均在此最大吸收波长下测定。
3.2 芦丁标准曲线的绘制
准确吸取0.2 mg/mL的芦丁标准液0.00、2.50、3.50、4.50、5.50、6.50mL分别置于50mL容量瓶中,各加入5%亚硝酸钠溶液0.40m L,摇匀,静置6min;加10%硝酸铝溶液0.40mL,摇匀,静置6 min;加4%氢氧化钠溶液5.00mL,用浓度为70%的乙醇溶液定容至50.00mL,摇匀,静置10min。在510 nm波长处以试剂空白为参比测定吸光度,绘制标准曲线得回归方程,见图2。
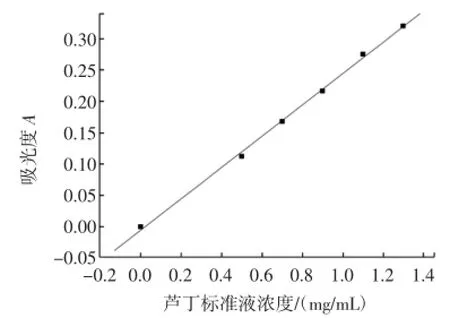
图2 芦丁溶液标准曲线Fig.2 The standard curveof rutin solu tion
由芦丁标准曲线,得回归方程为A=-0.005 3+ 0.245 8C,R2=0.999 04。
3.3 紫荆果中总黄酮提取及定性实验
3.3.1 紫荆果中总黄酮的提取
准确称取2.000 0 g的紫荆果粉末,用60mL浓度为75%的乙醇溶液做提取剂,水浴浸提2 h,将提取液过滤,用相同浓度的乙醇溶液洗涤并定容至50mL容量瓶中,即得总黄酮提取液。
3.3.2 总黄酮提取液定性实验
铝盐反应:用量筒量取提取液、芦丁标准溶液各2.0 m L于2支小试管中,各滴加几滴1%硝酸铝溶液,振荡,观察实验现象。
氢氧化钠反应:用量筒量取提取液、芦丁标准溶液各2.0m L于2支小试管中,各滴加几滴4%氢氧化钠溶液,振荡,观察实验现象。
铁离子反应:用量筒量取提取液、芦丁标准溶液各2.0m L于2支小试管中,各滴加几滴5%三氯化铁溶液,振荡,观察实验现象。
3.3.3 定性实验结果及分析
对紫荆果提取液和芦丁标准溶液分别进行显色反应,结果如表1所示。

表1 总黄酮提取液与芦丁标准溶液的颜色反应Table1 Chromogenic reaction of flavonoidsextractsand rutin solution
通过显色结果对比:紫荆果提取液显色反应现象与黄酮类化合物的显色一致,说明提取液中含有黄酮类化合物。
3.4 单因素试验及结果分析
3.4.1 乙醇浓度对总黄酮提取率的影响
准确称取2.000 0 g的紫荆果粉末,固定料液比为2∶60(g/mL),改变提取剂乙醇浓度分别为55%、60%、65%、70%、75%、80%,在80℃恒温水浴中浸提2 h,将提取液冷却至室温过滤、洗涤、合并提取液和洗涤液,并用与提取剂相同浓度的乙醇溶液在50mL容量瓶中定容。乙醇提取液的显色反应方法如前,在510nm波长处测其吸光度,做3组平行实验。将吸光度的平均值代入线性回归方程,计算提取液中总黄酮浓度和紫荆果中总黄酮提取率,选择较佳的提取剂(乙醇)浓度。
由图3可知,乙醇浓度在55%~70%之间,吸光度值逐渐增加,乙醇浓度在70%~80%之间,吸光度值逐渐降低。实验结果表明,当乙醇浓度为70%时,吸光度值达到最大,总黄酮提取率最高。即紫荆果中提取总黄酮,提取剂乙醇的较佳浓度为70%。

图3 乙醇浓度对总黄酮提取率的影响Fig.3 Effection of ethanol concentration on the extraction ratio of total flavonoids
3.4.2 料液比对总黄酮提取率的影响
准确称取2.000 0 g的紫荆果粉末,固定提取剂乙醇的浓度为70%,改变料液比分别为:1.0∶60、1.5∶60、2.0∶60、2.5∶60、3.0∶60(g/mL),在80℃的恒温水浴中浸提2 h,将提取液冷却至室温过滤、洗涤、合并提取液和洗涤液,并用与提取剂相同浓度的乙醇溶液在50mL容量瓶中定容。乙醇提取液的显色反应方法如前,在510 nm处测吸光度,平行测定3次,取平均值,代入回归方程,计算紫荆果提取液中总黄酮浓度和紫荆果中总黄酮提取率,选择较佳的料液比。

图4 料液比对总黄酮提取率的影响Fig.4 Effection of solid-liquid ratio on theextraction ratio of total flavonoids
由图4可知,料液比为2.0∶60(g/mL)时,测定提取液的吸光度值最大,即总黄酮提取率最高,结果显示紫荆果中提取总黄酮的较佳料液比为2.0∶60(g/mL)。
3.4.3 浸提温度对总黄酮提取率的影响
准确称取2.000 0 g的紫荆果粉末,固定提取剂乙醇浓度为70%,料液比为2.0∶60(g/mL),在温度分别为50、60、70、80、85、90℃的恒温水浴中浸提2 h,将提取液冷却至室温过滤、洗涤、合并提取液和洗涤液,并用与提取剂相同浓度的乙醇溶液在50mL容量瓶中定容,乙醇提取液的显色反应方法如前,平行测定3次,取平均值,代入回归方程,计算紫荆果提取液中总黄酮浓度和紫荆果中总黄酮提取率,选择较佳的浸提温度。

图5 浸提温度对总黄酮提取率的影响Fig.5 Effection of temperatureon the extraction ratio of total flavonoids
由图5可知,在50℃~80℃之间,总黄酮提取率随温度升高而增加,浸提温度高于80℃,总黄酮提取率随着温度升高而降低,探究其原因可能是温度升高引起的溶剂挥发损耗。实验结果显示紫荆果中提取总黄酮,80℃为较佳的浸提温度。
3.4.4 浸提时间对总黄酮提取率的影响
准确称取2.000 0 g的紫荆果粉末,固定提取剂乙醇的浓度为70%,料液比为2.0∶60(g/mL),在80℃的恒温水浴中分别浸提1.0、1.5、2、2.5、3 h。将提取液冷却至室温过滤、洗涤、合并提取液和洗涤液,用与提取剂相同浓度的乙醇溶液在50mL容量瓶中定容。乙醇提取液的显色反应方法如前。平行测定3次,取平均值,代入回归方程,计算紫荆果提取液中总黄酮浓度和紫荆果中总黄酮提取率,选择较佳的浸提时间。
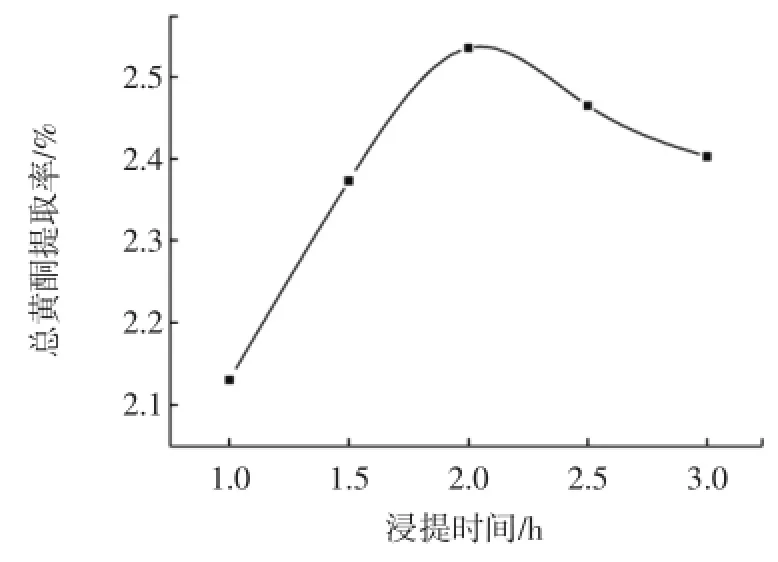
图6 提取时间对总黄酮提取率影响Fig.6 Effection of reflux tim eon theextraction ratio of total flavonoids
由图6可知,总黄酮提取率开始随着时间延长而增加,当时间超过2.0 h后,总黄酮提取率随着时间延长而降低。探究其原因可能是随着时间延长提取剂乙醇的挥发损耗。实验结果显示紫荆果中总黄酮提取的较佳浸提时间为2.0 h。
3.5 正交试验及结果分析
在单因素试验结果基础上,以黄酮提取率为综合考察指标,选定料液比、浸提时间、浸提温度、乙醇浓度四因素,每个因素3个水平,设计L9(34)表进行正交试验,优化紫荆果中总黄酮提取工艺条件。因素水平见表2,正交试验结果见表3。

表2 L9(34)正交试验因素与水平设计Table2 Factorsand levelsof L9(34)orthogonalexperiment

表3 正交试验结果Table3 The resultoforthogonalexperiment
从表3可以看出,本试验中A、B、C、D四个单因素的主次关系是C>B>A>D,即C(浸提温度)为最重要的因素,其次是B(浸提时间),再次是A(料液比),D(乙醇浓度),影响最小。正交试验结果显示,以总黄酮提取率为考察指标,最优实验条件组合是A1B3C2D3。即料液比为1.5∶60(g/m L),浸提时间为2.5 h,浸提温度为80℃,提取剂乙醇浓度为75%。
按照正交试验所确定的最佳提取条件进行验证性试验,做3次平行试验,计算得到紫荆果中总黄酮提取率为2.910%。
3.6 紫荆果中总黄酮对羟基自由基的清除作用
参考Fenton反应体系,加入不同体积的总黄酮提取液,在510 nm波长处测定吸光度[8]。扣除提取液的本底吸收。做3次平行试验,计算提取液中总黄酮对羟自由基的清除率。清除率计算公式:

式中:A0为空白对照溶液吸光度;Ax为提取液吸光度;Ax0为不加H2O2提取液的本底吸光度。
以BHT(二丁基羟基甲苯)为对照,比较两种抗氧化剂对·OH的清除活性。对照实验结果见图7。

图7 紫荆果总黄酮提取液对羟基自由基的清除率Fig.7 Liquid of hydroxyl radicalscavenging rateof extraction of total flavonoids from fruitof Chinese redbud
由图7可知:紫荆果中的总黄酮提取液对羟基自由基(·OH)有清除能力,随着提取液体积增加,清除率也逐渐增加。从图中可以看出:当加入与提取液相同体积的BHT情况下,紫荆果中的总黄酮提取液对羟基自由基(·OH)的清除率要高于BHT(二丁基羟基甲苯)对羟自由基(·OH)的清除率。
4 讨论
利用乙醇单次浸提紫荆果中总黄酮,采用分光光度法测得总黄酮含量为2.910%。与文献中报道的通过醇沉法提取纯化紫荆花中黄酮类化合物,测得总黄酮回收率为7.32%。提取液的抗氧化实验结果显示,紫荆果中总黄酮对羟自由基有较强的清除活性。紫荆果与花、皮一样,同样具有较高的利用价值,有待开发。
5 结论
采用乙醇浸提法提取紫荆果中的总黄酮,设计单因素试验和L9(34)正交试验初步确定了紫荆果中总黄酮提取的较佳实验条件:料液比为1.5∶60(g/mL),浸提时间为2.5 h,浸提温度为80℃,提取剂乙醇浓度为75%。在此条件下总黄酮提取率可高达2.910%。
还对紫荆果中的总黄酮提取液抗氧化性质做了初步探究,对紫荆果中的总黄酮提取液和BHT对羟自由基(·OH)清除活性作了比较。实验结果显示:紫荆果提取液对羟基自由基(·OH)的清除能力要高于BHT(二丁基羟基甲苯)。
参考文献:
[1]谢棒祥,张敏红.生物类黄酮生理功能及其应用研究进展[J].动物营养学报,2003,15(2):11-15
[2]张德权,台建祥,付勤.生物类黄酮的研究及应用概况[J].食品与发酵工业,1999,25(6):52-57
[3]幸宏伟.玫瑰花醇提取物对油脂的抗氧化作用[J].重庆工商大学学报:自然科学版,2006,23(2):150-153
[4]蔡碧琼,蔡珠玉,张福娣,等.稻壳中黄酮提取物的抗氧化性质研究[J].江西农业大学学报,2010,32(4):0813-0818
[5] 徐美奕,韩雅莉,陈志红.紫荆花总黄酮提取工艺的优化研究[J].时珍国医国药,2007,18(11):2712-2713
[6]徐美奕,韩雅莉,东野广智等.紫荆花总黄酮的分离纯化与光谱分析[J].中药材,2007,30(10):1252-1255
[7]李君玲.紫荆皮总黄酮超声提取工艺优化[J].江苏农业科学,2012, 40(7):266-267
[8]文美琼,李璐,杨申明,等.彝药野坝子花总黄酮的提取及对活性氧自由基的清除作用[J].时珍国医国药,2010,21(6):1444-1447
[9]张海悦,张守媛.响应面优化黑葵花籽壳中黄酮的提取及抗氧化性研究[J].中国酿造,2011,30(9):42-47
Study on Scavenging Free Radical of Total Flavonoidsof Cercis Chinensis Bunge
SUN Xiu-qing
(HebiVocationalCollege,Hebi458030,Henan,China)
To optimize the extraction of total flavonoids in Cercis chinensis Bunge and study on the scavenging effecton hydroxyl radicals provide a preparation for potential application.In this study,flavonoids from Cercis chinensis Bungewere extracted by using ethanol.The preferred extraction conditionswere determined by single factor experiment and orthogonal experiment.The experiment reveals that:ethanol concentration of 75%,solid-liquid ratio of1.5∶60(g/mL),temperaturewas80℃and extraction timewas2.5 h.The extraction ratio of flavonoids reached up to 2.910%by using spectrophotometry.Antioxidanteffectsof flavonoidsand BHTwere measured to remove hydroxyl radicals by comparative experiments.Antioxidant experiments showed that flavonoids from CercischinensisBungehavea strongscavengingeffecton hydroxyl radicals.
CercischinensisBunge;flavonoids;extraction ratio;scavengingeffect;hydroxyl radicals
10.3969/j.issn.1005-6521.2015.05.018
2013-11-19
2012河南省科技攻关计划项目(122102110236)
孙秀青(1971—),女(汉),副教授,硕士研究生,研究方向:生物技术。
