碱溶酸沉法提取青稞蛋白质的工艺研究
2015-12-27吴桂玲刘立品李文浩张伟刘晓雪张国权
吴桂玲,刘立品,李文浩,张伟,刘晓雪,张国权
(西北农林科技大学食品学院,陕西杨凌712100)
碱溶酸沉法提取青稞蛋白质的工艺研究
吴桂玲,刘立品,李文浩,张伟,刘晓雪,张国权*
(西北农林科技大学食品学院,陕西杨凌712100)
以藏区典型青稞品种藏青85为试验材料,以料液比、pH、提取温度和提取时间为单因素试验的基础上进行二次正交旋转组合设计,确定了适宜青稞蛋白提取的最佳工艺参数。结果表明,影响青稞蛋白质提取率的因素依次为pH、料液比、提取时间、提取温度,青稞蛋白质提取适宜工艺条件为:料液比1∶25(g/mL),pH 11,提取温度40℃,提取时间20min,青稞蛋白质提取率为70.71%。
青稞;蛋白质;碱溶酸沉法;提取率;二次正交旋转组合设计
青稞(Hordeum vuLgare L.),又称裸大麦、米大麦,属禾本科小麦族大麦属,在我国主要分布于青藏高原地区,是该地区种植面积最广,且最具特色的农作物,具有耐寒、耐贫瘠、适应性广、生育期短、抗逆性强、产量稳定等优良特性[1-3]。藏青85是藏区典型中晚熟超高产品种,具有前期生长快、耐肥水、抗倒伏能力强等特点,其社会效益和经济效益均较突出。青稞具有高蛋白质、高纤维、高维生素、低糖、低脂肪,且富含微量元素硒的营养特点,其粗蛋白质含量7.68%~17.52%,膳食纤维含量13.4%,硒含量0.028mg/kg[4-6]。青稞蛋白含有18种氨基酸,包括人体必需的8种氨基酸,其中赖氨酸含量为0.36 g/100 g,对于补充机体每日必需氨基酸的需要有重要意义[7-10];青稞蛋白还含有丰富的支链氨基酸,有利于肝脏功能的恢复、降低心血管疾病的发生概率等功能[11-12]。
目前,国内外常用物理法、化学法和生物酶法提取植物蛋白质。物理法有胶体磨法、均质法、高压法等,其提取率相对较低;化学法主要为碱溶酸沉法,生物酶法提取主要用纤维素酶、果胶酶、蛋白酶等,其工艺相对复杂[13]。碱溶酸沉法是目前提取植物蛋白质最普遍和最常用的方法,具有提取率高、成本低、便于操作的优点,适于工业化生产[14],而目前关于碱溶酸沉法提取青稞蛋白的工艺还未见报道。本研究采用碱溶酸沉法提取藏青85青稞蛋白,以蛋白质提取率为评价指标,在单因素实验基础上,采用二次正交旋转组合设计对青稞蛋白质的提取工艺进行优化,得到最佳提取工艺条件,为青稞蛋白质资源的研究开发提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
青稞样品为藏青85:由西藏农牧科学院农业研究所提供;氢氧化钠、盐酸、浓硫酸、硼酸、五水硫酸铜、硫酸钾、甲基红、溴甲酚绿、无水乙醇等均为分析纯:四川西陇化工有限公司。
1.2 仪器与设备
KDC-40离心机:科大创新股份有限公司中佳分公司;SHA-C水浴恒温振荡器:常州国华电器有限公司;HR-200电子分子天平:东生兴业有限公司;101-1AB型电热鼓风干燥箱:天津市泰斯特仪器有限公司;PB-10 pH计:赛多利斯科学仪器有限公司;Foss凯氏定氮仪:瑞典富斯-特卡脱公司。
1.3 方法
1.3.1 青稞蛋白质提取工艺
青稞→粉碎→过筛(60目)→加水搅匀→调节pH→恒温水浴振荡→3 500 r/min离心10min→收集上清液→调节pH至等电点→4 000 r/min离心20min→去上清液→60℃干燥15 h→青稞蛋白质粉。
1.3.2 青稞蛋白质等电点的测定
参考李凤英等(2005)方法[15],并加以改进。青稞全粉按料液比1∶20加入蒸馏水,搅匀后调pH至10,在50℃条件下水浴震荡1h,取出3500 r/min离心10min,收集上清液并将其均分为10份,每份40mL,分别调pH至2.0、3.0、4.0、4.2、4.4、4.5、4.6、4.8、5.0、6.0、7.0,沉淀凝沉后4 000 r/min离心15min,收集上清液,测定上清液中蛋白质含量m及未调节等电点的上清液蛋白质含量M,求其沉淀率:

以蛋白质沉淀率作为指标,其沉淀率最大值的pH为等电点。
1.3.3 青稞蛋白质提取工艺单因素试验
1.3.3.1 料液比对青稞蛋白质提取率的影响
青稞全粉分别按料液比1∶5、1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)加入蒸馏水,在pH10,提取温度50℃,提取时间60min条件下进行蛋白质提取,测定蛋白质提取率。
1.3.3.2 pH对青稞蛋白质提取率的影响
青稞全粉按料液比1:20加入蒸馏水,在pH分别为8、9、10、11、12,提取温度50℃,提取时间60min条件下进行蛋白质提取,测定蛋白质提取率。
1.3.3.3 提取温度对青稞蛋白质提取率的影响
青稞全粉按料液比1∶20加入蒸馏水,在pH10,提取温度分别为30、40、50、60、70℃,提取时间60min条件下进行蛋白质提取,测定蛋白质提取率。
1.3.3.4 提取时间对青稞蛋白质提取率的影响
青稞全粉按料液比1∶20加入蒸馏水,在pH10,提取温度50℃,提取时间分别为20、40、60、80、100、120min条件下进行蛋白质提取,测定蛋白质提取率。
1.3.4 二次正交旋转试验设计
在单因素试验基础上,选择料液比、pH、提取温度、提取时间的实验水平,以青稞蛋白质提取率为考察指标,设计4因素二次正交旋转试验,优化青稞蛋白质提取工艺的最佳参数,其因素水平表见表1。

表1 二次正交旋转试验因素水平表Table 1 Factorsand levelsoforthogonal rotation combination design
1.3.5 蛋白质含量的测定
蛋白含量的测定参照GB/T5511-2008《谷物和豆类氮含量测定和粗蛋白质含量计算凯氏法》,采用凯氏定氮法进行,氮含量换算蛋白质含量的换算系数:5.83。
1.3.6 蛋白质提取率计算
蛋白质提取率/%=提取蛋白质量/青稞全粉蛋白含量×青稞全粉质量×100%
1.4 数据分析处理
以上各实验均重复进行3次,并采用DPS 7.05和MicrosoftExcel2003进行试验设计及数据处理。
2 结果与分析
2.1 青稞蛋白质等电点分析
青稞蛋白质等电点分析见图1。
由图1可知,pH在2~7的范围内,青稞蛋白质沉淀率呈先增大后减小趋势,在pH为4.5时,蛋白质沉淀率达到最大,为80.87%,且随着pH接近中性,沉淀率降低、溶解率增大,在pH为7时,溶解率达到94.23%。由此可知,青稞全粉蛋白质等电点(pI)为4.5。

图1 青稞蛋白质沉淀率随pH的变化Fig.1 Changesofp rotein p recipitation ratew ith pH in highland barley
2.2 影响青稞蛋白质提取的因素
2.2.1 料液比
料液比对青稞蛋白质提取率影响见图2。

图2 料液比对青稞蛋白质提取率的影响Fig.2 Effectsof solid-to-liqu id on theextraction rateof protein in highland barley
由图2可知,料液比在1∶5~1∶20的范围内,青稞蛋白质提取率随着料液比的增加显著增大(p<0.05),料液比继续增加,青稞蛋白质提取率无显著性差异。这主要是因为蛋白质的提取过程中,若提取液用量太少,溶液的黏度较大,分子扩散速率较低,体系分散不均匀,导致体系pH不均匀,影响了提取液中的蛋白质的溶出,提取率偏低;若提取液用量过多,增加在酸沉阶段上清液的体积及蛋白质的损耗,使蛋白质提取率无显著性差异,并会造成原料浪费[16]。因此,本试验确定青稞蛋白质提取适宜料液比为1∶20。
2.2.2 pH
pH对青稞蛋白质提取率影响见图3。

图3 pH对青稞蛋白质提取率的影响Fig.3 Effectsof pH on theextraction rateofprotein in highland barley
由图3可知,随着pH的增大,青稞蛋白质提取率呈显著上升趋势,pH的增大有利于蛋白质提取率的提高。大多数植物蛋白质是酸性蛋白质,蛋白质分子中Asp和Glu残基总和大于Lys、Arg和His残基总和,在碱性条件下带负电荷,蛋白质分子间相互排斥,使溶液分散性、溶解性较好,提高了蛋白提取率。此外,碱液对蛋白质分子的次级键有破坏作用,使蛋白质分子表面具有相同电荷,也起到了增溶的作用。但pH过高,破坏蛋白质的生物活性,使其变性,并加速美拉德反应,产生大量褐色物质,降低了蛋白质的纯度[17]。pH太大可引起脱氨、脱羧、肽键断裂,引起胱赖反应,对青稞蛋白质的理化特性造成不良影响[18]。青稞蛋白质提取的适宜pH为11。
2.2.3 提取温度
提取温度对青稞蛋白质提取率影响见图4。

图4 提取温度对青稞蛋白质提取率的影响Fig.4 Effectsofextraction time on theextraction rateofprotein in high land barley
由图4可知,青稞蛋白质提取率随着提取温度的升高呈增长趋势,当提取温度为60℃时,提取率最大,为39.06%,继续升高温度后提取率随着提取温度的升高而下降,蛋白质提取率在50℃~70℃间无显著性差异(p≥0.05)。这主要是因为温度升高,分子运动速度加快,蛋白质分子的构象发生变化,立体结构的伸展对蛋白质有一定的增溶效果,使蛋白质较容易从原料中溶解出来。青稞蛋白质提取率从60℃后开始下降,这是因为水分子的热运动加剧使得蛋白质结构展开,维持蛋白质空间构象的次级键被破坏,非极性基团的暴露,导致蛋白质分子间发生聚集和沉淀,造成溶解度的降低[19]。且随着温度增加,溶液黏度增加,加大分离难度。提取温度50℃较为适宜青稞蛋白质提取。
2.2.4 提取时间
提取时间对青稞蛋白质提取率影响见图5。

图5 提取时间对青稞蛋白质提取率的影响Fig.5 Effectsof extraction temperatureon theextraction rate of protein in highland barley
由图5可知,青稞蛋白提取率随着提取时间的增加呈先增大后降低趋势,当提取时间为40min时,蛋白质提取率达到最大,为41.07%。这主要是因为青稞中含有一定量的戊聚糖,延长反应时间,会造成离心时少量蛋白质与戊聚糖类物质的粘连,导致青稞蛋白质提取率呈现下降趋势[20]。因此,青稞蛋白质提取适宜时间为40min。
2.3 青稞蛋白提取工艺条件优化
2.3.1 二次正交旋转组合设计及实验结果
根据单因素试验结果,以青稞蛋白质提取率为考察目标,设计四因素的二次正交旋转试验。确定料液比(X1)、pH(X2)、提取温度(X3)、提取时间(X4)的零水平分别为1∶20、10、50℃、40min,试验设计及结果见表1、2。

表2 二次正交旋转组合设计试验方案及结果Table2 Orthogonal rotation combination design scheme and resu lts
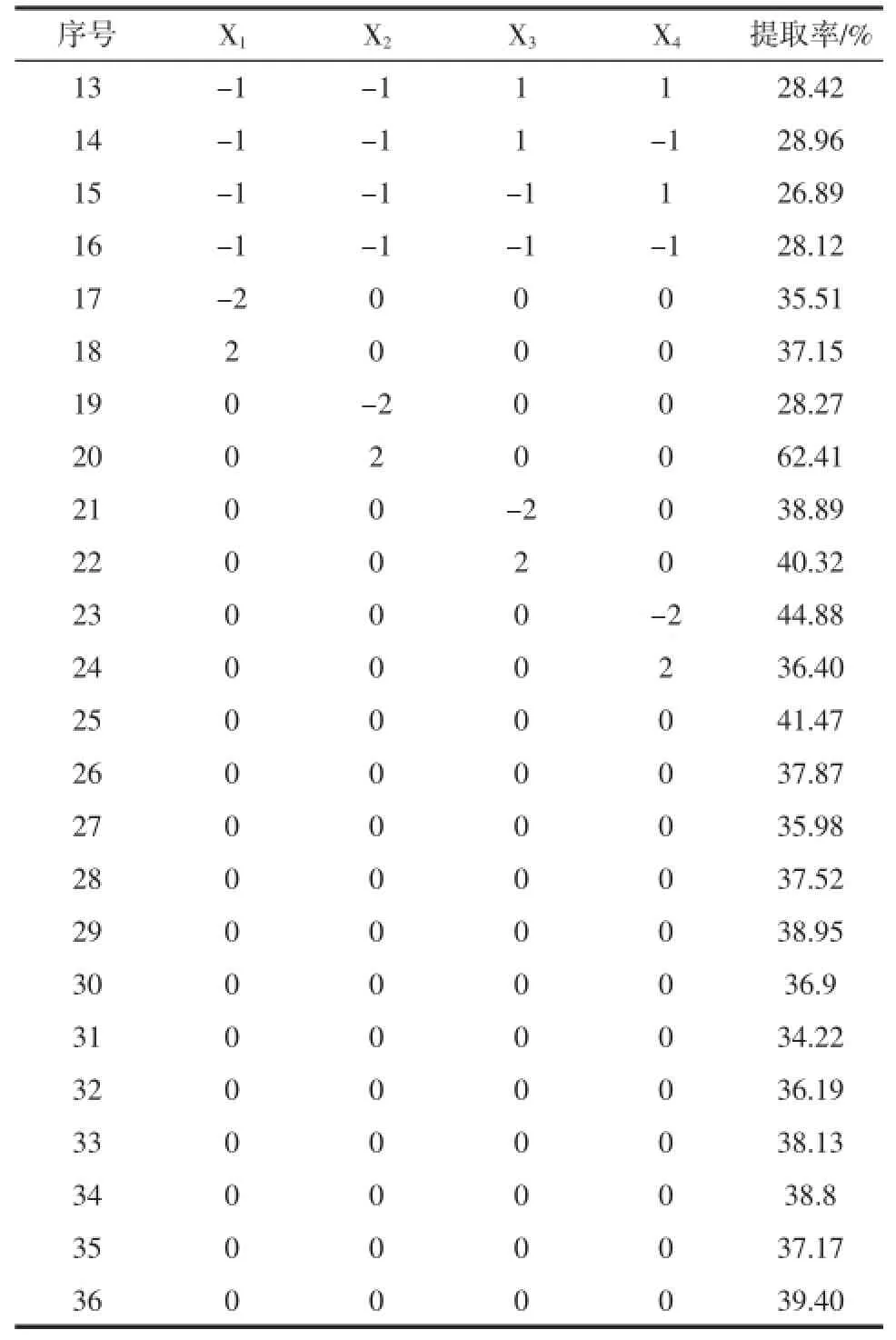
续表2 二次正交旋转组合设计试验方案及结果Continue tab le2 O rthogonal rotation com bination design schem e and results
2.3.2 回归模型的建立与检验
采用DPS 7.05数据处理系统对表2中的结果进行二次多项式回归分析,得到青稞蛋白质提取率(Y)和料液比(X1)、pH(X2)、提取温度(X3)、提取时间(X4)之间的回归模型:Y=37.716 7+1.347 1X1+10.162 1X2+ 0.451 3X3-0.811 3X4-0.354 9X12+1.897 6X22+0.463 9X32+ 0.722 6X42+0.459 4X1X2+0.116 9X1X3+0.106 9X1X4-0.245 6X2X3-0.525 6X2X4-0.208 1X3X4
由表3可知,回归方程失拟项不显著(F1=2.106 5,p=0.1188),即回归方程对试验点拟合效果较好,回归方程达到极显著水平(F2=36.130 3,p<0.000 1),即模型成立,可用于描述青稞蛋白质提取率随液料比、pH、提取时间、提取温度变化的规律。
在α=0.1的显著水平上,剔除不显著项,简化后的回归方程为:
Y=37.716 7+1.347 1X1+10.162 1X2-0.811 3X4+ 1.897 6X22+0.722 6X42
由表3可以看出,一次项X1、X2、X4对青稞蛋白质提取率有显著或极显著影响,二次项X22、X42对青稞蛋白质提取率有显著或极显著影响,其余一次项、二次项以及交互项影响均不显著。由一次项显著性检验可以看出,四个因素对青稞蛋白质提取率影响大小为X2>X1>X4>X3,表明对青稞蛋白质提取率的影响因素依次为pH、液料比、提取时间、提取温度。

表3 试验结果方差分析表Table3 Varianceanalysisof theexperim ental results of orthogonal rotation combination design
2.3.3 青稞蛋白质提取工艺参数的优化与验证
通过模型分析,优化工艺参数为料液比1∶25,pH 11,提取温度40℃,提取时间20min,在此条件下蛋白质得率72.48%。3次平行验证实验的实测值为70.71%,与预测值差1.77%,验证结果显示方程预测性较好,模型是可靠的。
3 结论
1)通过青稞蛋白质等电点测定试验,以蛋白质沉淀率作为指标,确定青稞蛋白质的等电点为pI4.5。
2)采用碱溶酸沉法提取青稞蛋白质,结果表明,液料比和pH对青稞蛋白质提取率影响极显著,提取时间对其提取率影响显著,提取温度对其提取率影响不显著,影响青稞蛋白质提取率的因素依次为pH、液料比、提取时间、提取温度。
3)在单因素实验的基础上,采用二次正交旋转组合设计实验方法对青稞蛋白质提取工艺进行优化。确定适宜青稞蛋白质提取工艺条件:料液比1∶25(g/mL),pH 11,提取温度40℃,提取时间20min,在此条件下青稞蛋白质提取率为70.71%。
[1]侯志强.青稞麦谷蛋白特异性分析及其基因克隆[D].西宁:青海大学,2012
[2]LIANG Junjun,DENGGuangbing,LONGHai,etal.Virus-induced silencing of genes encoding LEA protein in Tibetan hulless barley (Hordeum vulgaressp.vulgare)and their relationship to drought tolerance[J].Mol Breeding,2012,30(1):441-451
[3]邹弈星.青藏高原青稞淀粉资源的评价[D].中国科学院成都生物研究所,2008
[4] Damiran D,YU Peiqiang.Metabolic characteristics in ruminants of the proteins in newly developed hull-less barley varietieswith altered starch traits[J].JournalofCerealScience,2012,55(3):351-360
[5]王金水,李涛,焦健.水酶法提取青稞蛋白工艺研究[J].食品工业科技,2010,31(9):267-269
[6] EshghiR,Akhundova E.Inheritance pattern ofβ-glucan and protein contents in hulless barley[J].Int JAgric Biol,2010,12(1):68-72
[7] Inge Celus,Kristof Brijs,Jan A.Delcour.The effects ofmalting and mashingon barley protein extractability[J].JournalofCerealScience,2006,44(2):203-211
[8]减靖巍.青棵淀粉和蛋白质的化学组成及其工艺性质研究[D].重庆:西南农业大学,2005
[9]Helm CV,Francisco A D,Gaziola SA,etal.Hull-less Barley Varieties:Storage Proteins and Amino Acid Distribution in Relation to NutritionalQuality[J].Food Biotechnology,2005,18(3):327-341
[10]杨希娟,党斌,吴昆仑,等.青稞蛋白的超声波辅助提取工艺及其功能特性研究[J].中国食品学报,2013,13(6):48-56
[11]Appel L J.The effects of protein intake on blood pressure and cardiovasculardisease[J].CurrentOpinion Lipidology,2003,14(1):55-59
[12]AludattM H,Rababah T,Ereifej K,etal.Effects ofbarley flour and barley protein isolate on chemical,functional,nutritional and biological properties of Pita bread[J].Food Hydrocolloids,2012,26(1): 135-143
[13]邹秀容,朱建华,曹思铭.超声波法提取米糠蛋白的研究[J].食品工业科技,2013,34(16):280-282
[14]陈凤莲.碱液浸提法分离小麦麸皮中蛋白质的研究[J].哈尔滨商业大学学报,2010,26(3):274-277
[15]李凤英,崔蕊静,李春华.葡萄籽蛋白质的提取工艺研究[J].中国油脂,2005,30(4):50-52
[16]赵晨霞,祝海娟,张翌楠.正交试验优化大麦虫蛋白质提取工艺[J].食品科学,2013,34(16):42-45
[17]毛银,王彬,朱科学,等.碱法提取茶渣蛋白工艺研究[J].食品研究与开发,2013,34(14):36-38
[18]孔涛,米平,赵雪淞,等.碱法提取花生粕蛋白质工艺条件的优化[J].江苏农业科学,2013,41(7):277-279
[19]崔淼,凌孟硕,孙明奎,等.碱酶两步法提取沙棘籽蛋白的工艺研究[J].中国油脂,2012,37(9):31-35
[20]李涛.青稞蛋白质的提取及其特性研究[D].郑州:河南工业大学, 2010
Research on Technology for Extraction of High land Bar ley Protein by Alkaline Extraction and Acid Precipitation M ethod
WUGui-ling,LIU Li-pin,LIWen-hao,ZHANGWei,LIU Xiao-xue,ZHANGGuo-quan*
(CollegeofFood Scienceand Engineering,NorthwestA&FUniversity,Yangling712100,Shannxi,China)
The quadratic orthogonal rotation combination design method was applied to optimize the extraction parametersofalkaliextraction and acid precipitationmethod for isolation ofhighland barley (cv.Zangqing 85)protein.Influencesof solid-to-liquid ratio,pH,extraction temperature and time on the protein extraction rate were studied respectively.The importance sequence of influence factors impacting protein extraction rate were pH,liquid ratio,extraction time and extraction temperature,successively.The optimum parametersof solidto-liquid ratio,pH value,extraction temperature and time for protein extraction were:1∶25,11,40℃and 20 min,respectively.Under thisoptimal condition,the protein extraction rate reached to 70.71%.
highland barley;protein;alkaliextraction and acid precipitation;extraction rate;quadratic orthogonal rotation combination design
10.3969/j.issn.1005-6521.2015.05.006
2013-12-24
国家大麦青稞产业技术体系青稞加工试验站(CARS-05-05B)
吴桂玲(1988—),女(满),硕士研究生,研究方向:粮食油脂及植物蛋白工程。
*通信作者:张国权(1968—),男(汉),教授,博士,研究方向:谷物品质评价及淀粉工程技术。
