桑白皮甾醇的萃取和纯化工艺研究
2015-12-27徐艳阳蔡森森张凡李越山
徐艳阳,蔡森森,张凡,李越山
(吉林大学生物与农业工程学院,吉林长春130022)
桑白皮甾醇的萃取和纯化工艺研究
徐艳阳,蔡森森,张凡,李越山
(吉林大学生物与农业工程学院,吉林长春130022)
为优化桑白皮甾醇的提取工艺,分别考查萃取溶剂种类、乙醇粗提液与蒸馏水体积比、萃取时间、乙醇粗提液与萃取溶剂体积比对桑白皮甾醇得率的影响;采用二因素三水平正交试验优化萃取工艺,结果表明最佳萃取工艺条件为:乙醇粗提液与氯仿体积比1∶1、乙醇粗提液与蒸馏水体积比1∶1,此时桑白皮甾醇得率为(5.63±0.28)mg/g。通过对不同类型大孔吸附树脂的比较,获得D-900大孔吸附树脂为较佳类型。氯仿萃取液采用D-900大孔吸附树脂进行柱层析两次,桑白皮甾醇纯度可达(50.48±1.39)%。对纯化后样品采用薄层色谱法进行定性分析,纯化样品和β-谷甾醇标准品在同一位置有紫红色斑点析出。应用气相色谱-质谱联用技术鉴定,桑白皮纯化样品含有羊毛甾醇、谷甾醇、β-香树脂醇和α-香树脂醇。
桑白皮;植物甾醇;提取;树脂;柱色谱;薄层色谱
matography
植物甾醇是以甾核即环戊烷多氢菲为骨架、结构上类似于胆固醇,来源于植物的甾体化合物,具有降低血胆固醇浓度、抑制肿瘤、抑制乳腺增生、防治前列腺肥大、调节免疫等生理功能[1]。国际生命科学学会把由植物甾醇和甾烷醇构成的保健食品推荐为十大功能性食品之一。而且植物甾醇作为功能食品,已被美国食品药品管理局(FDA)、欧盟食品科学委员会(SCF)等官方机构认可和推荐,主要以胶囊、咀嚼片、片剂等形式在国外市场上流通,不仅把它添加在高脂产品中,也向低脂食品中发展。国内金龙鱼粮油知名企业于2009年率先将植物甾醇玉米油在中国市场推广。2011年国际Wilmar&BASF营养与健康联合研究院在上海建立,主要致力于植物甾醇的试验研究与开发应用。因此,对植物甾醇的研究开发具有广阔的市场前景。
桑白皮(CortexMori)为桑科桑属植物白桑(Morus alba L.)的干燥根皮,是我国卫生部于2002年公布的可用于保健食品的中药之一[2]。全世界共有12种桑科桑属植物,其中中国有9种,在全国各地均有栽培,主要分布于新疆、四川、河北、山东、东北三省、云南和广东等地。目前国内外学者对桑白皮的研究主要集中在多糖、黄酮类化合物、多糖、生物碱等的提取及抗氧化性、降糖、平喘和治疗肺疾病等方面[3-8]。对桑白皮甾醇的研究报道很少,仅有Piao Shu-juan[9]、胡叶梅[10]等学者应用气相色谱法对桑白皮甾醇的含量进行了研究。因此,本文对桑白皮甾醇的萃取工艺进行研究,应用大孔树脂柱层析对萃取液进行分离纯化,为桑白皮甾醇的应用开发提供科学依据。
1 材料与方法
1.1 材料与试剂
桑白皮购于长春市同仁堂药店;β-谷甾醇标准品(GC>95%)阿拉丁试剂(中国)有限公司;大孔吸附树脂购于沧州宝恩吸附材料科技有限公司。
1.2 主要仪器与设备
AL104型电子分析天平:梅特勒-托利多仪器有限公司;CY-100微量进样器:北京青云卓立精密设备有限公司;T22N紫外可见分光光度计:上海精密科学仪器有限公司;SHA-C水浴恒温振荡器:金坛市恒丰仪器厂;LD4-2A型低速离心机:北京市雷勃尔离心机有限公司;PH070A干燥箱:上海一恒科学仪器有限公司;层析柱:长春市华泰玻璃仪器公司;5975-6890N气相色谱-质谱联用仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 桑白皮甾醇萃取-柱层析纯化工艺流程
桑白皮乙醇粗提液[11]→离心→取上清液加入蒸馏水和溶剂萃取→摇匀、静置分层→水洗至中性→用无水硫酸钠干燥→浓缩、回收溶剂→得到油膏状物质(甾醇粗制品)→配制2mg/mL桑白皮甾醇氯仿萃取液→过柱(大孔吸附树脂)2次→浓缩、回收溶剂→桑白皮甾醇纯化样品
1.3.2 试验指标与方法
1.3.2.1 硫磷铁法测定桑白皮甾醇得率
参照文献[11]硫磷铁法测定,桑白皮甾醇得率的计算公式如下:

式中:y1为桑白皮甾醇得率,(mg/g);c1为萃取液吸光度值对应β-谷甾醇标准溶液质量浓度,(mg/mL);v1为萃取液体积,mL;b为稀释倍数;m1为桑白皮质量,g。
1.3.2.2 桑白皮甾醇含量计算
桑白皮甾醇含量的计算公式如下:

式中:yc为桑白皮甾醇纯度,%;c2为纯化后甾醇溶液的质量浓度,(mg/mL);v2为溶液体积,mL;b为稀释倍数;m2为纯化后桑白皮甾醇的质量,g。
1.3.2.3 薄层色谱法定性分析
参照文献[12]进行检测,样品比移植的计算公式如下:

式中:Rf为比移值,%;D1为原点与斑点中心的距离,cm;D2为原点与展开剂前沿的距离,cm。
1.3.2.4 气相色谱-质谱(GC-MS)测定
气相色谱条件:采用Agilent5975-6890N气质联用仪,色谱柱为AgilentHP-5毛细管柱(30m×250μm,0.25μm),进样量1.0μL,进样温度为280℃,分流比为30∶1,载气为氦气,流速为1.1mL/min。
质谱条件:离子源为EI,电子能量为70 eV,离子源温度为230℃,传输线温度为280℃,质量范围20 amu~700 amu,全扫描方式。
1.3.3 桑白皮甾醇萃取试验
1.3.3.1 萃取工艺的单因素试验
选择萃取溶剂种类、乙醇粗提液与蒸馏水体积比、萃取时间、乙醇粗提液与萃取溶剂体积比作为试验的单因素。量取25m L桑白皮乙醇粗提液,依次加入一定量的蒸馏水、萃取溶剂,振荡摇匀,静置分层后取萃取溶剂层,用蒸馏水水洗至中性,采用无水硫酸钠干燥,然后蒸馏浓缩、回收溶剂,并采用硫磷铁法测定甾醇得率。各个因素的水平分别为:萃取溶剂氯仿、乙醚、石油醚、正己烷;乙醇粗提液与蒸馏水体积比1∶0.4、1∶0.6、1∶0.8、1∶1、1∶1.2;萃取时间5、10、15、20、25、30min;乙醇粗提液与萃取溶剂体积比1∶0.4、1∶0.6、1∶0.8、1∶1、1∶1.2、1∶1.4。在进行单因素试验时,其他固定条件分别为萃取溶剂为氯仿、乙醇粗提液与蒸馏水体积比1∶1、萃取时间5min、乙醇粗提液与溶剂体积比1∶1。
1.3.3.2 萃取工艺优化试验
选择乙醇粗提液与氯仿体积比、乙醇粗提液与蒸馏水体积比为考查因素,以甾醇得率为试验指标,在L9(34)正交表上安排优化试验。试验因素水平表见表1。

表1 试验因素水平表Table1 Levelsof experim ental factors
1.3.4 桑白皮甾醇柱层析纯化工艺试验
1.3.4.1 大孔吸附树脂的选择
采用D-900、NKA-9、AB-8、D101、S-8大孔吸附树脂对桑白皮甾醇萃取液进行纯化;然后分别在紫外光区扫描各样液,与β-谷甾醇标准溶液进行对比分析;选择纯化效果较优的大孔吸附树脂,以不同的树脂质量进行干法装柱,比较脱色效果的优劣。
1.3.4.2 纯化试验
以D-900大孔吸附树脂进行分离纯化,重复过柱两次,测定桑白皮甾醇含量。
1.4 数据分析
每次试验重复3次,应用SPSSV17.0对数据进行方差分析(Analysisof Variance,ANOVA),组间比较采用LSD法(Least-significant difference)和S-N-K法(Student-Newman-Keuls),p<0.05表示存在显著性差异。
2 结果与讨论
2.1 萃取工艺单因素试验及分析
2.1.1 萃取溶剂种类对甾醇得率的影响
在250mL带塞锥形瓶中依次加入25mL桑白皮乙醇粗提液、25mL蒸馏水和25mL萃取溶剂(乙醚、石油醚、正己烷、氯仿),摇匀、萃取5min,结果见图1(p<0.01)。

图1 萃取溶剂种类对甾醇得率的影响Fig.1 Effectsof typeof extraction solventon phytosterol extraction rate
在试验过程中发现,石油醚萃取部分经蒸馏后为灰白色物质,该物质不溶于无水乙醇,无法进行硫磷铁法检测甾醇含量。其他三种溶剂经蒸馏后得到黄色油膏状物质,颜色由深至浅依次为氯仿、正己烷、乙醚。但乙醚萃取部分随水洗次数的增加,体积锐减,故不选择乙醚作为萃取溶剂。由图1可知,与正己烷相比,使用氯仿进行萃取,甾醇得率提高了46.92%,因此选择氯仿。
2.1.2 乙醇粗提液与蒸馏水体积比对甾醇得率的影响
在250mL带塞锥形瓶中加入25mL桑白皮乙醇粗提液,按照乙醇粗提液与蒸馏水体积比1∶0.4、1∶0.6、1∶0.8、1∶1、1∶1.2分别加入10、15、20、25、30mL蒸馏水,再加入25mL氯仿,摇匀、萃取5min,试验结果见图2(p<0.01)。

图2 乙醇粗提液与蒸馏水体积比对甾醇得率的影响Fig.2 Effects of volume ratio ofethanolcrudeextract to distilled water on phytosterolextraction rate
由图2可知,乙醇粗提液与蒸馏水体积比在1∶0.4~1∶0.8范围内甾醇得率缓慢增加,在1∶0.8~1∶1.2范围内甾醇得率增加地较快。因此,乙醇粗提液与蒸馏水体积比选择1∶1~1∶1.2。
2.1.3 萃取时间对甾醇得率的影响
在250mL带塞锥形瓶中依次加入25mL桑白皮乙醇粗提液、25mL蒸馏水和25mL氯仿,摇匀,分别萃取5、8、10、15、20min,试验结果见图3(p>0.05)。

图3 萃取时间对甾醇得率的影响Fig.3 Effectsof extraction tim eon phytosterolextraction rate
由图3可知,根据ANOVA,p>0.05表明萃取时间在5min~20min范围内对甾醇得率的影响没有显著性差异。因此,萃取时间选择5min。
2.1.4 乙醇粗提液与氯仿体积比对甾醇得率的影响
在250mL带塞锥形瓶中依次加入25mL桑白皮乙醇粗提液和25mL蒸馏水,按照乙醇粗提液与氯仿体积比1∶0.4、1∶0.6、1∶0.8、1∶1、1∶1.2、1∶1.4分别加入10、15、20、25、30、35mL氯仿,摇匀、萃取5min,试验结果见图4(p<0.01)。
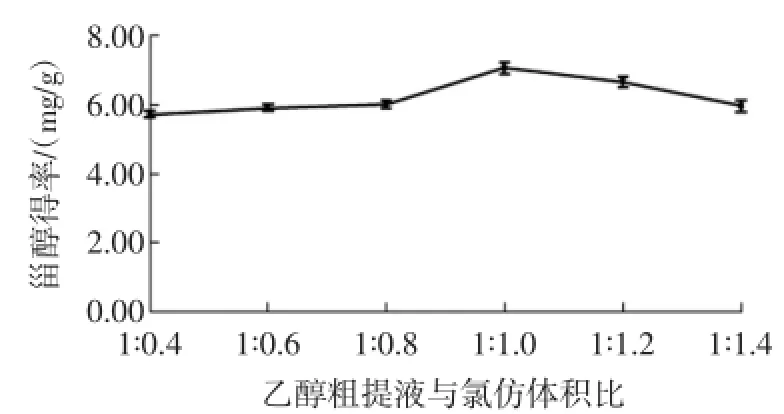
图4 乙醇粗提液与氯仿体积比对甾醇得率的影响Fig.4 Effectsofvolume ratio ofethanolcrudeextract to chloroform on phytosterolextraction rate
由图4可知,乙醇粗提液与氯仿体积比在1∶0.4~1∶1范围内甾醇得率逐渐增加,在1∶1~1∶1.4范围内甾醇得率逐渐减少。这是由于分液漏斗容积有限,下方氯仿层无法充分萃取上层乙醇粗提液中的甾醇,导致甾醇得率下降。因此,乙醇粗提液与氯仿体积比选择1∶1。
2.2 萃取工艺优化试验
根据单因素试验结果,选择乙醇粗提液与氯仿体积比(A)、乙醇粗提液与蒸馏水体积比(B)为考查因素,以甾醇得率为试验指标,在L9(34)正交表上安排优化试验。试验方案及结果见表2~表3。

表2 L9(34)正交试验方案及结果Table2 Resultsof L9(34)or thogonalexperiments

表3 方差分析结果Table3 Resultsof ANOVA
由表2可知,根据极差分析,乙醇粗提液与氯仿体积比的优水平为1∶1,乙醇粗提液与蒸馏水体积比的优水平为1∶1.2;根据RA>RB表明影响甾醇得率的主次顺序为乙醇粗提液与氯仿体积比、乙醇粗提液与蒸馏水体积比。与蒸馏水体积比的优水平1∶1.2相比,当加入蒸馏水体积比1∶1时,其yB2(5.23)与yB1(5.28)的值相差无几,综合考虑甾醇得率及节约蒸馏水用量,乙醇粗提液与蒸馏水体积比的优水平选择1∶1。
由表3可知,乙醇粗提液与氯仿体积比对甾醇得率有极显著的影响,乙醇粗提液与蒸馏水体积比则有显著的影响;这与表2分析结果一致。因此桑白皮甾醇萃取试验的最优工艺参数为:乙醇粗提液与氯仿体积比为1∶1、乙醇粗提液与蒸馏水体积比为1∶1。对优组合的甾醇得率进行区间估计。计算点估计值yˆ优= 5.12+0.58+0.12=5.82,误差限εα=0.39。因此,优组合的甾醇得率真值在5.43mg/g~6.21mg/g,此时的置信度为95%。在上述优组合条件下进行3次验证试验,测得甾醇得率为(5.63±0.28)mg/g,在2.2.1 ANOVA得出的置信区间5.43mg/g~6.21mg/g,表明采用L9(34)正交试验优化的工艺参数是可靠的。
2.3 柱层析纯化试验及其结果分析
2.3.1 大孔吸附树脂的确定
5种大孔吸附树脂分别采用干法装柱,树脂质量为5.0 g;将配制好的2mg/mL甾醇萃取液从柱顶加入,流速为0.5mL/min;洗脱液为4∶1氯仿:乙醇(体积比),洗脱速度为5mL/min。试验结果见表4,各样液的紫外扫描图见图5~图6。
由表4可知,d样液的纯度最高,为48.71%。由图5可知,β-谷甾醇标准溶液的最大吸收峰为244 nm,这与赵文竹等[13]学者的结果(243 nm)接近。由图6可知,b、c、d、e、f和g样液的最大吸收峰依次为:251、244、245、244、244、242 nm,其最大吸收峰与β-谷甾醇标准溶液的相近。根据样液的甾醇纯度及最大吸收峰位置,选择D-900大孔吸附树脂进行下一步的纯化试验。
由图7可知,与a样液相比,d、h和k样液在可见光区400 nm~600 nm范围内吸光度值明显下降,即脱色效果明显。在波长244 nm处,k样液(1.646)的吸光度值比a样液(1.704)低3.40%,比d样液(1.686)低2.37%,比h样液(1.656)低0.60%,而其余波长处的吸光度值均低于a、d和h样液,表明杂质去除效果较优。因此选择10.0 g D-900大孔吸附树脂、以流速0.25mL/min进行柱层析分离。

表4 经不同树脂处理后产品的纯度Table 4 Thepurity of sam ples treated by different resins

图5 β-谷甾醇标准溶液(氯仿溶剂)的紫外扫描图Fig.5 UV scanning graphsofstandard solution ofβ-sitosterol(chloroform as solvent)

图6 经不同大孔吸附树脂处理样液的紫外扫描图Fig.6 UV scanning graphsofsolutionsafter treated by different m acroporousadsorption resins

图7 经D-900大孔吸附树脂处理样液的紫外扫描图Fig.7 UV scanning graphsofsolutionsafter treated by D-900 macroporous adsorption resins
2.3.2 D-900大孔吸附树脂分离效果
桑白皮甾醇萃取液采用D-900大孔吸附树脂进行分离纯化两次,甾醇含量达(50.48±1.39)%。
桑白皮甾醇溶液与β-谷甾醇标准溶液的薄层色谱图见图8。

图8 β-谷甾醇标准溶液与桑白皮甾醇溶液的薄层色谱图Fig.8 Thin layer chromatogram sof purified extractandβsitosterolstandard solution
由图8可知,β-谷甾醇标准品Rf=(48.73±1.66)%,桑白皮甾醇Rf=(48.17±2.79)%,即纯化样品与β-谷甾醇标准品在同一位置有紫红色斑点析出,表明纯化样品中含有桑白皮甾醇。桑白皮纯化样品的GC-MS总离子流见图9。
根据质谱库检索,并由文献[14]中的甾醇类化合物可知,纯化样品中甾醇类化合物有羊毛甾醇、谷甾醇、β-香树脂醇和α-香树脂醇,它们的匹配因子(MF,最大值为1 000)依次为769、894、875和895,保留时间依次为26.448、27.794、28.779、30.376min。
3 结论
1)通过桑白皮甾醇萃取工艺的单因素试验可知,与正己烷相比,氯仿萃取使桑白皮甾醇得率提高了46.92%;萃取时间在5min~20min内对甾醇得率的影响不显著。以乙醇粗提液与氯仿体积比、乙醇粗提液与蒸馏水体积比为考查因素,以桑白皮甾醇得率为试验指标,通过二因素三水平正交试验优化桑白皮甾醇萃取工艺。结果表明,乙醇粗提液与氯仿体积比为1∶1、乙醇粗提液与蒸馏水体积比为1∶1,此时桑白皮甾醇得率为(5.63±0.28)mg/g,在95%置信区间5.43mg/g~6.21mg/g范围内,实验测定值与理论预测值基本吻合。

图9 桑白皮纯化样品的GC-M S总离子流图Fig.9 Totalion chromatogram sofpurified extraction sam ple
2)对桑白皮甾醇萃取液采用D-900、NKA-9、AB-8、D101、S-8 5种大孔吸附树脂进行分离纯化,结果显示D-900大孔吸附树脂的纯化效果最好。对桑白皮甾醇萃取液采用10.0 g D-900大孔吸附树脂、以流速0.25mL/min进行分离纯化2次,桑白皮甾醇含量达(50.48±1.39)%。
3)采用薄层色谱法和气相色谱-质谱联用法对桑白皮甾醇纯化样品进行定性分析。结果显示,桑白皮甾醇乙醇溶液的比移值Rf为(48.17±2.79)%,β-谷甾醇标准品的Rf为(48.73±1.66)%,二者在薄层色谱薄板上同一位置有紫红色斑点析出,表明纯化样品中含有桑白皮甾醇。采用气相色谱-质谱联用法鉴定,桑白皮纯化样品含有羊毛甾醇、谷甾醇、β-香树脂醇和α-香树脂醇。
[1] 许世卫.中国2020年食物与营养发展目标战略分析[J].中国食品与营养,2011,17(9):5-13
[2]孙伟.101种植物提取物对两种植物病原菌生物活性的研究[D].北京:中国农业科学院,2011
[3] CHANG Lee-wen,JUANG Lih-jeng,WANG Bor-sen,et al. Antioxidantand antityrosinase activity ofmulberry(Morus alba L.) twigsand rootbark[J].Food and Chemical Toxicology,2011,49(4): 785-790
[4] DOMINIK K,JZEF K,MAGDALENA R,et al.β-Sitosterol and campesterol stabilisation by natural and synthetic antioxidants during heating[J].Food Chemistry,2011,128(4):937-942
[5]MA Song-Tao,ZHANG Xiao-Ke,WANG Qiu-Lin.Experimental study on the preventive and treat-ment function of cortexmori for peripheral ner-vous lesion at the early stage of diabetes rats[J]. Chinese journalofapplied physiology,2008,24(2):201-204
[6] KIM Hyun-Ji,LEE Hai-ja,JEONG Soo-Jin,et al.Cortex Mori Radicis extract exerts antiasth-matic effects via enhancement of CD4+CD25+Foxp3+regulatory T cells and inhibition of Th2 cytokinesinamouseasthmamodel[J].JournalofEthnopharmacology, 2011,138(1):40-46
[7]OROZCO-SOLANOM,RUIZ-JIMÉNEZ J,LUQUE de CASTROM. D.Ultrasound-assisted extraction and derivatization of sterols and fatty alcohols from olive leavesand drupes prior to determination by gas chromatography-tandemmass spectrometry[J].JournalofChromatography A,2010,1217(8):1227-1235
[8] CHANG Lee-wen,JUANG Lih-jeng,WANG Bor-sen,et al. Antioxidantand antityrosinase activity ofmulberry(Morusalba L.) twigsand rootbark[J].Food and Chemical Toxicology,2011,49(4): 785-790
[9] PIAO Shu-juan,CHEN Li-xia,KANG Ning,et al.Simultaneous Determination of Five Charact-eristic Stilbene Glycosides in Root Bark of Moru-s albus L.(Cortex Mori)Using High-Performance Liquid Chromatography[J].Phytochemical Analysis,2011,22(3): 230-235
[10]胡叶梅,韩军花,王素芳,等.中药降血脂类有效成分——植物甾醇的含量及分布研究[J].卫生研究,2011,40(3):388-390
[11]徐艳阳,蔡森森,宋艳翎,等.响应面法优化桑白皮甾醇微波辅助提取工艺参数[J].食品科学,2013,34(18):65-69
[12]李泉.多原料植物甾醇络合水解法提纯及合理配比初探[D].青岛:青岛大学,2007
[13]赵文竹,于志鹏,于一丁,等.均匀设计微波法提取玉米须中β-谷甾醇[J].食品研究与开发,2010,31(9):19-22
[14]杨春英,刘学铭,陈智毅,等.气相色谱-质谱联用法测定14种食用植物油中的植物甾醇[J].中国粮油学报,2013,28(2):123-127
Extraction and Purification Process of Plant Sterol from M ulberry Root Bark
XUYan-yang,CAISen-sen,ZHANGFan,LIYue-shan
(CollegeofBiologicaland Agricultural Engineering,Jilin University,Changchun 130022,Jilin,China)
In order to optimize extraction process of plant sterol from mulberry root bark,effects of type of extraction solvent,volume ratio of ethanol crude extract to distilled water,extraction time,volume ratio of ethanol crude extract to extraction solventon phytosterol extraction yield were investigated respectively.Then,optimization parameterswere discussed by two-factor three-level orthoganol testanalysis.Results showed that optimum extraction conditionswere as follows:volume ratio ofethanol crude extract to chloroform of 1∶1,and ethanol crude extract to distilled water of1∶1.Under these conditions,phytosterol extraction yield of(5.63± 0.28)mg/gwas obtained.By comparison of differentmacroporous adsorption resin on purification effects,D-900 type ofmacroporus resinwaschoosed aspurification columnmaterial.Extraction sampleused by chloroform solution,reached a sterol purity of(50.48±1.39)%,purifed by twice of column chromatography.Purified extraction samplewas qualititively analyzed by thin layer chromatography,Then purified extract and standard compound ofβ-sitosterolshowed a similarmaximum absorption peak at the same spots position on the thin layer chromatography plates.Lanosterol,sitosterol,β-amyrin andα-amyrin were identified in the purified exaction samplebyGasChromatography-Massspectrometry(GC-MS).
mulberry root bark;plant sterol;extraction;resin;column chromatography;thin layer chro
10.3969/j.issn.1005-6521.2015.05.008
2013-08-21
吉林大学基本科研业务费项目(450060487500);吉林大学本科教学改革研究项目(2013138);吉林省高等教育教学改革研究项目(2014138)
徐艳阳(1972—),女(汉),副教授,博士,研究方向:食品营养与安全。
