小鼠白细胞介素33真核表达质粒的构建及表达
2015-12-27朱俊丰桑力轩杨芳丽翟景波高植鹏邓芳博王大南吕昌龙
朱俊丰, 桑力轩, 杨芳丽, 李 岩, 翟景波, 高植鹏,邓芳博, 孙 逊, 王大南, 吕昌龙*
(1.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122;2.辽宁大学 生命科学院,辽宁 沈阳 110036)
小鼠白细胞介素33真核表达质粒的构建及表达
朱俊丰1,2, 桑力轩1, 杨芳丽1, 李 岩1, 翟景波1, 高植鹏1,邓芳博2, 孙 逊1, 王大南1, 吕昌龙1*
(1.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122;2.辽宁大学 生命科学院,辽宁 沈阳 110036)
克隆小鼠 IL-33基因构建其真核表达质粒,并转染COS-7细胞检测其表达。提取C57BL/6小鼠肺组织总RNA,经反转录聚合酶链式反应(RT-PCR)扩增小鼠 IL-33基因,酶切后插入pcDNATM3.1/myc-HisA构建其真核表达质粒pcDNA-3.1-IL-33,重组质粒转染COS-7细胞,RT-PCR和免疫印迹法(western blotting)检测目的基因表达。结果显示,pcDNA3.1-IL-33中插入的片段序列测定结果与小鼠IL-33cDNA序列一致,重组质粒转染COS-7细胞后检测到相应mRNA及蛋白表达。成功克隆了小鼠IL-33基因cDNA,并构建其真核表达质粒。
白细胞介素33;基因克隆;表达质粒构建;真核表达
白细胞介素-33(IL-33)是2005年发现的细胞因子,为IL-1类细胞因子超家族成员,广泛存在于多种组织细胞中,是炎症反应的重要调节因子之一[1-2]。目前认为IL-33具有双重生物学功能,即在正常状态下存在于细胞核中,作为转录抑制因子发挥作用[3];细胞损伤时释放到胞外成为一种免疫系统的危险信号,与受体ST2结合,作为细胞因子发挥免疫调节作用[4]。小鼠的IL-33 cDNA编码266个氨基酸, 其相应全长蛋白质的相对分子质量为30 kD[5]。有研究表明全长IL-33是参与机体活动的有效形式,剪切后的可溶性IL-33活性下降,主要在血清中出现,可能成为一种疾病标记物[6]。但是另有研究发现,全长 IL-33经过中性粒细胞弹性蛋白酶和蛋白酶G剪切能够产生生物活性10倍于全长 IL-33的片段[7]。综上所述,IL-33的活性形式依然存在争议。为了进一步研究IL-33活性,本文利用基因工程的方法在大肠埃希菌中高效表达出鼠IL-33成熟蛋白,并对免疫学活性进行了初步研究, 为深入研究IL-33的免疫学作用及其分子机制提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物、菌株与质粒 C57BL/6小鼠购自中国医科大学实验动物中心;大肠埃希菌E.coli-DH5、COS-7细胞、表达载体pcDNATM3.1/myc-HisA由本室保存。
1.1.2 试剂 RNAiso Plus、载体连接试剂盒、限制性核酸内切酶、PCR试剂、T4DNA连接酶购自TaKaRa公司,DNA凝胶回收试剂盒、质粒抽提试剂盒购自北京原平皓公司,Trizol、EasyScriptcDNA第一链合成试剂盒为全式金公司产品,lipofectamine 2000转染试剂购自Invitrogen公司,DMEM培养基、新生小牛血清、细胞裂解液、蛋白酶抑制剂购自汇百生物公司。抗Myc的单克隆抗体购自北京康为世纪生物科技有限公司。其他试剂为进口或国产分析纯。
1.2 方法
1.2.1 引物设计与合成 根据GenBank小鼠IL-33序列和pcDNA3.1/myc-HisA载体特性, 按照酶切位点对侧翼序列的要求设计引物并包含相应的酶切位点 (引物合成由南京金斯瑞生物科技有限公司完成)。IL-33上游引物: AGCAAGCTTGCCACCATGAGACCTAGAATGAAGTAT,含酶切位点HindⅢ;下游引物: AGCTCTAGAGATTTTCGAGA-
GCTTAAAC,含酶切位点XbaⅠ,不含终止密码子。上游引物中含有Kozak序列。同时,调整下游引物使IL-33能融合表达Myc和HisA标签。
1.2.2 RNA 的提取及RT-PCR 用RNAiso Plus提取C57BL/6小鼠肺组织总RNA,按全式金公司提供的cDNA第一链合成说明进行反应获得cDNA,随即进行聚合酶链反应(PCR)获得IL-33基因编码序列,反应条件: 95 ℃ 5 min,进入循环,94 ℃ 30 s,54 ℃30 s,72 ℃ 1 min,共30个循环,最后72 ℃延伸10 min。产物经1%溴化乙锭-琼脂糖凝胶电泳分离分析PCR产物,用DNA回收纯化试剂盒回收扩增的目的基因。
1.2.3 IL-33cDNA的克隆及测序 将上述回收片段经HindⅢ与XbaⅠ双酶切,插入上述酶酶切线性化的pcDNATM3.1/myc-HisA载体,连接后转化DH5α感受态菌,过夜培养后挑取白色单菌落,小量提取质粒 DNA 进行酶切鉴定, 命名为 pcDNA3.1-IL-33。送南京金斯瑞生物公司进行插入片段序列测定。
1.2.4 重组质粒的细胞转染与表达 对数生长期COS-7细胞培养于含血清及双抗的DMEM培养液中,于 37 ℃、5% CO2培养箱中培养,将3×105个细胞/孔接种于6孔板,每孔DMED培养基定容至3 mL,培养24 h后,采用lipofectamine2000转染试剂按试剂说明转染pcDNA3.1-IL-33与空载体,并设空白对照,10 h后弃去转染液,换新鲜培养基继续培养,转染后24 h分别收集实验孔及空载体对照孔、空白对照孔的细胞,提取细胞总RNA,RT-PCR检测细胞IL-33基因表达;于转染后不同时间用冰冷细胞裂解液裂解细胞,收集细胞裂解产物,Western blot法检测培养细胞IL-33表达,检测方法按试剂说明进行。
2 结果与分析
2.1 RT-PCR扩增小鼠IL-33基因
分离小鼠肺组织总RNA,进行1%琼脂糖凝胶电泳,紫外灯下可见3条清晰条带,分别为28S RNA、18S RNA和5S RNA(图1A), 28S RNA与18S RNA无弥散现象,说明RNA未被降解。总RNA经逆转录为cDNA后进行PCR反应, 将产物进行1%琼脂糖凝胶电泳可见一亮带,大小约801 bp,与IL-33基因片断预期大小相符(图1B)。
2.2 pcDNA3.1-IL-33真核表达质粒的构建
HindⅢ与XbaⅠ双酶切后的小鼠肺组织IL-33的PCR产物经过琼脂糖凝胶电泳回收,与上述酶酶切后的pcDNA3.1/myc-HisA进行定向连接,连接后转化DH5α感受态菌。抽提质粒,行HindⅢ与XbaⅠ双酶切鉴定,经10 g/L琼脂糖凝胶电泳结果与预期相符(图2)。南京金斯瑞生物科技有限公司DNA测序结果与IL-33cDNA序列一致。
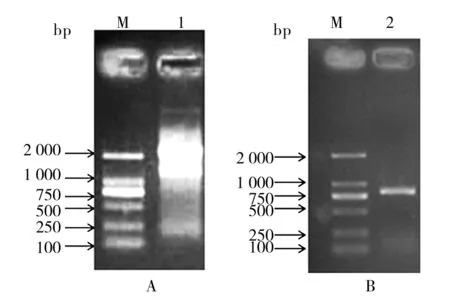
图1 小鼠IL-33基因扩增结果Fig.1 RT-PCR of IL-33A:Tranzol提取小鼠肺总RNA,M:DL2 000 DNA Marker;1:小鼠肺组织总RNA;2:小鼠肺组织IL-33PCR产物;B:RT-PCR扩增小鼠IL-33,M:DL2 000 DNA MarkerA:Total RNA was extracted from mouse lung using Tanszol. M:DL2 000 DNA Marker;1:Total RNA of mice lung; B:Amplify mouse IL-33 cDNA by RT-PCR. M:DL2 000 DNA Marker;2:PCR products of IL-33

图2 pcDNA3.1-IL-33真核表达质粒酶切鉴定结果Fig.2 Identification of recombinant plasmidpcDNA3.1-IL-33 byenzyme digestionM:DL2000 DNA Marker;1:pcDNA3.1-IL-33双酶切;2:pcDNA3.1-IL-33;M′:λ-HindⅢ digest DNA MarkerM:DL2000 DNA Marker;1:pcDNA3.1-IL-33digested with HindⅢand XbaⅠ;2:pcDNA3.1-IL-33;M′:λ-HindⅢ digest DNA Marker
2.3 重组质粒在COS-7细胞中的表达
分别收集空白对照、pcDNA3.1-IL-33与空载体转染的COS-7细胞,逆转录获得cDNA模板进行PCR扩增。结果表明, 从重组质粒转染的COS-7细胞中可扩增出IL-33基因, 而空质粒转染和未转染细胞中未扩增出目的条带(图3A),Western blot法证实pcDNA3.1-IL-33转染细胞48 h后的细胞裂解产物可检测到IL-33,而空载体转染细胞和未转染细胞未检测到其表达(图3B)。
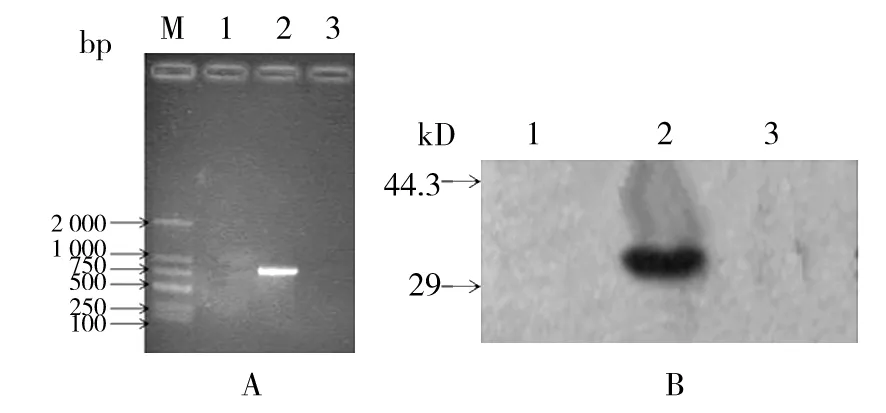
图3 重组质粒在COS-7细胞中的表达结果Fig.3 Western blot and RT-PCR analysis of IL-33 prokaryotic expressionA:RT-PCR检测重组质粒在COS-7细胞中的表达,M:DL2000 DNA Marker;1:空载体转染引物扩增;2:pcDNA3.1-IL-33转染引物扩增;3:空白对照引物扩增;B:Western blot检测重组质粒在COS-7细胞中的表达,1:未转染细胞;2:pcDNA3.1-IL-33转染细胞;3:空载体转染细胞A: RT-PCR analysis of IL-33 prokaryotic expression,M:DL2000 DNA Marker;1:COS-7 cell transfected by pcDNATM3.1/myc-HisA;2:COS-7 cell transfected bypcDNA3.1-IL-33;3:COS-7 cell;B:Western blot analysis of IL-33 prokaryotic expression,1:COS-7 cell;2:COS-7 cell transfected bypcDNA3.1-IL-33;3:COS-7 cell transfected bypcDNATM3.1/myc-HisA
3 讨 论
IL-33作为新近发现的一种细胞因子和核因子,在炎症性肠病中扮演重要角色[8]。有研究认为IL-33具有“警报素”作用,当各种原因导致肠上皮细胞破坏时,IL-33作为一种危险信号从细胞中释放,激活肥大细胞和嗜碱、嗜酸性粒细胞等,促进多种炎症细胞因子的产生,并促进初始性T细胞向Th2细胞分化,趋化Th2细胞到达病灶,发挥促炎作用[9-11]。同时,还有研究发现IL -33能使炎症性肠病动物模型炎症程度减轻,症状改善,说明IL-33能抑制炎症进展[12-14]。总之,目前研究表明IL-33在炎症性肠病发病中可能具有双重作用,其参与炎症性肠病炎症进展的具体作用机制仍未完全清楚,且需进一步发掘并探索IL-33是否具有治疗价值。
本研究选择真核表达载体pcDNATM3.1/myc-HisA,成功构建了pcDNA3.1-IL-33真核表达质粒,通过体外转染细胞,转染后的细胞能够成功表达带Myc、 His 标签的小鼠IL-33全长蛋白。下一步可以通过 6×His标签对IL-33融合蛋白进行纯化,通过pull-down实验研究筛选IL-33相互作用蛋白。此外,Myc标签还可以用于免疫共沉淀和免疫印迹实验,为研究IL-33蛋白在体内的作用及信号通路提供了有力的工具[15]。
虽然本研究已经成功构建全长IL-33的真核表达质粒,但由于不同大小IL-33的活性及作用一直存在争议,需要进一步克隆不同大小的IL-33序列并构建其真核表达质粒,为进一步研究IL-33的功能和活性提供工具。
综上所述,本研究成功构建了带His、Myc双标签的pcDNA3.1-IL-33真核表达质粒,将其转染到COS-7细胞并在体外成功表达了带HisA和Myc双标签的小鼠IL-33全长蛋白,为下一步研究IL-33在炎症性肠病的作用及其分子机制奠定了基础。
[1] Schmitz J, Owyang A, Oldham E, et al. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity,2005, 23(5): 479-490.
[2] McSorley HJ, Blair NF, Smith KA, et al. Blockade of IL-33 release and suppression of type 2 innate lymphoid cell responses by helminth secreted products in airway allergy[J]. Mucosal immunology,2014, 7(5): 1068-1078.
[3] Carriere V, Roussel L, Ortega N, et al. IL-33, the IL-1-like cytokine ligand for ST2 receptor, is a chromatin-associated nuclear factorinvivo[J]. Proceedings of the National Academy of Sciences of the United States of America,2007, 104(1): 282-287.
[4] Palmer G, Lipsky BP, Smithgall MD, et al. The IL-1 receptor accessory protein (AcP) is required for IL-33 signaling and soluble AcP enhances the ability of soluble ST2 to inhibit IL-33[J]. Cytokine,2008, 42(3): 358-364.
[5] Pastorelli L, De Salvo C, Vecchi M, et al. The role of IL-33 in gut mucosal inflammation[J]. Mediators of inflammation,2013, 2013: 608187.
[6] Lefrancais E, Roga S, Gautier V, et al. IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G[J]. Proceedings of the National Academy of Sciences,2012, 109(5): 1673-1678.
[7] Cayrol C, Girard JP. The IL-1-like cytokine IL-33 is inactivated after maturation by caspase-1[J]. Proceedings of the National Academy of Sciences of the United States of America,2009, 106(22): 9021-9026.
[8] Nunes T, Bernardazzi C, de Souza HS. Interleukin-33 and inflammatory bowel diseases: lessons from human studies[J]. Mediators of inflammation,2014, 2014(104): 423957.
[9] Pushparaj PN, Li D, Komai-Koma M, et al. Interleukin-33 exacerbates acute colitis via interleukin-4 in mice[J]. Immunology,2013, 140(1): 70-77.
[10]Pastorelli L, Garg RR, Hoang SB, et al. Epithelial-derived IL-33 and its receptor ST2 are dysregulated in ulcerative colitis and in experimental Th1/Th2 driven enteritis[J]. Proceedings of the National Academy of Sciences of the United States of America,2010, 107(17): 8017-8022.
[11]Mamdouh A K Sedhom, Mélanie Pichery, Jenna R Murdoch, et al. Neutralisation of the interleukin-33/ST2 pathway ameliorates experimental colitis through enhancement of mucosal healing in mice[J]. Gut,2013, 62(12): 1714-1723.
[12]Lihua Duan, Jie Chen, Hongwei Zhang, et al. IL-33 ameliorates experimental colitis through promoting Th2/Foxp3+regulatory T-cell responses in mice[J]. Mol Med,2012, 18(18): 753-761.
[13]Grobeta P, Doser K, Falk W, et al. IL-33 attenuates development and perpetuation of chronic intestinal inflammation[J]. Inflammatory bowel diseases,2012, 18(10): 1900-1909.
[14]Sattler S, Ling GS, Xu D, et al. IL-10-producing regulatory B cells induced by IL-33 (Breg(IL-33)) effectively attenuate mucosal inflammatory responses in the gut[J]. Journal of autoimmunity,2014, 50: 107-122.
[15]刘滢,张佩,冯永辉,等.Ag85A真核表达重组体的构建及稳定转染细胞系的建立[J].微生物学杂志,2009,29(1):22-26.
Construction & Expression of Eukaryotic Expression Plasmid of Mouse IL-33
ZHU Jun-feng1,2, SANG Li-xuan1, YANG Fang-li1, LI Yan1, ZHAI Jing-bo1, GAO Zhi-peng1,DENG Fang-bo2, SUN Xun1, WANG Da-nan1, Lü Chang-long1
(1.Teach. &Res.Div.ofImmunol.,ChinaMed.Uni.,Shenyang110122; 2.Schl.ofLifeSci.,LiaoningUni.,Shenyang110036)
Mouse IL-33 cDNA was cloned and constructed its eukaryotic expression plasmids and transfected into COS-7 cells to determine its expression. Total RNA of the lung of C57BL/6 mouse was extracted and amplified mouse IL-33 cDNA by reverse transcription-polymerase chain reaction (RT-PCR). Then the resulting gene fragment was inserted into pcDNATM3.1/myc-HisA vector after digested by restriction enzyme to construct eukaryotic expression plasmid pcDNA-3.1-IL-33. The recombinant plasmid was transfected into COS-7 cells. The expression of target gene was detected by RT-PCR and Western blotting. The inserted DNA sequence in pcDNA3.1-IL-33 was identical to mouse IL-33 cDNA, which was verified correctly by sequencing. The corresponding gene expression was detected in the recombinant plasmid-transfected COS-7 cells. The mouse IL-33 cDNA was successfully cloned and its eukaryotic expression plasmid was constructed.
IL-33; gene cloning; construction of expression plasmid; eukaryotic expression
辽宁省科学计划项目(2011415052-1)
朱俊丰 男,实验师,博士研究生。研究方向为黏膜免疫。Tel: 024-62202232,E-mail: zhujunfeng@lnu.edu.cn
* 通讯作者。教授,博士生导师。研究方向为黏膜免疫。Tel: 024-23256666-5345,E-mail: cllu@mail.cmu.edu.cn
2015-04-09;
2015-05-16
Q93-31
A
1005-7021(2015)06-0060-04
10.3969/j.issn.1005-7021.2015.06.011
