HBeAg对小鼠骨髓源性树突状细胞细胞因子分泌及其PI3K-Akt信号通路的影响
2015-12-27吴乐灿吴金明蓝松松林贤凡王秀燕张腾黄智铭吴建胜
吴乐灿,吴金明,蓝松松,林贤凡,王秀燕,张腾,黄智铭,吴建胜
(温州医科大学附属第一医院,浙江 温州 325015,1.消化内科;2.肝胆外科)
·论 著·
HBeAg对小鼠骨髓源性树突状细胞细胞因子分泌及其PI3K-Akt信号通路的影响
吴乐灿1,吴金明1,蓝松松1,林贤凡1,王秀燕1,张腾2,黄智铭1,吴建胜1
(温州医科大学附属第一医院,浙江 温州 325015,1.消化内科;2.肝胆外科)
目的:探讨乙型肝炎e抗原(HBeAg)对小鼠骨髓源性树突状细胞(DCs)细胞因子分泌及其PI3KAkt信号通路的影响。方法:分离C57BL/6小鼠骨髓细胞,体外诱导为未成熟树突状细胞(DCs),经CD11c磁珠分选纯化并用LPS刺激成熟后,分成3组:空白组、OVA组和HBeAg组。经酶联免疫吸附(ELISA)法检测各组培养上清中IL-12p70和IL-10的分泌,用混合淋巴细胞反应(MLR)和Western blot法分别检测各组DCs刺激T淋巴细胞增殖能力以及细胞内Akt磷酸化水平。结果:HBeAg组上清液中IL-12p70分泌水平以及DCs刺激T淋巴细胞增殖能力较空白组和OVA组明显降低(P<0.05),而IL-10分泌水平及DCs细胞内Akt的磷酸化水平较其余2组明显升高,差异均具统计学意义(P<0.05)。结论:HBeAg能够减弱DCs的免疫功能,抑制后者分泌IL-12的同时,增加IL-10的分泌。这些改变可能与PI3K-Akt信号通路的激活有关。
乙型肝炎e抗原;树突状细胞;白介素12;白介素10;信号通路;小鼠
目前全世界超过20亿人感染过乙型肝炎病毒(HBV),其中约3.5亿为慢性HBV感染者[1]。我国是HBV感染的高发区,HBV携带率为10%,慢性HBV感染患者约3 500万。然而当前慢性乙型肝炎仍缺乏有效的治疗措施,我国每年有超过100万的患者死于肝硬化和肝癌等HBV相关肝病。树突状细胞(dendritic cells,DCs)作为体内最强的专职抗原递呈细胞,能够直接激活T细胞,进而启动一系列免疫反应,在抗病毒免疫方面起着关键作用[2]。以往研究表明,DCs的功能缺陷将导致其不能有效地将抗原递呈给T淋巴细胞,从而导致异常的体液免疫和细胞免疫,而这可能与乙型肝炎慢性化存在密切联系[3-5]。作为免疫调节蛋白,HBeAg参与并在乙型肝炎慢性化过程中起重要作用[6]。近年来研究表明,DCs中PI3K-Akt信号通路的活化,能抑制DCs成熟,降低后者IL-12的分泌并促进IL-10分泌[7-9]。本研究通过体外HBeAg刺激正常小鼠骨髓源性DCs,观察DCs功能、细胞因子分泌和PI3K-Akt信号通路的变化,进一步探讨HBeAg在HBV感染慢性化中的作用机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:正常C57BL/6小鼠,6~8周龄,购自上海斯莱克实验动物有限公司,无特定病原菌级。
1.1.2 主要试剂:HBeAg、卵清蛋白(OVA)购自北京科卫试剂公司,RPMI-1640、胎牛血清购自美国Gibico公司,重组小鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)以及重组小鼠白细胞介素-4(rmIL-4)购自美国PeproTech公司,CDllc microbeads、磁柱购自德国Miltenyi Biotec公司,兔抗小鼠单克隆抗体CD11c-别藻蓝蛋白(APC)及同型对照购自美国BioLegend公司,小鼠IL-12p70和IL-10酶联免疫吸附试验(ELISA)试剂盒购自美国RD公司,CCK-8试剂购自日本同仁化学研究所,兔抗鼠p-Akt和Akt单克隆抗体购自Abcam公司,GAPDH单克隆抗体购自杭州贤至生物科技有限公司,ECL化学发光试剂盒购自Santa Cruz公司。
1.2 方法
1.2.1 C57BL/6小鼠骨髓DCs分离培养及纯化:取C57BL/6小鼠麻醉后用颈椎脱臼法处死,于75%乙醇中浸泡3~5 min,无菌条件下分离并取出小鼠股骨和胫骨,在超净工作台中用吸取RPMI-1640的1 mL注射器反复冲洗骨髓腔,直至颜色变白。100目滤网过滤,加入红细胞裂解液溶解红细胞,1 200 r/min离心10 min,去除上清,用RPMI 1640完全培养液(含10%胎牛血清、rmGM-CSF 10 ng/mL、rmIL-4 2 ng/ mL、1%青链霉素混合液)调整细胞浓度至106/mL,接种于6孔培养板中,37 ℃含5% CO2的培养箱中培养3 h贴壁后,去除非贴壁细胞,补足完全培养液。隔日半量换液。细胞培养至第6天时,收集悬浮和半贴壁细胞,使用MiniMACS免疫磁珠分选系统,按试剂说明书分选CD11c+细胞,即为纯化DCs。使用APC标记的小鼠CDllc单克隆抗体以及相应同型对照,流式检测DCs纯度。纯化DCs用LPS(100 ng/mL)刺激24 h,成为成熟DCs。
1.2.2 HBeAg刺激实验及分组:将成熟DCs分为3组,即加入HBeAg(5 μ g/mL)刺激24 h,为HBeAg组;加入等量OVA无关蛋白刺激24 h,为OVA组;另设空白组,加入等量RPMI-1640培养基。收集各组细胞行后续实验。
1.2.3 ELISA法检测细胞培养上清液IL-12p70和IL-10分泌水平:取各组DCs培养上清液,使用ELISA试剂盒,按试剂盒说明书测定IL-12p70和IL-10含量。酶标仪于波长450 nm处检测出样品的A值,并在标准曲线上换算出对应细胞因子的含量。
1.2.4 Western blot法测定:DCs内Akt磷酸化水平:收集各组DCs,用裂解缓冲液提取总蛋白,BCA法测定蛋白质浓度,每个样本取30 μ g蛋白,经SDSPAGE后,电转移至PVDF膜。封闭2 h,分别加入兔抗p-Akt、Akt和GAPDH(1∶1 000稀释),4 ℃过夜,TBS-T洗膜(10 min,3次),再加入山羊抗兔的二抗(1∶5 000稀释),孵育2 h,TBS-T洗3次后,ECL试剂盒显色。底片经扫描仪透扫后,用Quantity One软件进行定量分析。
1.2.5 同种异体混合淋巴细胞反应(MLR)检测DCs刺激T淋巴细胞增殖的能力:制备BALB/c小鼠脾脏细胞悬液,经自行制备的T淋巴细胞尼龙毛柱分离T细胞,用完全培养基调整细胞密度至1×106/mL作为应答细胞。将各组DCs重悬于RPMI-1640培养液中,调整细胞密度为2×105/mL,加入终浓度为25 μ g/ mL的丝裂霉素C,37 ℃、5% CO2培养箱中孵育30 min,PBS洗2次,再用完全RPMI-1640培养液重悬成5×105/mL,作为刺激细胞。将BALB/c小鼠脾T淋巴细胞和各组DCs加入96孔板共培养,每孔加入淋巴细胞100 μ L,然后分别加入40、20、10 μ L的DCs(DCs/T比值分别为1∶5、1∶10、1∶20),每种混合比例各设3个复孔,加培养液至总体积200 μ L,37 ℃,5% CO2培养箱孵育96 h。另设只含淋巴细胞的孔为对照组,含RPMI-1640的孔为本底组。培养结束前4 h,每孔各加入CCK-8试剂20 μ L,继续孵育4 h,振荡混匀后,于参比波长650 nm、检测波长450 nm处测定其吸光度(OD)。重复3次,刺激结果用刺激指数(stimulating index,SI)均值表示。SI=(实验组OD值-本底OD值)/(对照组OD值-本底OD值)。
1.3 统计学处理方法 采用SPSS 17.0统计软件。结果以表示。3组数据采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠骨髓源性DCs纯度鉴定 流式检测结果显示,用免疫磁珠法纯化后,CDllc+细胞阳性率达到90%以上,此DCs纯度可满足进一步实验的需要,见图1。
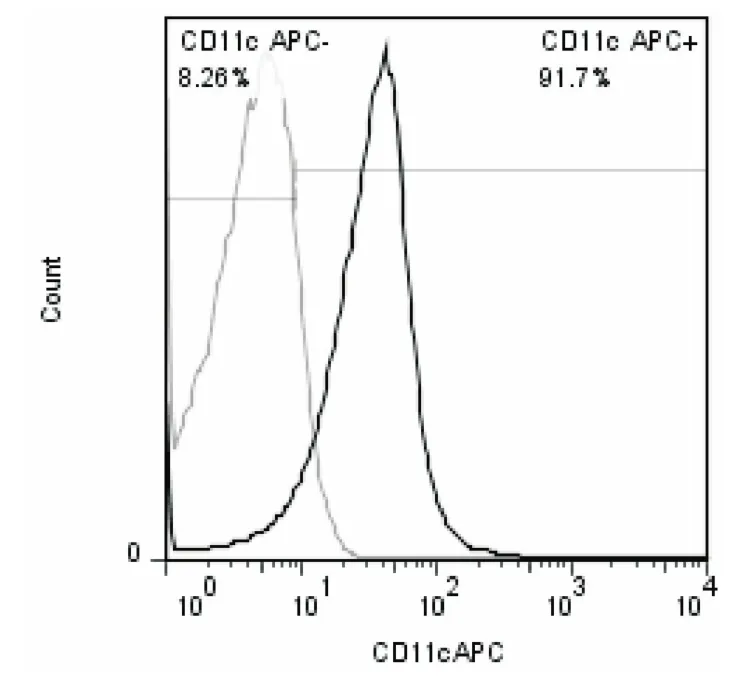
图1 免疫磁珠分选后CD11c阳性细胞比例
2.2 细胞培养上清液中IL-12p70和IL-10分泌水平
经ELISA法检测,空白组、OVA组和HBeAg组IL-12p70分泌量分别为(86.73±8.68)pg/mL、(88.17± 7.44)pg/mL和(62.85±8.63)pg/mL,应用LSD检验行组间多重比较,表明经HBeAg干预后,DCs分泌IL-12的能力明显降低,与其他2组比较,差异均有统计学意义(t值分别为-4.568和-4.843,均P<0.05),空白组和OVA组之间差异无统计学意义(t= -0.275,P>0.05)(见图2A)。相反地,HBeAg组IL-10表达水平为(44.27±5.49)pg/mL,明显高于空白组的(34.92±7.36)pg/mL和OVA组的(34.29±7.04)pg/mL(t值分别为2.213和2.363,均P<0.05),空白组与OVA组之间差异无统计学意义(t=0.150,P>0.05)(见图2B)。
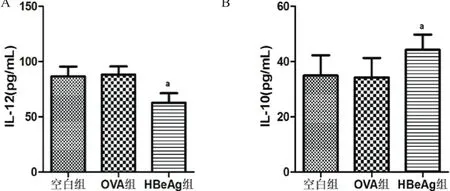
图2 各组DCs上清液IL-12和IL-10分泌水平
2.3 Western blot法测定Akt的磷酸化水平 为探索HBeAg对DCs细胞内信号通路的影响,我们对各组细胞p-Akt和Akt的表达进行了Western blot法检测。以p-Akt作为目的蛋白,Akt作为参照蛋白,使用灰度值进行定量分析,分别计算各组p-Akt/Akt比值作为最终统计指标。3组灰度值比值分别为空白组(0.493±0.025)、OVA组(0.480±0.076)、HBeAg组(0.881±0.171)。方差齐性检验示方差齐(F=4.051,P>0.05),LSD检验行组间两两比较。结果显示,HBeAg组p-Akt/Akt明显高于其余2组,差异有统计学意义(t值分别为4.338和4.487,P均<0.05),空白组和OVA组间比较,差异无统计学意义(t=0.149,P>0.05),见图3。

图3 各组DCs中p-Akt和Akt表达量
2.4 DCs刺激同种异体淋巴细胞增殖的能力 在混合淋巴细胞反应中,3组DCs刺激淋巴细胞增殖的能力随DCs/T比例增高而增高。DCs/T比例为1∶5、1∶10和1∶20时HBeAg组DCs刺激淋巴细胞增殖能力低于空白组和OVA组,差异有统计学意义(t值分别为-4.233和-4.305,-3.262和-3.334,-2.292和-2.547,均P<0.05)。空白组和OVA组的差异无统计学意义(t值分别为-0.072,-0.719,-0.255,均P>0.05),见图4。

图4 混合淋巴细胞反应中DCs对T细胞增殖的影响
3 讨论
HBV感染后不同的临床结局很大程度上取决于机体对HBV感染的免疫反应,病毒的复制和不适当的宿主免疫应答将导致HBV的慢性感染。现观点认为,HBV能躲避宿主免疫系统的清除,诱导宿主对HBV免疫耐受而得以持续感染[10-11]。DCs属于专职抗原提呈细胞,能够有效识别病毒等病原体,在抗病毒免疫中起重要作用,其拥有独特的激活初始T细胞能力,能够有效地将固有免疫和适应性免疫应答连接起来[12]。各种慢性病毒能以DCs作为靶点进行免疫逃避[13]。在HBV存在的情况下,DCs的功能缺陷可能导致耐受性T细胞应答和HBV持续感染状态。此外,DCs本身分泌的Th1型细胞因子(如IL-12)和Th2型细胞因子(如IL-10)比例的失衡也将为HBV慢性感染创造有利环境[14-16]。以往研究[17-18]表明,相对于健康人,慢性乙型肝炎患者的髓样DCs的进一步成熟能力受损,表现为上调共刺激分子、产生促炎症细胞因子和刺激T细胞的能力下降。
HBeAg不是病毒复制和感染所必需的,但却是建立慢性感染所必需的,能在慢性感染阶段对宿主免疫应答进行免疫调节[19]。有学者[20]报道,HBeAg阳性慢性乙型肝炎患者外周血DCs受聚肌胞刺激后TLR3表达异常,协同刺激因子CD86表达低下。HBeAg导致慢性乙型肝炎患者外周血Thl/Th2型细胞因子失衡,有利于形成对HBV感染的免疫耐受[21]。而用HBe(385-420)基因与CD40L胞外段基因融合所构建的真核表达载体能够显著促进DCs成熟,增强DCs功能[22]。这些研究均表明,HBeAg可能是造成慢性HBV感染者体内免疫耐受和促使病毒持续感染的关键因素。本研究通过体外HBeAg刺激小鼠骨髓来源DCs,观察DCs功能、细胞因子分泌和PI3K-Akt信号通路的变化,结果显示HBeAg组DCs的IL-12表达水平较空白组和OVA组明显降低,而IL-10的表达则较其他2组明显升高。在混合淋巴细胞反应中,HBeAg组DCs刺激T细胞增殖的能力明显低于其他2组。上述结果提示,HBeAg能够引起DCs功能低下,并且通过抑制DCs本身IL-12分泌及促进其IL-10分泌,造成Thl/Th2型细胞因子失衡。
磷脂酞肌醇3-激酶(PI3K)家族参与多种信号通路,调节细胞的主要功能。PI3K-Akt信号通路在许多人类肿瘤谱中失调,与肿瘤细胞躲避机体免疫监视和造成机体免疫耐受方面紧密相关。PI3K首次被Arbibe等[23]证实在TLRs信号网络中,能抑制TLR2介导的NF-κB的活化,阻断NF-κB启动下游炎症因子基因转录和蛋白表达。近年来研究表明,PI3K是 DCs产生IL-12的内源性抑制剂[24],对DCs的IL-12的合成起负性调节作用,而对IL-10的合成起正性调节作用[7,25]。作为抑制性因子,升高的IL-10抑制Th1细胞免疫应答,降低机体的抗病毒能力[26]。本研究Western blot法检测结果显示,相对于空白组和OVA组,HBeAg组DCs中Akt的磷酸化水平明显增高,表明HBeAg能够激活Akt信号通路。我们推测该通路的活化与细胞因子IL-12和IL-10检测结果可能存在相关性,确切关系仍需进一步实验研究。
综上所述,HBeAg一方面可能通过影响DCs中的PI3K-Akt信号通路,促进IL-10和抑制IL-12的表达,造成Thl/Th2型细胞因子失衡,致使无法产生有效的Th1型抗病毒免疫反应;另一方面可能通过减弱DCs刺激T细胞的能力,导致机体不能产生强有力的抗病毒特异性T细胞免疫,引起对HBV的免疫耐受,从而使感染慢性化。但HBeAg是通过何种方式作用于PI3K-Akt通路以及DCs中IL-12和IL-10的表达改变是否与PI3K-Akt通路存在明确相关性,尚待进一步研究。
[1] Rehermann B. Pathogenesis of chronic viral hepatitis: differential roles of T cells and NK cells[J]. Nat Med, 2013, 19(7): 859-868.
[2] Banchereau J, Briere F, Caux C, et al. Immunobiology of dendritic cells[J]. Annu Rev Immunol, 2000, 18: 767-811.
[3] Beckebaum S, Cicinnati VR, Zhang X, et al. Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape[J]. Immunology, 2003, 109(4): 487-495.
[4] Woltman AM, Op den Brouw ML, Biesta PJ, et al. Hepatitis B virus lacks immune activating capacity, but actively inhibits plasmacytoid dendritic cell function[J]. PLoS One, 2011, 6(1): e15324.
[5] Op den Brouw ML, Binda RS, van Roosmalen MH, et al. Hepatitis B virus surface antigen impairs myeloid dendritic cell function: a possible immune escape mechanism of hepatitis B virus[J]. Immunology, 2009, 126(2): 280-289.
[6] Ferrari C, Missale G, Boni C, et al. Immunopathogenesis of hepatitis B[J]. J Hepatol, 2003, 39(Suppl 1): S36-S42.
[7] Fukao T, Tanabe M, Terauchi Y, et al. PI3K-mediated negative feedback regulation of IL-12 production in DCs[J]. Nat Immunol, 2002, 3(9): 875-881.
[8] Jackson AM, Mulcahy LA, Porte J, et al. Role of mitogenactivated protein kinase and PI3K pathways in the regulation of IL-12-family cytokines in dendritic cells and the gen-eration of T H-responses[J]. Eur Cytokine Netw, 2010, 21(4): 319-328.
[9] Aksoy E, Vanden BW, Detienne S, et al. Inhibition of phosphoinositide 3-kinase enhances TRIF-dependent NF-kappa B activation and IFN-beta synthesis downstream of Toll-like receptor 3 and 4[J]. Eur J Immunol, 2005, 35(7): 2200-2209.
[10] Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures[J]. J Viral Hepat, 2004, 11(2): 97-107.
[11] Ratnam D, Visvanathan K. New concepts in the immunopathogenesis of chronic hepatitis B: the importance of the innate immune response[J]. Hepatol Int, 2008, 2(Suppl 1): 12-18.
[12] Banchereau J, Steinman RM. Dendritic cells and the control of immunity[J]. Nature, 1998, 392(6673): 245-252.
[13] Lambotin M, Raghuraman S, Stoll-Keller F, et al. A look behind closed doors: interaction of persistent viruses with dendritic cells[J]. Nat Rev Microbiol, 2010, 8(5): 350-360.
[14] Ferlazzo G, Pack M, Thomas D, et al. Distinct roles of IL-12 and IL-15 in human natural killer cell activation by dendritic cells from secondary lymphoid organs[J]. Proc Natl Acad Sci USA, 2004, 101(47): 16606-16611.
[15] Gazzinelli RT, Wysocka M, Hieny S, et al. In the absence of endogenous IL-10, mice acutely infected with Toxoplasma gondii succumb to a lethal immune response dependent on CD4+ T cells and accompanied by overproduction of IL-12, IFN-gamma and TNF-alpha[J]. J Immunol, 1996, 157(2): 798-805.
[16] 吴文治, 徐英, 吴金明, 等. HBV S-ecdCD40L治疗性疫苗对乙肝转基因小鼠肝脏中树突状细胞表型和功能的影响[J].温州医科大学学报, 2014, 44(4): 248-251.
[17] van der Molen RG, Sprengers D, Binda RS, et al. Functional impairment of myeloid and plasmacytoid dendritic cells of patients with chronic hepatitis B[J]. Hepatology, 2004, 40(3): 738-746.
[18] Duan XZ, Zhuang H, Wang M, et al. Decreased numbers and impaired function of circulating dendritic cell subsets in patients with chronic hepatitis B infection (R2)[J]. J Gastroenterol Hepatol, 2005, 20(2): 234-242.
[19] Milich DR, Jones JE, Hughes JL, et al. Is a function of the secreted hepatitis Be antigen to induce immunologic tolerance in utero?[J]. Proc Natl Acad Sci USA, 1990, 87(17): 6599-6603.
[20] 安宝燕, 谢青, 林兰意, 等. e抗原阳性慢性乙型肝炎患者外周血树突状细胞Toll样受体3的表达及意义[J]. 中华肝脏病杂志, 2007, 15(10): 729-733.
[21] 韩亚萍, 李军, 蒋龙凤, 等. HBeAg导致慢性乙型肝炎患者外周血Th1/Th2型细胞因子失衡[J]. 中华肝脏病杂志, 2013, 21(8): 584-589.
[22] 张欢, 吴金明, 陈娟, 等. HBe(385-420)-ecdCD40L真核表达载体的构建及其融合蛋白生物活性预测[J]. 温州医学院学报, 2012, 42(2): 146-150.
[23] Arbibe L, Mira JP, Teusch N, et al. Toll-like receptor 2-mediated NF-kappa B activation requires a Rac1-dependent pathway[J]. Nat Immunol, 2000, 1(6): 533-540.
[24] 徐慧, 戴元荣, 夏晓东, 等. 哮喘大鼠肺组织Akt蛋白表达上调对IL-4, IL-12和IL-13的影响[J]. 温州医学院学报, 2009, 39(5): 433-436.
[25] Hirata N, Yanagawa Y, Iwabuchi K, et al. Selective regulation of interleukin-10 production via Janus kinase pathway in murine conventional dendritic cells[J]. Cell Immunol, 2009, 258(1): 9-17.
[26] Wilson EB, Brooks DG. The role of IL-10 in regulating immunity to persistent viral infections[J]. Curr Top Microbiol Immunol, 2011, 350: 39-65.
(本文编辑:吴健敏)
Effect of hepatitis B e antigen on the cytokine secretions and PI3K-Akt signaling pathway of mouse bone marrow-derived dendritic cells
WU Lecan1, WU Jinming1, LAN Songsong1, LIN Xianfan1, WANG Xiuyan1,ZHANG Teng2, HUANG Zhiming1, WU Jiansheng1.
1.Department of Gastroenterology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Hepatobiliary Surgery, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To investigate the effect of HBeAg on cytokine secretions and PI3K-Akt signaling pathway of mouse bone marrow-derived dendritic cells. Methods: The murine bone marrow cells were cultured and induced in vitro into DCs. Then the DCs were purifed by murine CD11c microbeads and were matured overnight with LPS (100 ng/mL) to generate mature DCs. All the DCs were classifed into three groups randomly, the control group, the OVA group and the HBeAg group. The secretions of IL-12p70 and IL-10 in DCs of all groups and the ability of three groups to stimulate allogenic T cell proliferation were detected by the enzymelinked immunosorbent assay and the Mixed Lymphocyte Reaction, respectively. Then the western blot was used to detect the phosphorylation of Akt in three DCs groups. Results: After the HBeAg intervention, the expression of IL-12p70 in DCs and the stimulating T cell proliferation ability of DCs were signifcantly decreased compared to the other two groups (P<0.05), whereas the secretion of IL-10 and the phosphorylation of Akt in DCs were signifcantly increased (P<0.05). Conclusion: HBeAg may exploit PI3K-Akt signaling pathway as a strategy to suppress the immune response of DCs by inhibiting the secretion of IL-12 and increasing the secretion of IL-10.
hepatitis B e antigen; dendritic cells; interleukin-12; interleukin-10; signaling pathway; mice
R512.6
ADOI: 10.3969/j.issn.2095-9400.2015.03.004
2014-11-27
浙江省自然科学基金资助项目(LY12H03003,Y2110 768)。
吴乐灿(1989-),男,浙江乐清人,硕士生。
吴金明,主任医生,硕士生导师,Email:wzfydw@ 163.com。
