酿酒酵母胞外蛋白在衰老过程中的变化
2015-12-25杜维朴永哲周彦品王小瑜赵长新
杜维,朴永哲,周彦品,王小瑜,赵长新
1(大连工业大学,辽宁 大连,116034)2(大连民族大学,辽宁 大连,116600)
分泌蛋白(secretory protein)是指细胞或组织分泌的蛋白,同胞内蛋白一样在参与细胞增殖、分化以及细胞间的信号转导等重要生命过程中发挥作用[1]。深入了解分泌蛋白有助于弄清不同生长发育时期、不同培养状态下的细胞状态信息,细胞异常时的病理病因以及认识整个生命过程具有重要的意义[2]。Zwickl等[3]提供了一种代谢标签掺入的方法研究胞外蛋白,方法对HepG细胞和人肝组织切片进行的研究结果证实对预防和治疗肝癌其有广泛的临床应用价值。相比于原核细胞,真核细胞具有大量结构复杂的隔性间隔,为运输与分泌带来比较大的困难。公认的蛋白分泌途径主要有2种[4],一种是常规分泌途径的信号假说 (signal hypothesis);另一种为非常规的蛋白质分泌途径,如白介素-1b、纤维原细胞生长因子等都是通过不依赖信号肽的非常规蛋白质分泌途径分泌的[5]。目前已对蛋白质的转运与分泌进行了广泛深入的研究,但至今对分泌途径种类未有一个确切的定论。
衰老是自然界生物体的普遍规律,是作为生命载体-细胞的最终归宿。衰老过程伴随着复制生殖能力退化,细胞代谢不可逆减缓,细胞周期停滞,细胞生理及形态学同时也发生改变等。衰老包括复制性衰老和时序型衰老[6],前者是指能复制出子代的个数,这种衰老与遗传物质的损伤有关;时序型衰老是指在特定培养条件下菌体存活的时间。目前衰老体系已经作为一种模式应用到丝状细菌(Podospora anserine)、酿酒酵母(Saccharomyces cerevisiae)、线虫(Caenorhabditis elegans)、果蝇(Drosophila melanogaster)和小鼠(Musmusculus)等模式生物中来研究复杂的衰老现象[7]。本文以酿酒酵母为载体,探究在酿酒酵母时序型衰老的状态下胞外蛋白与胞内酶活性之间的关系,探讨衰老状态下胞外蛋白来源的变化情况。
1 材料和方法
1.1 材料
1.1.1 菌种
Saccharomyces cerevisiae FFC 2144,大连工业大学菌种保藏中心。
1.1.2 仪器
湘仪高速冷冻离心机H2050R-1;MAPADA分光光度计UV6100;北京六一双向电泳槽DYCZ-26B;北京博医康冷冻干燥机VFD2000;上海智城恒温摇床ZWYR-2101C;大龙三维脱色摇床 SK-D3309-Pro;Congent超滤仪;超声波细胞破碎仪XO-1000;Thermo Scientific台式四极杆-轨道阱高分辨质谱仪等。
1.1.3 药品
General Electric Company载体两性电解质pH 4-6.5,载体两性电解质 pH 3-10。过硫酸铵、丙酮、苯酚、尿素(科密欧,优级纯),愈创木酚,TCA,甲醇(科密欧,色谱纯);ASB-14硫脲、CHAPS、色氨酸、组氨酸、YNB、精氨酸、丙烯酰胺、SDS(阿拉丁)。
1.1.4 培养基
采用改良无蛋白质的全合成YNB培养基[8],葡萄糖 2%,(NH4)2SO41%,YNB 0.67%,DL-苹果酸0.6%,酒石酸0.2%,色氨酸0.5‰,组氨酸0.5‰,精氨酸0.5‰。
1.2 实验方法
1.2.1 菌落计数法测定菌体浓度
将菌液用含有0.05%琼脂的无菌生理盐水稀释成不同的浓度梯度,取20 μL用九格法涂到YPD平板上。每个平板3个梯度,每个梯度3个平行。涂布后的平板放入28℃下培养24 h后进行菌落计数,并换算出实际活菌浓度。活菌浓度定义为每毫升溶液中能自身分裂产生子代的活菌数,单位CFU/mL。
1.2.2 老化培养
选取细胞两种寿命中的时序型寿命作为考察条件,在菌体生长到对数期末时转入到无菌生理盐水中培养,通过长时间培养使酵母细胞老化,观察细胞形态和酶活性等情况。
1.2.3 胞内粗酶干粉的提取
将发酵液10 000×g,10 min离心弃掉上清得到酵母菌体,菌体沉淀用预冷PBS清洗3次,将清洗后的菌体放入研钵中液氮研磨。收集研磨后的菌体粉末,冻干保存。
1.2.4 胞外蛋白提取
用冻干/平衡酚-丙酮沉淀法提取胞外蛋白:将过0.22 μm膜后的发酵液直接冻干浓缩至80 mL,加入等体积的Tris-平衡酚(1 mol/L,pH 8.0)冰浴搅拌30 min后离心弃上清,保留酚相及中间层。加入3倍体积的浓度为100 mmol/L的乙酸铵-甲醇后于-20℃过夜沉淀,次日离心后的沉淀先用含有0.1%(w/v)DTT的冷丙酮清洗,再用冷丙酮清洗2次,每次10 min。清洗后的蛋白进行真空干燥除去残余丙酮,-80℃保存。
1.2.5 胞内酶活性测定
精确称取0.5 g粗酶干粉溶于10 mL PBS缓冲液中,漩涡振荡促进溶解后离心,上清液即为酶溶液。整个过程尽量低温短时间内完成以减少酵母胞内自身酶系的相互作用。测定酶溶液中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、蛋白酶的酶活性。在测定SOD、POD酶活性时加入终浓度为0.5 mmol/L的PMSF以抑制蛋白酶对测定结果的影响。其中SOD酶用邻苯三酚自氧化法[9],将4.6 mL Tris-HCl 2×缓冲液与4.4 mL蒸馏水混合后加入100 μL粗酶液25℃水浴加热20 min,在紫外波长325 nm处每隔30 s,测3 min内吸光值的变化与邻苯三酚自氧化速率作对比。酶活力定义为每毫升酶液中SOD抑制率达50%时,所对应的SOD量为1个SOD活力单位(U);用愈创木酚法[10]测定POD酶活性,将0.2 mol/L,pH 6.0的磷酸盐缓冲液2.9 mL、2.0%的 H2021.0 mL、0.05 mol/L愈创木酚1.0 mL、粗酶液0.1 mL摇匀,在37℃水浴中保温15 min,立即加入10%的TCA 2 mL终止反应,在470 nm处测量1 min吸光值的变化的平均值。以每分钟吸光值变化0.01为1个酶活力单位(U)。蛋白酶活性测定采用国标法,酶活力定义为在40℃下,将每分钟水解酪蛋白产生1 μg酪氨酸定义为1个活力单位。
1.2.6 胞外蛋白的双向电泳
1.2.6.1 蛋白样品的溶解及定量
取保存的蛋白质干粉溶于适量的裂解液中(7 mol/L 尿素,2 mol/L 硫脲,2%CHAPS,2%ASB-14,20 μL 3-10两性电解质,0.1%DTT)4℃过夜并用Bradford法[11]测定蛋白质含量,根据裂解液体积估算蛋白质提取率,并将裂解液稀释至上样所需浓度。
1.2.6.2 等电聚焦
IEF 胶条的制作:取540 μL H2O,200 μL 30%丙烯酰胺,0.6 g尿素,4~6载体两性电解质 4.8 μL,3~10 载体两性电解质 24 μL,5 μL 10% 过硫酸铵,4 μL TEMED混匀并缓缓注入到玻璃管中(12 cm),室温聚合。等电聚焦电压如下:300 V,30 min;500 V,1 h;800 V,1 h;1 600 V,4 h。
1.2.6.3 胶条平衡
首先将等电聚焦后的胶条由玻璃管的一端挤出放入含有0.2 g/mL DTT的平衡液中平衡15 min,然后再置于0.2 g/mL碘乙酰胺中平衡17 min。平衡液:6 mol/L尿素,体积分数为20%甘油,2%SDS,50 mmol/L Tris-HCl(pH 8.8,1.5 mol/L)。
1.2.6.4 SDS-PAGE
将平衡后的胶条转移到12%浓度的二维胶上进行恒流电泳,参数为20 mA/gel 15 min,40 mA/gel直至溴酚蓝移动到胶条的最低端。
1.2.6.5 蛋白染色
Neuhoff考染法[12]
1.2.7 蛋白点鉴定
1.2.7.1 前期酶解
用去尖的枪头从胶上切下蛋白点后清洗,加入50%乙腈/0.2 mol/L NH4HCO3(pH 8.0)进行脱色,用100%ACN进行脱水,冻干后的胶加入胰蛋白酶溶液进行酶解。
1.2.7.2 质谱样品制备
向吸涨后的胶块加入不含胰蛋白酶的50 mmol/L NH4HCO3缓冲液,放置在37℃培养箱反应过夜。次日用掌式离心机离心,取出上清转移至加入了60%CH3CN/5%TFA的新管中;在沉淀中加入超纯水,孵育10 min,离心移出上清与前一管上清液混合;再向沉淀中加入60%ACN/0.1%TFA超声15 min,吸出溶液,并入前次上清,反复抽提2次,将所得上清用真空离心浓缩仪干燥5 min,放入-80℃冰箱中过夜。次日冻干后-80℃保存。
1.2.7.3 质谱分析
色谱条件:富集柱:C18(100 μm ×2 cm),分析柱C18(75 μm ×15 cm,2 μm),流动相 a:98%H2O+2%CH3CN+0.1%TFA,流动相 b:20%H2O+80%CH3CN+0.1%TFA,柱温 35 ℃,流速 0.25 μL/min。质谱条件:喷雾电压2.5 kV,离子源温度300℃,扫描范围:m/z=300~2000。利用Xcalibue软件和NCBI等相关数据库搜索比对。
2 结果与讨论
2.1 衰老过程中培养基内活细胞数与胞外蛋白测定结果
将处于对数末期的酵母细胞转入无菌生理盐水培养,每2天用菌落计数法测定活细胞数量以及胞外蛋白含量,结果如图1所示。
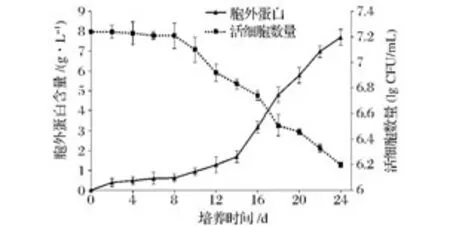
图1 衰老过程中胞外蛋白与活细胞数量关系图Fig.1 The number of viable cells and extracellular protein content in the culture
图1可知在无菌生理盐水中培养的酵母细胞在8 d内细胞数量基本维持稳定,测定结果来看细胞数目峰值为107.25个/mL,到第8天时细胞数目为107.21个/mL。可复制出子代的活性细胞占峰值的92%以上,8%细胞中包括休眠细胞、死亡裂解细胞以及误差等。图1同时显示8 d内胞外蛋白含量没有明显升高,通过以上的数据进行下一步实验方案的确定,尽量将细胞裂解对胞外蛋白组成的干扰降到最低,故第8天为胞外蛋白的最佳提取时间。从第8天开始活细胞数量显著下降,胞外蛋白含量明显增加。24天时细胞数量下降约1个单位左右,胞外蛋白浓度达到7.2 g/L。由此可知在无菌生理盐水培养4 d内细胞由于处在无外源C源的胁迫下,酵母产生了一种应答机制[13]。这种应答机制将利用胞内储存的能量合成并向外环境分泌蛋白酶和信号肽等胞外蛋白。随着培养的继续细胞内能量耗尽,一部分细胞出现老化自溶,一部分细胞进入休眠状态,这两类细胞在菌落计数中不会被体现。有活性的菌体数每下降0.7个单位说明有一半的细胞老化严重不能在充足营养下短时间内复制出子代,在此过程中胞外蛋白含量急速上升,说明有小部分细胞自溶亦或是酵母胞内蛋白在向外排出。
2.2 衰老过程中胞内酶活性测定结果
根据图1得到的数据酵母在无营养培养基中老化衰老,在第8天开始逐渐转为休眠状态亦或是老化凋亡。故8 d内酵母形态及数目基本保持完整,有利于测定胞内酶系变化。测定9 d内酵母老化过程中胞内SOD酶、POD酶、蛋白酶的变化,结果如图2所示。
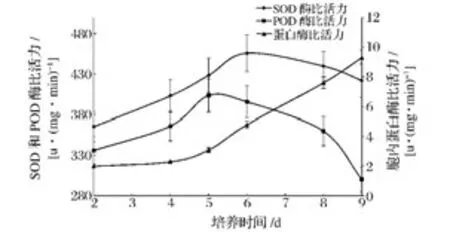
图2 衰老培养过程中SOD酶、POD酶、蛋白酶活性Fig.2 The activities of SOD,POD and protease during long term fermentation in saline
SOD、POD酶是细胞抗氧化酶系中的关键酶,负责将对细胞有害的氧自由基(super oxygen anion,O2-)转化成低害的H2O2,并最终转化成无害的H2O,其活性的变化与细胞的氧化程度密切相关。故SOD、POD酶活性相对高低可以作为细胞老化程度的一个依据[14]。从图上看,在持续饥饿胁迫下 SOD酶、POD酶的活性都呈先升高后降低的趋势,在5~6天时达到峰值,而后迅速下降。在前5 d的衰老过程中SOD、POD酶活性上升以清除不断增加的氧自由基,但5 d后由于细胞内能量消耗殆尽导致胞内抗氧化酶活性降低,不能及时清除不断产生的自由基,自由基的积累会导致细胞组织机能紊乱,进而使细胞稳态失衡、老化加剧[15]。与之不同的是胞内蛋白酶活性一直处于升高状态,且随着培养天数的增加蛋白酶活性升高明显。胞内蛋白酶主要存在于溶酶体中,在细胞内的消化器官、细胞自溶、防御以及对某些物质的利用等方面起作用。5~6天时SOD、POD酶活性的降低与蛋白酶活性的急剧升高相对应。胞外蛋白不断增加的原因可能是细胞受到氧化性损伤,在老化状态下细胞内部分修饰错误或老化失活的蛋白被降解从而排到细胞外。
2.3 双向电泳图谱比较
提取在YNB培养基培养3 d的酵母胞外蛋白以及在无菌生理盐水中衰老培养8 d的酵母胞外蛋白做双向电泳,结果如图3所示。

图3 酵母胞外蛋白双向电泳图谱Fig.3 Two-dimensional gel electrophoresis analysis of extracellular protein
从图3来看两张图谱的特征相一致,在两张图的左侧都出现并排的纵向条纹,在同一分子质量上都有并排出现的横向拖尾,且一半以上的蛋白点都可以相互识别。与正常培养时相比,衰老状态下酵母胞外蛋白表达量大、蛋白点多20% ~30%,在局部放大图中可以清晰地看到衰老培养比正常的图多出许多分子质量较低的随机散乱的蛋白点。这说明在饥饿胁迫下酵母逐渐衰老的过程中,胞外蛋白的组成发生了较大变化。

图4 酵母胞外蛋白双向电泳局部放大图Fig.4 Magnification of two-dimensional gel electrophoresis
2.4 质谱分析结果
质谱分析结果显示,在9个鉴定结果中检测到8个胞内蛋白、1个胞外蛋白、1个蛋白为匹配。匹配到的胞外蛋白覆盖率较高达到87.63%,匹配到的胞内蛋白匹配率较低,基本都在30%以下。质谱结果表明在衰老培养条件下,从图谱上看散乱的点为胞内蛋白。蛋白点与数据库匹配率不高,蛋白点多为对比目标蛋白的碎片,而非完整蛋白。说明这些蛋白经过水解后排出到细胞外,这也与胞内蛋白酶活性升高相吻合。初步推论为衰老过程中的酵母细胞将细胞内的某些被破坏或失活的蛋白水解成碎片后排出到细胞外,而对于这些被排出的蛋白是否被进行统一的修饰标记以及这些蛋白的具体排出途径有待于我们进一步的论证。

表1 质谱分析结果Table 1 The results of MS analysis
3 结论
本文在连续饥饿胁迫下对酿酒酵母进行衰老培养,提取衰老状态下的酿酒酵母胞外蛋白并用双向电泳进行图谱分析。结合胞内SOD酶、POD酶、蛋白酶活性变化,及质谱的分析结果等得出在衰老状态下SOD、POD酶活性先升高后降低,过氧化物酶活性的降低导致其不能及时清除衰老过程中产生的自由基,胞内氧活性自由基对细胞造成氧化损伤。同时蛋白酶活性的持续升高使胞外蛋白图谱变化明显,蛋白酶活性的升高将一部分老化组织降解成碎片,使此类的“垃圾蛋白”最终排出到胞外。
[1] 张海婧,刘辉,吕丽艳,等.分泌蛋白质组研究进展[J].分析化学,2007,35(6):912-918.
[2] 李明,邓芳,王保龙.分泌蛋白质组学在肿瘤标志物研究中的进展[J].临床输血与检验,2013,15(4):407-409.
[3] Zwickl H,Traxler E,Staettnrt S,et al.A novel technique to specifically analyze the secretome of cells and tissues[J].Electrophoresis,2005,26(14):2 779-2 785.
[4] Lee M C,Miller E A,Goldberg J,et al.Bi-directional protein transport between the ER and Golgi[J].Annu Rev Cell Dev Biol,2004,20:87-123.
[5] Seelenmeyer C,Wegehingel S,Tews I.Cell surface counter receptors are essential components of the unconventional export machinery of galectin-1[J].Cell Biol,2005,171(2):373-381.
[6] Steinkraus K A,Kaeberlein M,Kennedy B K,et al.Replicative aging in yeast:the means to the end[J].Annu Rev Cell Dev Biol,2008,24:29-54.
[7] 杨婷,张冲,陈清轩.衰老机制研究进展[J].中国生物工程杂志,2005,25(3):6-11.
[8] CHEN Y P,Kirk N,Piper P W.Effects of medium compositionon MF-α1 promoter-directed secretion of a small protease inhibitor in Saccharomyces cerevisiae batch fermentation[J].Biotechnology Letters,1993,15(3):223-228.
[9] 顾含真,陆领倩,袁勤生,等.超氧化物歧化酶两种测活方法的比较[J].药物生物技术,2006,13(5):377-379.
[10] 黄智,戴思慧,马凌珂,等.西瓜种子萌发过氧化物酶活性变化的研究[J].湖南农业科学,2010(9):43-45.
[11] 李海玲,彭书明,李凛,等.4种常用蛋白浓度测定方法的比较[J].中国生化药物杂志,2008,29(4):277-278.
[12] Neuhoff V,Arold N,Taube D,et al.Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nano-gram sensitivity using Coomassie Brilliant Blue G-250 and R-250[J].Electrophoresis,1988,9(6):255-262.
[13] Bennett J Giardina,Bruce A Stanley,Hui-Ling Chiang.Glucose induces rapid changes in the secretome of Saccharomyces cerevisiae[J].Proteome Science,2014(12):9-18.
[14] 袁方,朴永哲,刘巨涛,等.外源肌醇、柚皮苷及姜黄素对酿酒酵母抗衰老性能影响[J].酿酒科技,2014,241(7):43-47.
[15] Letelier M,Lepe A,Faúndez M,et al.Possible mechanisms underlying copper-induced damage in biological membranes leading to cellular toxicity[J].Chemico-Biological Interactions,2005,151(2):71-82.
