葡萄酒酵母car1基因表达量与EC含量相关性的研究*
2015-12-25魏玉洁付方圆武顺邹弯薛洁闫寅卓武运
魏玉洁,付方圆,武顺,邹弯,薛洁,闫寅卓,武运
1(新疆农业大学,新疆乌鲁木齐,830052)2(中国食品发酵工业研究院,北京,100015)
葡萄酒酿造是一个复杂的过程,其中由酵母菌主导的酒精发酵过程是最为关键的工艺步骤,酿酒酵母性能的优劣不仅对葡萄酒的口感和风味影响很大,而且还直接影响到所酿葡萄酒的产量、质量,甚至是安全性[1]。氨基甲酸乙酯(carbamate ethyl)是一种具有遗传毒性和致癌性的酵母代谢副产物[2-3],被国际癌症研究机构确认为人类可能致癌物质(2A类)[4],因此生产上应尽可能降低葡萄酒中EC的含量。
葡萄酒中的EC形成主要与前体物质尿素和瓜氨酸有关[5-8],它们在葡萄酒中的积累分别是酿酒酵母和苹果酸乳酸细菌对葡萄汁中精氨酸代谢的结果。本课题前期研究结果表明,与乳酸菌相比,酿酒酵母代谢精氨酸产生尿素对葡萄酒中氨基甲酸乙酯含量的影响更为重要[9]。研究证明,酵母代谢产生尿素的关键酶是精氨酸酶[10-11],许多研究者对此途径酶的基因及其调控进行了研究。在葡萄酒酵母中,编码精氨酸酶的基因是car1,基于此Suizu等通过破坏car1基因构建不产尿素的清酒酵母[12],因此推断car1基因的活性与葡萄酒中尿素和EC的含量密切相关。
实时荧光定量PCR(real-timePCR)实现了聚合酶链式反应技术(polymerase chain reaction,PCR)从定性到定量的飞跃,该技术利用PCR反应体系中添加的特定荧光基团,实时监测整个PCR进程中荧光信号的累积,从而对DNA、RNA样品或者目标基因的表达进行定量分析。具有重复性好、灵敏度高、定量准确、速度快等优点[13-15]。本实验研究了发酵期间不同酿酒酵母产EC能力的差异,同时利用荧光PCR技术对酵母中car1基因的表达活性进行了比较,以期为降低葡萄酒中EC含量,筛选适宜的酿酒酵母鉴定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 葡萄酒酿酒酵母
共18株酿酒酵母,其中13株来自本实验室从新疆酿酒葡萄表皮分离的酿酒酵母,5株来自商业活性干酵母,18株供试酵母分别标记为Y1~Y18。
赤霞珠葡萄汁:由丰收葡萄酒有限公司提供。
1.1.2 仪器与设备
气质联用仪,美国PerkinElmer公司;安捷伦DBFFAP毛细管色谱柱(60m×0.25μm×0.25μm);strata FL-PR Florisil固相萃取柱,上海安谱科学仪器有限公司;电泳仪,北京六一仪器厂;凝胶成像仪和PCR仪,美国Bio-Rad公司;7500fast荧光定量PCR仪,美国ABI公司;核酸定量仪,日本岛津公司。
1.1.3 主要化学试剂
氨基甲酸乙酯(EC)(纯度>99%)、内标物氨基甲酸丙酯(nPC)(纯度 >98%,Sigma公司)。丙酮(色谱纯)、二氯甲烷(分析纯)、瓜氨酸(色谱纯,百灵威)。琼脂糖(Biowest Agarose)、EB(Sigma)、反转录试剂盒(TaKaRa)、Power SYBR Green PCR Master Mix(ABI)、car1引物和ACTE引物(Life Technologies)、荧光定量8连管(Axygen)、RNase-free水(TakaRa)、RNase-free的枪头和1.5 mL EP管(Axygen)。
1.2 分析方法
1.2.1 葡萄酒中EC含量的测定
采用 GC-MS 方法[16]。
1.2.2 精氨酸的测定方法
采用PITC柱前衍生高效液相色谱[17]。
1.2.3 酿酒酵母的活化
供试斜面酵母在10 mL灭菌后的麦汁中经18 h活化后接种到装有300 mL赤霞珠葡萄汁的三角瓶中;商业酵母在10 mL灭菌后的麦汁中活化30 min后接种到装有300 mL赤霞珠葡萄汁的三角瓶中。然后在28℃下发酵5~8 d,每天称重,连续2 d重量不变化发酵结束。
1.2.4 酵母RNA提取
在发酵过程中收集酵母菌体用液氮研磨成粉,加入1 mL Trizol试剂,按商品提供的操作手册进行RNA提取,最后加入50 μL去RNA酶的双蒸水溶解。
1.2.5 RNA浓度、纯度检测
利用BioSpec-nano nucleic acid analyzer检测提取的总RNA浓度和纯度。
1.2.6 RNA凝胶电泳检测
先用1 mol/L NaOH浸泡电泳槽和制胶板1~2 h。配制1%琼脂糖凝胶,总RNA上样量1 μg左右。电压200 V,电流400 mA、电泳时间30 min。
1.2.7 酵母RNA的反转录
使用TaKaRa反转录试剂盒进行反转录,反应条件为:37℃,15 min(逆转录反应);85℃,5 s(失活逆转录酶);反应结束后,将cDNA溶液放置于-20℃保存备用或立即进行荧光定量PCR。
1.2.8 荧光定量PCR
以酵母acte基因作为内参,引物为:5'-CATGTTCCCAGGTATTGCCG-3’,5'-GCCAAAGCGGTGATTTCCT-3’;酿酒酵母精氨酸酶基因car1的引物为:
5'-TGGGTATCGCCGCCTTTT-3’,5'-GGGACTTCACCGTTTGTTTCT-3'
然后将反转录实验获得的cDNA溶液进行10倍稀释,配制反应液,在ABI 7500 Fast上进行Real Time PCR反应,反应条件为:95℃,10 min,循环1次;95℃,15 s,60 ℃,40 s,循环40 次,并采集荧光。
1.2.9 car1基因相对表达量的计算
采用 Livak 和 Schmittgen(2001)[18]的2-ΔΔCT公式计算基因相对表达量,其中ΔΔCT=(CT,Target-CT,Acte)Time x-(CT,Target-CT,Acte)Time 0。CT,Target和CT,Acte分别是目标基因和内参基因的CT值;Time x和Time 0分别指不同采样时间点。分别以第1天采样的样本获Y15酵母为参照,将其值转换成1,其他样品与之比较,即获得相对表达值。
2 结果与分析
2.1 酿酒酵母发酵性能的比较研究
将18株酿酒酵母按照1.2.3的方法活化,然后接入装有300 mL葡萄汁的三角瓶中,28℃下发酵,每天称重。发酵曲线如图1所示。

图1 18种酿酒酵母发酵期间失重变化情况Fig.1 18 kinds of S.cerevisiae weightlessness during fermentation
从图1可以看出,18种酿酒酵母发酵曲线基本相似,在发酵第2天,所有酵母均已起酵,第3天达到发酵高峰,随后酵母的活性逐渐降低,第7~8天发酵基本停止。但从起酵速度和发酵速度两方面来讲,不同酵母间又存在显著差异,本实验室分离的酿酒酵母Y4、Y5、Y7、Y15的起酵速度最快,甚至高于5种商业酵母;而失重最多的酵母分别为Y5、Y4和商业酵母Y15。
对发酵结束的葡萄酒进行理化指标的检测,检测方法参照国家标准GB/T 15038,具体结果见表1。
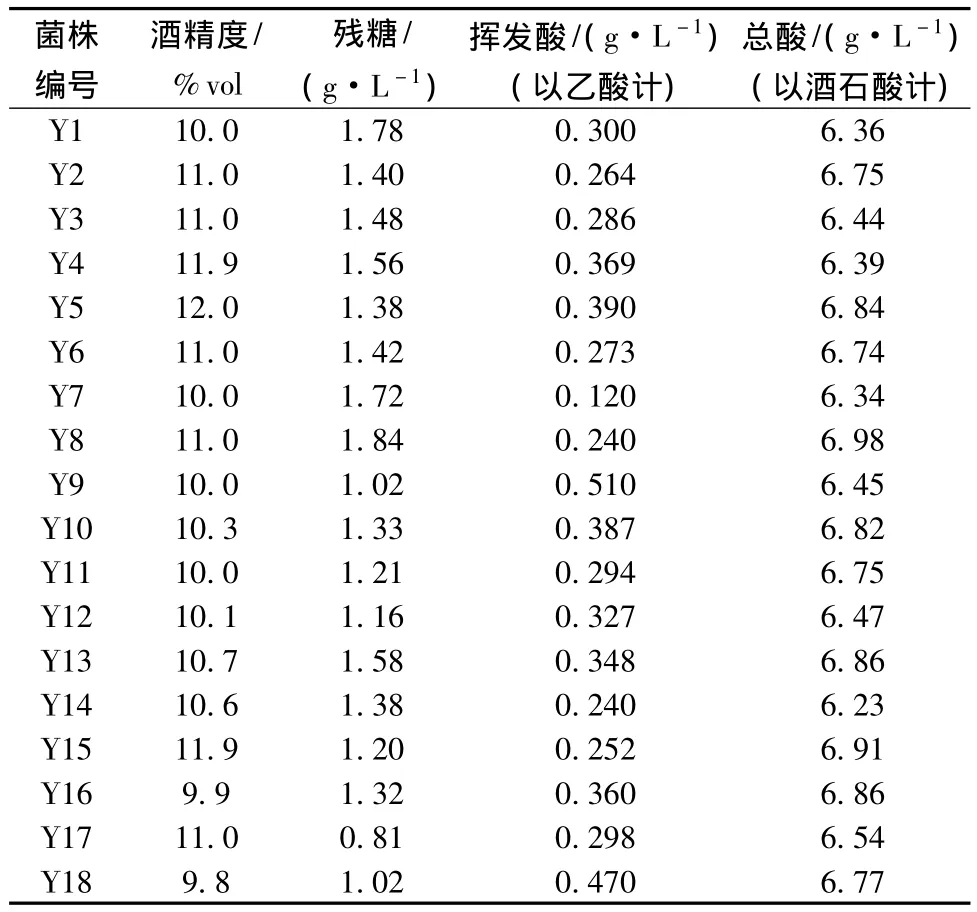
表1 不同酵母发酵葡萄酒基本理化指标Table 1 The physical and chemical indicators of different S.cerevisiae ferment in wine
由表1看出,不同酵母发酵结束后葡萄酒的酒精度存在差异,酒精度最高的酵母依次为Y5、Y4和Y15,与发酵期间的失重量正好对应。而其余酵母发酵后的理化指标也满足葡萄酒国家标准的各项要求,均可以进行工业化的生产应用。
2.2 酿酒酵母代谢产生尿素和EC能力的分析研究
目前,大多数研究认为,酵母菌是影响葡萄酒中EC含量的主要微生物,因为不同酵母菌分泌和代谢尿素的能力不同,本研究在其他发酵条件均相同的条件下,研究了不同酵母菌对发酵期间精氨酸含量的变化,以发酵性能比较好的Y4、Y5、Y15和Y8酵母为例,发酵期间精氨酸的变化趋势如图2所示。
尿素为葡萄酒中EC形成的主要前体物质,是发酵过程中精氨酸代谢的副产物。从图2可以看出,精氨酸含量在发酵期间的变化规律基本相似,均呈现指数下降趋势,即呈现一级动力学反应特点,发酵开始精氨酸含量下降迅速,而后期逐渐减缓。但酵母类型不同,反应速率存在显著差异,图2中的4种酵母,Y15的速率最大,其次为Y5、Y4和Y8。

图2 四种不同类型的酵母发酵期间精氨酸含量的变化Fig.2 The change of arginine during the fermentation,which is ferment from 4 kind of S.cerevisiae
2.3 酿酒酵母car1基因表达量的分析
在葡萄酒酿造过程中,酵母降解精氨酸生成尿素和鸟氨酸,该过程受car1基因编码的精氨酸酶活性的影响。由基因car1编码的精氨酸酶代谢精氨酸产生尿素,car1基因表达量越多,尿素的积累量越大,产生的EC也就越多。因此控制精氨酸酶的基因car1的表达量是降低葡萄酒中EC含量的关键。所以筛选低产尿素的酵母,即car1基因表达量低的酵母是降低葡萄酒中EC含量的关键因素。
2.3.1 RNA样品的质量检测
本研究利用紫外分光光度计对从酵母细胞中提取的RNA的OD值进行测定,结果如表2所示。

表2 不同酵母细胞RNA的OD值Table 2 The OD value of different S.cerevisiae cell RNA
表3结果显示,将酵母总RNA样品进行紫外分析测定,18种酿酒酵母的RNA OD260/280基本在2.0左右,说明样品中没有其他小分子物质的污染。凝胶电泳检测结果表明:用本方法提取的总RNA样品28S、18S的带型整齐清楚(图3),这一结果说明,用本方法提取的酿酒酵母总RNA完整性较好,没有出现降解。因此,用本方法提取的酵母总RNA样品纯度较高。总RNA浓度在853.4~1 576.1 ng/μL。后续的RT-PCR扩增试验的结果证实,本方法提取的酵母总RNA的质量较高、完整性好,能满足多数分子生物学试验要求。

图3 酵母总RNA电泳结果Fig.3 Total RNA electrophoresis results of S.cerevisiae

图4 目的基因的扩增曲线和溶解曲线Fig.4 Amplification curve and dissolution curve of purpose gene
以不同酵母的cDNA为模板,每组设3个重复,经Real-timePCR后,扩增曲线的走势正常,拐点清楚,整体平行性好,基线平而无上扬现象,并且溶解曲线的峰值单一(图4、图5),说明引物具有高度特异性,没有非特异性产物扩增。

图5 内参基因的扩增曲线和溶解曲线Fig.5 Amplification curve and dissolution curve of Internal gene
2.3.2 酵母car1基因在酒精发酵期间不同阶段的表达
图2结果显示,不同酵母发酵的发酵液中精氨酸含量均呈下降趋势,由于car1基因可代谢精氨酸产生尿素,因此本研究分析了发酵期间不同酵母car1基因的表达情况,以发酵初始酵母为对照,结果如图6所示。
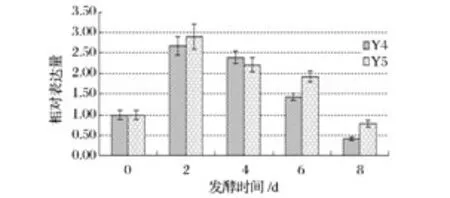
图6 Y4、Y5酵母在发酵期间car1基因的表达Fig.6 The Y4,Y5 S.cerevisiaestrains expression level of car1 gene during fermentation
图6结果说明,2种不同的酿酒酵母在发酵期间,car1基因均呈现先增加后降低的趋势,本实验中,发酵第2天基因的相对表达量最高,Y4、Y5酵母分别为发酵开始时基因表达量的2.67和2.90倍,比较而言,此时Y5酵母代谢精氨酸的能力更强,这正好与2个样品精氨酸的含量相一致(Y4、Y5酵母发酵第2天精氨酸含量分别为16.778和16.293)。比较图1和图6的变化情况发现,酵母的发酵曲线与car1的基因表达也基本相似,图1中发酵第3天达到高峰,此后趋势逐渐减缓,这也说明了酵母的活性直接影响基因的表达情况,生产中降低酵母活性的措施在一定程度上也能抑制基因的表达量。
取发酵第2天的发酵液和酵母,分别检测发酵液中的EC含量和酵母中car1基因的表达量,结果如图7所示。不同酵母由于car1基因表达情况不同,造成葡萄酒酵母代谢精氨酸以及产生尿素的能力不同,直接影响到发酵液中的EC含量。本研究中产EC最高的是Y14酵母,发酵第2天的EC含量为1.58 ng/L,而Y18酵母产量最低,仅为0.23 ng/L,差异达到了极显著水平;结合图2、图6和图7的结果,酵母car1基因的表达量与发酵液中的精氨酸呈负相关关系,相关系数在0.990 3~0.997 7之间,达到了极显著水平;而car1基因的表达量与EC含量呈现正相关关系,相关系数在0.624 9~0.995 8之间,酿酒酵母car1基因的表达量与发酵液中的EC含量基本一致,所以葡萄酒酵母代谢精氨酸以及尿素的分泌具有菌株特异性,不同酵母精氨酸代谢能力存在显著差异。
3 讨论

图7 18种不同酿酒酵母EC含量与基因表达量的关系Fig.7 The correlation between the 18 S.cerevisiae strains content of EC and amount of gene expression
本研究结果表明,酿酒酵母car1基因的活性在发酵期间呈现先上升后下降的趋势,不仅与发酵醪液中精氨酸的变化趋势基本一致,而且与酵母自身的繁殖情况也相同,因此降低发酵温度和酵母接种量等影响酵母活性的措施也将会通过影响car1基因活性,进而影响到葡萄酒中的EC浓度。本研究分析的18株酿酒酵母,Y18酵母产EC能力最低,而Y14酵母最高,不同酵母间存在显著差异,在其他发酵参数均相同的条件下,酵母car1基因的表达量与该酵母发酵后葡萄酒中的EC含量也呈现正相关关系,因此筛选精氨酸酶活力低的酵母菌株,是降低葡萄酒中EC含量的主要措施之一。
尿素作为影响葡萄酒中EC含量的关键因素之一,在葡萄酒酒精发酵过程中,其形成主要来自于精氨酸降解。即在较好氮源缺乏的情况下,精氨酸会在精氨酸酶的作用下分解为尿素和瓜氨酸,精氨酸酶作为尿素形成的一个关键酶,主要是由 car1编码。1990年酿酒酵母中的精氨酸酶基因被首次敲除,研究者通过小规模发酵试验观察到野生型菌株和精氨酸酶基因敲除菌株之间的二氧化碳排放量相差不大,这表明精氨酸酶基因敲除后不影响酿酒酵母的发酵性能[19]。但后期研究表明使用精氨酸酶基因缺陷型菌株进行发酵容易受到野生型酵母菌株的污染[20],而且基因手段构建的酵母菌株的安全性问题仍无定论,目前基因工程菌在工业化生产中是不建议使用的,因此了解car1基因在酵母发酵过程中的表达特点,筛选car1活性低的酿酒酵母具有重要意义。目前,我国葡萄酒领域有关该基因的表达研究极为少见,本研究对酿酒酵母car1基因在发酵过程中的表达分析结果,对进一步探讨该基因对葡萄酒EC含量的影响方面的作用具有重要参考价值。
[1] Fleet G H.Wine yeast for the future[J].FEMS Yeast Research,2008,8(7):979-995.
[2] Beland F A,Wayne B R,Mellick P W,et al.Effect of ethanol on the tumorigenicity of urethane(ethyl carbamate)in B6C3F1 mice [J].Food and Chemical Toxicology,2005,43(4):1-19.
[3] Miller Y E,Dwyer-Nield,Keith R L,et al.Induction of a high incidence of lung tumors in C57BL/6mice with multiple ethyl carbamate injection [J].Cancer Letters,2003,198(4):139-144.
[4] Lachenmeier D R,Kanteres F,Kuballa T,et al.Ethyl carbamate in alcoholic beverages from Mexio(tequila,mescal,stool)and Guatemala(cuxa):Market survey and risk assessment[J].International Journal of Environmental Research and Public health,2009,6(1):349-360.
[5] Delledonne D,Rivetti F,Romano U.Developments in the production and application of dimethylcarbonate[J].Applied Catalysis A:General,2001,221(1-2):241-251.
[6] WANG D,YANG B,ZHAI X,et al.Synthesis of diethyl carbonate by catalytic alcoholysis of urea[J].Fuel Process Technology,2007,88(8):807-812.
[7] Azevedo Z,Couto J A,Hogg T.Citrulline as the main precursor of ethyl carbamate in model fortified wines inoculated with Lactobacillus hilgardii:a marker of the levels in a spoiled fortified wine[J].Letters in Applied Microbiology,2002,34(1):32-36.
[8] Arena M E,Manca de Nadra M C.Influence of ethanol and low pH on arginine and citrullinemetabolism in lactic acid bacteria from wine [J].Research in Microbiology,2005,156(8):858-864.
[9] 梁萌萌,薛洁,张敬,等.葡萄酒中氨基甲酸乙酯的分析与控制[J].酿酒科技,2013,225(3):40-43.
[10] Uthurry C A,Varela F,Colomo B.Ethyl carbamate concentrations of typical Spanish red wines[J].Food Chemistry,2004,88(3):329-336.
[11] Uthurry C A,Suárez Lepe J A.Ethyl carbamate production by selected yeasts and lactic acid bacteria in red wine[J].Food Chemistry,2006,94(2):262-270.
[12] Suizu T,Limura Y,Gomi K,et al.Construction of urea non-producing yeast Saccharomyces cerevisiae by disruption of the car1 gene[J].Agric Biol Chem,1990,54(2):537-539.
[13] Haller F,Kulle B,Schwager S,et al.Equivalence test in quantitative reverse transcription polymerase chain reaction:confirmation of reference genes suitable for normalization[J].Analytical Biochemistry,2004,335(1):1-9.
[14] Ransbotyn V,Reusch T B H.Housekeeping gene selection for quantitative real-time PCR assays in the seagrass Zostera marina subjected to heat stress[J].Limnology and O-ceanography:Methods,2006,4(5):367-373.
[15] Yoo W G,Kim T I,LI S,et al.Reference genes for quantitative analysis on clonorchis sinensis gene expression by real-time PCR[J].Parasitol Research,2009,104(2):321-328.
[16] 付方圆,薛洁,梁萌萌,等.葡萄酒贮存过程中氨基甲酸乙酯含量的变化[J].食品与发酵工业,2014,40(8):34-39.
[17] 杨菁,孙黎光,白秀珍.异硫氰酸苯酯柱前衍生化反相高效液相色谱法同时测定18种氨基酸[J].色谱,2002,20(4):369-370.
[18] Livak K J,Schmittgen,T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J].Method,2001,25(4):402-408.
[19] Suizu T,Iimura Y,Gomi K,et al.Construction of urea non-producing yeast Saccharomyces cerevisiae by disruption of the car1 gene [J].Agriculture Biological Chemistry,1990,54(2):537-539.
[20] Yoshiuchi K,Watanabe M,Nishimura A.Breeding of a non-urea producing sake yeast with killer character using a kar1-1 mutant as a killer donor[J].Journal of Industrial Microbiology & Biotechnology,2000,24(3):203-209.
