嗜水气单胞菌低分子质量蛋白的相关研究
2015-12-24谭礼宁王娟英欧阳家和余小岚孙莉娜林向民
谭礼宁,王娟英,欧阳家和,余小岚,孙莉娜,林向民
(1.福建农林大学福建省农业生态过程与安全监控重点实验室;2.福建农林大学生命科学学院,福建福州350002)
细菌中的蛋白质是微生物维持生命活动的基本功能单位,随着全基因组序列测序的进一步深入,以双向电泳技术为基础的经典蛋白质组学技术和以标记定量蛋白质组学与质谱联用为基础的新兴技术,是当前研究微生物蛋白质的主要方法与策略之一[1,2].利用上述技术,研究人员建立了诸如大肠杆菌、金黄色葡萄球菌、结核分枝杆菌等细菌的蛋白质组学平台,并对这些蛋白的功能进行了广泛的研究[3-6].低分子质量(LMW)蛋白质一般是指分子质量低于25 ku的蛋白质,它们在生物体内发挥重要的生物学功能[7-9].研究表明,鼠伤寒沙门氏菌中至少有6个低分子质量外膜蛋白可以引起T细胞免疫反应,说明这些LMW蛋白具有作为反应性关节炎临床诊断标记的潜能[10].又如大肠杆菌体内,分子量为14 ku的CheY蛋白,CheY磷酸化后参与药物趋向感应信号的传递,并最终介导细菌鞭毛趋向运动[11].因此,研究LMW蛋白的表达变化与功能具有重要意义.
LMW蛋白质在细胞中占有较高的比例,但针对其相关的系统研究还很缺乏,特别是对微生物小分子蛋白的分析与鉴定.以大肠杆菌K12为例,在SWISS-PROT蛋白数据库(更新时间截止为2014年6月12号)中去除片段序列以外的“reviewed”蛋白数目为9728个蛋白,其中氨基酸长度在228以下(约25 ku)的蛋白数目为3909个,达到总蛋白数目的40.1%.然而,综合当前已有文献报道鉴定的LWM蛋白数目仅占约25%[12].此外,还有很多大肠杆菌LWM蛋白在数据库中注释是“未知功能蛋白”,说明目前对这类蛋白的功能与性质还不清楚.限制这类蛋白研究的因素可分为以下几种情况:(1)在经典的蛋白质组学研究中,主要以双向电泳作为分离手段,第二向常采用10-12%聚丙烯酰胺凝胶,检测到的蛋白质分子质量多集中在20 ku以上,从而忽略了对LMW蛋白的研究.此外,大部分蛋白分子量集中在约50 ku,丰度较高.相对来讲,LMW蛋白属于较低丰度蛋白,这就导致在双向电泳过程中,LMW蛋白的含量受到高分子质量的蛋白质的限制;(2)高分子质量蛋白质酶解产生的肽段数目比LMW蛋白多,这将在混合多肽的液相质谱鉴定中抑制LMW蛋白的肽段离子化,从而降低数据检索的准确性;(3)此外,由于LMW蛋白的酶解肽段较少,有的只有1-2个肽段,从而对质谱鉴定的匹配计算造成了难度,发现错误率(false discovery rate,FDR)的几率比高分子质量蛋白质高很多[12,13].
基于以上原因,LMW蛋白与亚细胞器和磷酸化蛋白的研究一样,需要进一步分离提取高纯度高覆盖率的LMW蛋白质,以获得更多的蛋白质信息.例如Müller et al[12]运用超滤的方法提取LMW蛋白质,并进行了提取条件和后续质谱检测相关参数的优化,获得了一定成果,但是所提取到的LMW蛋白质的纯度较低.最近,Kawashima et al报道了一种简单、快速并且成本较低的差别溶解(differential solubilization,DS)方法,用于纯化人血清中的LMW蛋白质[14].该方法利用酸性条件下,乙腈沉淀大分子质量的变性蛋白,使高分子质量蛋白质与低分子质量蛋白质分离,获得LMW蛋白质,其效果优于超滤法.但是该方法是否适用于微生物LWM蛋白的提取,尚未见报道.本文利用DS法提取水产养殖业致病细菌[嗜水气单胞菌(Aeromonas hydrophila)]的LMW蛋白,并分析鉴定了LMW蛋白质组分.该方法的建立,将为研究细菌LMW蛋白质的功能提供依据.
1 材料与方法
1.1 菌体的培养与处理
挑取嗜水气单胞菌ATCC7966单克隆菌落,于LB培养基中30℃培养16 h后,以1∶100的比例在100 mL LB培养基中扩大培养(30℃,200 r·min-1).培养至菌液的D600nm=1.0时,离心收集菌体(10000 g,4℃,15 min).用5 mL磷酸盐缓冲液(PBS,pH 7.4)重悬菌体,然后冰浴超声破碎(间隙开6 s,间隙停9 s,输出功率比30%)30 min.破碎液离心(10000 g,4℃,15 min),以去除细胞碎片.上清真空冷冻干燥至体积小于500 μL.然后用双蒸水补总体积至500 μL,得到浓缩后的细菌全蛋白溶液.
1.2 利用DS方法提取细菌LMW蛋白
取15 μL 浓缩后的细菌全蛋白溶液,加入 30 μL DS 缓冲液[7 mol·L-1尿素,2 mol·L-1硫脲,20 mmol·L-1二硫苏糖醇(DTT)],混合均匀,缓慢滴入1350 μL预冷丙酮,充分混合后,4℃孵育1 h.混合液离心(19000 g,4℃,15 min),弃上清,向沉淀中加入体积分数70%乙腈(含12 mmol·L-1HCl),充分重悬后,4℃孵育1 h.对重悬液离心(19000 g,4℃,15 min),吸取上清,真空冷冻干燥至粉末,用适当体积的UST 缓冲液(8 mol·L-1尿素,1 g·L-1SDS,体积分数2%Triton X-100)或200 mmol·L-1三乙基碳酸氢铵(TEAB)溶解,-20 ℃保存[14].
1.3 Tricine-SDS-PAGE分离LMW蛋白
取5 μg LWM蛋白,加入适量上样缓冲液,煮沸5 min后,用分离胶为16%(含6 mol·L-1尿素),积层胶为4%的Trcine-SDS-PAGE分离小分子蛋白,100 V恒压,电泳至考马斯亮蓝前沿到达胶的底部.然后考马斯亮蓝R250染色、脱色、扫描,并根据蛋白条带的光密度值用1D软件做定量分析[15].
1.4 蛋白酶解与质谱鉴定
对于胶内蛋白酶解,切取Tricine-SDS-PAGE胶内4个主条带,切成约1 cm3的胶块,100 μL双蒸水洗2次.50 mmol·L-1NH4HCO3与100%乙腈等体积混合后,取100 μL脱色2次.用100 μL 100%乙腈脱水至胶粒完全变白,真空抽干10 min.加入 30 μL 10 mmol·L-1DTT(25 mmol·L-1NH4HCO3配制),56 ℃水浴 1 h.弃上清,加入 30 μL 55 mmol·L-1碘乙酰胺(IAM,25 mmol·L-1NH4HCO3配制),暗室静置 45 min.弃上清,100 μL 25 mmol·L-1NH4HCO3洗胶粒2 次.25 mmol·L-1NH4HCO3与100%乙腈等体积混合后,取100 μL洗胶粒2次.100 μL 100%乙腈脱水2次至胶粒完全变白,真空抽干10 min.每份胶粒样品加入20 μL 胰蛋白酶酶液(20 ng·μL-1,25 mmol·L-1NH4HCO3配制)静置10 min,待酶液被胶块完全吸收后,再加入 25 μL 25 mmol·L-1NH4HCO3,37 ℃孵育过夜.
对于液相蛋白的酶解,用45 μL 200 mmol·L-1TEAB溶解真空冷冻干燥得到的样品.加入5 μL 200 mmol·L-1TCEP(200 mmol·L-1TEAB 配制)室温孵育 1 h.再加入 5 μL 55 mmol·L-1IAM(200 mmol·L-1TEAB配制),振荡混匀后,暗室静置30 min.加入660 μL预冷丙酮,-20℃静置过夜.8000 g,4℃离心10 min.弃上清,真空抽干10 min,加入100 μL 200 mmol·L-1TEAB 溶解沉淀.再加入1 μg胰蛋白酶,振荡混匀后,37℃孵育过夜.
取10 μL酶解后的样品用LC-LTQ-XL(Thermo Scientific,Waltham,MA,USA)进行质谱分析鉴定.肽段在 BioBasic C18 Column(100 ×0.18 mm,孔径:5 μm)中进行 HPLC 分离,梯度条件为:含0.1%(体积分数)甲酸的5% -35%乙腈(体积分数)梯度20 min,含0.1%甲酸的35% -95%乙腈(体积分数)梯度2 min,流速设定0.16 mL·min-1;LTQ-XL(Thermo Scientific)条件设定喷雾电压 3.5 kV,母离子扫描范围400-2000 m·z-1,CID扫描后选择前10个最高丰度的离子进行PQD扫描,质谱分析所获得的原始数据用Proteome Discoverer 1.2软件进行数据库的检索.设定半胱氨酸烷基化以及甲硫氨酸氧化为固定修饰,搜索使用的数据库为Aeromonas hydrophila蛋白数据库,选取至少有2个肽段匹配的蛋白为可信蛋白,对于液相酶解分析样品,除了2个肽段匹配以外,设置FDR阈值<5%.
1.5 数据处理与分析
根据质谱鉴定的嗜水气单胞菌蛋白的分子质量和等电点,将蛋白分成若干部分与相应的蛋白鉴定数目进行比较,分析LMW蛋白的性质.利用Agbase网站的在线工具GoRetriever和GoSlimViewer,对质谱鉴定的蛋白,在细胞组分、分子功能和生物过程这3个方面进行GO功能分析,取所含GO term>2的功能类别进行进一步分析(http://www.agbase.msstate.edu/)[16].
2 结果与分析
2.1 嗜水气单胞菌LMW蛋白质组学分析
以70%乙腈(体积分数)处理,获得A.hydrophila的LMW蛋白,并进行Tricine-SDS-PAGE胶分离,考马斯亮蓝R250染色,再经脱色处理后,用1D软件分析蛋白条带的丰度(图1).结果显示,在最后一次离心得到的沉淀中(泳道b),其LMW蛋白的含量明显减少,分子质量小于20 ku的蛋白质占总提取蛋白质的31.9%,而A.hydrophila全菌蛋白相应部分占30.5%(泳道c),这2个样品的LMW蛋白质量差异不显著.而在最后1次离心得到的上清中,即用DS方法提取的的LMW蛋白,小于20 ku的部分占总提取蛋白的90.4%,说明DS方法获得了较高纯度的LMW蛋白(泳道a).
为了进一步鉴定这些LWM蛋白中较高丰度的蛋白,对丰度最高的4个条带进行了胶内酶解,质谱鉴定结果显示这些条带都是混合物,其主要成分是30S和50S核糖体的核糖体蛋白,包括 L13、L16、L17、L19、L25、S5、S6、S7、S13、S15、S16、S17、S20,预计分子质量都小于 25 ku(表1).
对LMW蛋白进行Shotgun LC MS/MS质谱鉴定(表2),共鉴定97个蛋白.对这些蛋白的分子质量和等电点分析显示(图2),小于25 ku的蛋白共57个,占总鉴定蛋白数目的58.8%,其中5-10 ku、10-15 ku、15-20 ku和20-25 ku蛋白数目分别为14、17、17和9个.这些蛋白的等电点(pI值)大多集中在pH 4-6,与生物内蛋白pI值的普遍范围一致.在这57个已鉴定的LMW蛋白中,有35个核糖体蛋白,占总数的61.4%,它们在细菌蛋白的合成过程中有重要的生物学作用.此外还有参与DNA与蛋白结合的蛋白,如HupA,StpA、外膜蛋白OmpH、离子通道蛋白PhaF、VI型分泌相关蛋白、各种酶和未知功能蛋白质等,但由于上述蛋白在生理条件下表达量较低,至今为止,鲜有人对其功能进行探讨,值得深入研究.

图1 DS方法提取的低分子质量蛋白与各组分蛋白的分析比较Fig.1 The comparison among different fractions of LMW proteins extracted with DS method from Aeromonas hydrophila

表1 LC/MS MS鉴定Tricine SDS-PAGE分离的低分子质量蛋白4条主条带蛋白成分Table 1 The protein composition of top 4 highest abundant bands of LMW in Tricine SDS-PAGE gel by LC MS/MS

表2LC/MS MS鉴定DS方法提取的LMW蛋白Table 2 The list of LMW proteins with DS extraction by LC MS/MS

续表2
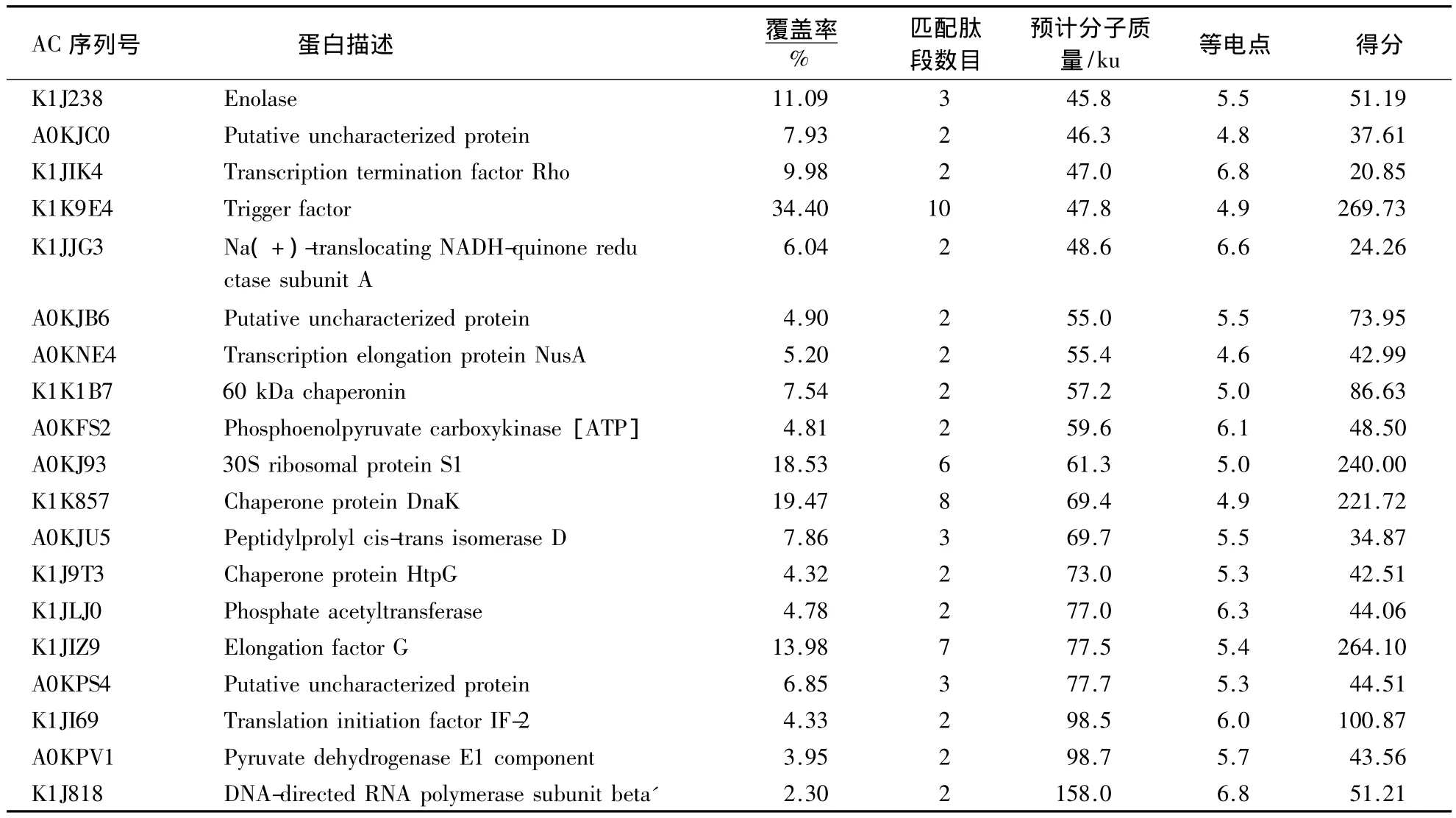
续表2

图2 DS方法提取的LMW蛋白分子质量与等电点Fig.2 The molecular weight and pI characteristics of LMW proteins extracted with DS method
2.2 嗜水气单胞菌LMW蛋白的生物学信息分析
虽然嗜水气单胞菌的全基因组已测序,但目前对它的研究报道较少,在其蛋白质数据库中,大部分蛋白质的功能未得到注释.为更好地研究提取到的LMW蛋白的功能,利用Agbase网站中的在线工具GoRetriever和GoSlimViewer,对经质谱鉴定的蛋白,在细胞组分、分子功能和生物过程这3个方面进行Go功能分析(图3).结果表明:这些蛋白主要涉及细胞内(25%)、细胞(23%)、细胞质(20%)和核糖体(19%)等细胞组分分类[16],核糖体结构组分(22%)、RNA结合功能(18%)、rRNA结合功能(15%)、离子结合功能(10%)等分子功能分类,以及转录(27%)、生物合成(15%)和胞内氮代谢(11%)等生物过程分类.以上结果显示LMW蛋白涉及生命活动中多个重要过程,具有重要的生物学功能.
3 结论与讨论
LMW蛋白在细菌生命活动中有重要的生理功能,但是目前对这类蛋白的研究还较少.本研究利用LMW蛋白质的提取方法,提取嗜水气单胞菌蛋白的LMW蛋白,并通过质谱方法鉴定了这些蛋白的成分与性质.实验证明该方法可获得高纯度的LMW蛋白,具有可操作性和可行性,为进一步研究LMW蛋白的功能和性质提供依据.
嗜水气单胞菌(Aeromonas hydrophila)是一种广泛分布于自然界水体环境的原发性致病菌,为条件致病菌,可感染鱼类、动物和人类,是典型的人—兽—鱼共患病病原菌.每年全世界由于该菌引起的鱼类暴发性流行病造成的经济损失不计其数.随着蛋白质组学的发展,利用蛋白质组学方法研究该菌蛋白功能的报道日益增多[17-19].根据 SWISS-PORT 蛋白数据库中的数据,A.hydrophila ATCC7966 中“unreview”蛋白为3685个,其中LMW蛋白有1315个,占总数的35.7%,但是目前对包括嗜水气单胞菌等病原菌在内的细菌LMW蛋白了解较少.而LMW蛋白在细菌的生命活动具有重要功能,具有深入研究的必要.

图3 嗜水气单胞菌ATCC7966的LMW蛋白GO功能分析Fig.3 GO analysis of LMW proteins of A.hydrophila ATCC7966 by AgBase
目前,对LMW蛋白的提取方法的研究,主要建立在对人血清样品的纯化基础上.这一方面与人血清更关系人类健康有关,另一方面与人血清中含有大量IgG蛋白(约占90%)的问题急待解决有关.要有纳米凝胶法、肽段吸附亲和柱、超滤离心法、色谱、有机溶剂法、圆盘凝胶电泳等分离手段[12,20-24].这些方法各有利弊,都有纯度不纯、样品丢失或者实验步骤繁琐等问题.而现有关于微生物LMW蛋白质的功能研究大多针对特定蛋白,缺乏全面系统地研究LMW蛋白质在微生物生命活动中的作用.
本文利用DS法提取微生物LWM蛋白质,提取到纯度大于90%的LMW蛋白质,减少高分子质量蛋白质的干扰,从而使LMW蛋白组学分析成为可能.这些蛋白主要涉及转录、生物合成和胞内氮代谢等重要生物途径,具有结合RNA、DNA以及离子的功能,并且涵盖了多种酶活性,如氧化还原酶活性、GTP酶活性、激酶活性等在各种生化途径中起重要作用的酶活性.
本文所提取的LMW蛋白质中,包含有35个核糖体蛋白亚基组分.众所周知,核糖体蛋白亚基是核糖体的重要组成部分,与蛋白质的合成紧密相关.然而近年来的研究表明,核糖体蛋白还有许多其它功能.比如,有的核糖体蛋白的表达情况与癌症形成相关[25].Mazumder et al[26]研究表明,哺乳动物核糖体蛋白L13a具有先天免疫功能,其在应对呼吸道合胞体病毒、肺炎病毒中的RNA病毒及一系列肺部致病菌的感染时,可以充当抗病毒剂.除了多核糖体蛋白亚基之外,本研究还鉴定出许多有重要功能的蛋白.以Ⅵ型分泌蛋白为例,研究表明,Ⅵ型蛋白分泌系统广泛存在于革兰氏阴性细菌,与细菌的致病力相关,并且参与细菌与宿主间的相互作用[27].Jiang et al[28]研究表明,铜绿假单胞菌的Ⅵ型蛋白分泌系统可能促进振和生物与细菌间的相互作用.此外,本研究还鉴定出苹果酸脱氢酶、烯醇化酶及丙酮酸脱氢酶E1等能量代谢中的重要酶,这些蛋白质在细胞翻译调控、新陈代谢等方面中都具有重要功能,利用DS方法富集这些蛋白,对更好的研究低丰度LMW蛋白的生物学功能以及微生物标记分子的筛选,都具有广阔的应用前景.
LMW蛋白的研究还存在不足,例如可能因实验步骤增多,导致蛋白质损失、重复性较差等问题,特别是由于LMW蛋白或者多肽产生的酶解肽段较少的问题,还需要质谱分析方法的进一步改进.此外,如果能采用更高分辨率的质谱仪器,将获得更多更准确的数据.
本研究除了鉴定出57个确定为LMW蛋白外,还有40个理论分子质量范围大于25 ku的蛋白.这些较高分子质量蛋白在纯度大于90%的LMW蛋白样品中得到鉴定,一方面由于大分子质量蛋白质容易获得较多酶解肽段,从而易于质谱鉴定,另一方面这些蛋白质很有可能是高分子蛋白质的片段或前体,而以LMW蛋白的形式存在,研究表明,这些蛋白质在某些生理活动和疾病中有重要的生物学功能,例如人体内β淀粉样蛋白在病理条件下降解成aβ42的小肽,引起人脑中淀粉样蛋白沉积,研究表明,aβ42脑脊液Aβ42水平可预测PD患者罹患痴呆的风险[29,30].有些蛋白质是多亚基复合体,在提取过程中经过多次变性后,小分子质量的亚基被分离并被提取得到.此外,本研究中还鉴定到一些只有1个肽段匹配但分子质量小于10 ku的蛋白质,这些蛋白质因酶解肽段数较少,需深入发展数据挖掘方法和质谱技术,以进一步验证.
[1]LIN X M,YANG J N,PENG X X,et al.A novel negative regulation mechanism of bacterial outer membrane proteins in response to antibiotic resistance[J].Journal of Proteome Research,2010,9(11):5952 - 5959.
[2]李伟.iTRAQ多重化学标记串联质谱技术在比较蛋白质组学中的应用[J].生命的化学,2006,26(5):453-456.
[3]TANCA A,BIOSA G,PAGNOZZI D,et al.Comparison of detergent-based sample preparation workflows for LTQ-Orbitrap analysis of the Escherichia coli proteome[J].Proteomics,2013,13(17):2597 -2607.
[4]ASLAM R,LAVENTIE B J,MARBAN C,et al.Activation of neutrophils by the two-component leukotoxin LukE/D from Staphylococcus aureus:proteomic analysis of the secretions[J].Journal of Proteome Research,2013,12(8):3667 -3678.
[5]KUMAR B,SHARMA D,SHARMA P,et al.Proteomic analysis of Mycobacterium tuberculosis isolates resistant to kanamycin and amikacin[J].Journal of Proteomics,2013,94:68 -77.
[6]LECOUTERE E,VERLEYEN P,HAENEN S,et al.A theoretical and experimental proteome map of Pseudomonas aeruginosa PAO1[J].Microbiologyopen,2012,1(2):169 -181.
[7]MUKHOPADHYAY A,KENNELLY P J.A low molecular weight protein tyrosine phosphatase from Synechocystis sp.strain PCC 6803:enzymatic characterization and identification of its potential substrates[J].Journal of Biochemistry,2011,149(5):551-562.
[8]TAN H,WAN S,LIU P-Q,et al.Alr5068,a low-molecular-weight protein tyrosine phosphatase,is involved in formation of the heterocysts polysaccharide layer in the cyanobacterium Anabaena sp.PCC 7120[J].Research in Microbiology,2013,164(8):875-885.
[9]NATH S,BANERJEE R,SEN U,et al.Atomic resolution crystal structure of VcLMWPTP-1 from Vibrio cholerae O395:insights into a novel mode of dimerization in the low molecular weight protein tyrosine phosphatase family[J].Biochem Biophys Res Commun.2014[online].
[10]SINGH R,SHASANY A K,AGGARWAL A,et al.Low molecular weight proteins of outer membrane of Salmonella typhimurium are immunogenic in Salmonella induced reactive arthritis revealed by proteomics[J].Clin Exp Immunol,2007,148(3):486-493.
[11]LUKAT G S,MCCLEARY W R,STOCK A M,et al.Phosphorylation of bacterial response regulator proteins by low molecular weight phospho-donors[J].Proc Natl Acad Sci USA,1992,89(2):718 -722.
[12]MULLER S.A.,KOHAJDA T,FINDEISS S,et al.Optimization of parameters for coverage of low molecular weight proteins[J].Analytical and Bioanalytical Chemistry,2010,398:2867 -2881.
[13]CAPRIOTTI A L,CARUSO G,CAVALIERE C,et al.Comparison of three different enrichment strategies for serum low molecular weight protein identification using shotgun proteomics approach[J].Analytica Chimica Acta,2012,740:58 - 65.
[14]KAWASHIMA Y,FUKUTOMI T,TOMONAGA T,et al.High-yield peptide-extraction method for the discovery of subnanomolar biomarkers from small serum samples[J].Journal of Proteome Research,2010,9(4):1694 -1705.
[15]SCHAGGER H.Tricine-SDS-PAGE[J].Nature Protocols,2006,1(1):16 -22.
[16]FIONA M M,SUSAN M B,NAN W,et al.AgBase:a unified resource for functional analysis in agriculture[J].Nucleic Acids Research,2007,35:599 -603.
[17]YU H B,KAUR R,LIM S,et al.Characterization of extracellular proteins produced by Aeromonas hydrophila AH-1[J].Proteomics,2007,7(3):436 -449.
[18]CHEN Z,PENG B,WANG S,et al.Rapid screening of highly efficient vaccine candidates by immunoproteomics[J].Proteomics,2004,4(10):3203 -3213.
[19]NI X D,WANG N,LIU Y J,et al.Immunoproteomics of extracellular proteins of the Aeromonas hydrophila China vaccine strain J-1 reveal a highly immunoreactive outer membrane protein[J].FEMS immunology and medical microbiology,2010,58(3):363-373.
[20]RAINCZUK A,MEHAN K,STEER D L,et al.An optimized procedure for the capture,fractionation and proteomic analysis of proteins using hydrogel nanoparticles[J].Proteomics,2010,10(2):332 -336.
[21]SENNELS L,SALEK M,LOMAS L,et al.Proteomic analysis of human blood serum using peptide library beads[J].Journal of Proteome Research,2007,6(10):4055 -4062.
[22]MARSHALL J,JANKOWSKI A,FURESZ S,et al.Human serum proteins preseparated by electrophoresis or chromatography followed by tandem mass spectrometry[J].Journal of Proteome Research,2004,3(3):364 -382.
[23]CHWRTOV O,BIRAGYN A,KWAK L W,et al.Organic solvent extraction of proteins and peptides from serum as an effective sample preparation for detection and identification of biomarkers by mass spectrometry[J].Proteomics,2004,4(4):1195-1203.
[24]李铁纯,汪子明,王璐,等.血清中低分子量蛋白质的提取和鉴定[J].高等学校化学学报,2010,31(10):1955-1960.
[25]DE LAS HERAS-RUBIO A,PERUCHO L,PACIUCCI R,et al.Ribosomal proteins as novel players in tumorigenesis[J].Cancer Metasasis Rev,2013,33:115 -141.
[26]MAZUMDER B,PODDAR D,BASU A,et al.Extra-ribosomal L13a is a specific innate immune factor for antiviral defense[J].Journey of Virology,2014,88(16):9100 -9110.
[27]FILLOUX A,HACHANI A,BLEVES B.The bacterial typeⅥ secretion machine:yet another player for protein transport across membranes[J].Microbiology,2008,154(6):1570 -1583.
[28]JIANG F,WATERFIELD NR,YANG J,et al.A Pseudomonas aeruginosa typeⅥ secretion phospholipase D effector targets both prokaryotic and eukaryotic cells[J].Cell Host Microbe,2014,15(5):600 - 610.
[29]RORIGUEZ E,GAGGERO C,LAVINA M.The structural gene for microcin H47 encodes a peptide precursor with antibiotic activity[J].Antimicrobial Agents and Chemotherapy,1999,43(9):2176 -2182.
[30]AlVES G,LANGE J,BlENNOW K,et al.CSF Aβ42 predicts early-onset dementia in Parkinson disease[J].Neurology,2014,82(20):1784 -1790.
