番鸭神经肽S的基因克隆及其对番鸭脾淋巴细胞增殖的影响
2015-12-24杨桂红黄一帆林珊珊祁保民王全溪
杨桂红,黄一帆,林珊珊,祁保民,王全溪
(中西兽医结合与动物保健福建省高校重点实验室/福建农林大学动物科学学院,福建福州350002)
神经肽S(neuropeptide S,NPS)是在2002年通过反向药理学技术发现的一种具有多种生物活性的神经肽,后被鉴定为孤儿受体GPR154(又称GPRA、VRR1)的内源性配体[1],共有20个氨基酸[2].因NPS氨基端的氨基酸残基均为丝氨酸(serine,缩写为S),因此有研究者将其命名为Neuropeptide S(NPS)[3].NPS通过其受体 GPR154(neuropeptide receptor,NPSR)发挥作用[4-5].NPSR 有两种,即 NPSR-A 和 NPSR-B,均属于G蛋白藕联受体(G protein-coupled receptor,GPCR),主要为Gs和Gq蛋白.NPS和NPSR在动物体内的分布及其广泛,二者构成了NPS—NPSR系统[6],参与介导多种生理功能,如唤醒、抑制各期睡眠、抑制摄食、免疫调节和影响神经内分泌活动等[7-13].上述的研究报道仅集中在人、猪、兔和鼠等动物,而关于禽类NPS的基因序列及NPS对禽类的功能作用如何则尚未见报道.番鸭是闽台地区的特色水禽动物,研究NPS对番鸭免疫功能的影响,对闽台地区的水禽养殖业具有重要的指导意义和经济价值.本试验在首次克隆番鸭NPS基因的基础上,进一步研究NPS对番鸭脾淋巴细胞增殖的影响,旨在为深入探讨其对鸭的免疫调节作用以及作为免疫增强剂的开发利用提供一定的理论依据.
1 材料与方法
1.1 材料
1.1.1 试验动物 12-13日龄番鸭购于福建省莆田市克里莫种鸭场.
1.1.2 试剂 Trizol RNA提取试剂盒、Taq酶、dNTP、DNA Marker(DL2000)购自大连 TaKaRa公司;MMLV反转录酶、RNA酶抑制剂购自美国Promega公司;四甲基偶氮唑蓝(MTT)购自Amresco公司,用pH为7.4的PBS缓冲液配成含量为5 mg·mL-1的溶液,经0.22 μm的微孔滤器过滤,避光保存;裂解液、二甲基亚砜(DMSO,分析纯)购自北京索莱宝科技有限公司;琼脂糖购自上海生物工程公司.
RPMI1640培养基购自Gibco公司;番鸭NPS购自康肽生物科技(北京)有限公司,临用前浓度分别配成 0.01、0.1、1、10、100 和1000 nmol·L-1;细菌脂多糖(lipopolysaccharide,LPS)购自 Sigma 公司,临用前含量配成20 ng·mL-1;植物血凝素(phytohemagglutinin,PHA)购自北京化学试剂公司,临用前含量配成80 ng·mL-1;淋巴细胞分离液购自上海恒信化学试剂有限公司;其他试剂均为国产分析纯.
1.1.3 仪器 主要仪器有超净工作台(苏州净化设备有限公司SW-CJ-1F型单人双面净化工作台)、CO2培养箱(美国Revco公司)、Model 680型酶标仪(美国Beckman公司)、XSZ-D2型倒置显微镜(重庆光学仪器厂)、96孔细胞培养板(美国Costar公司)、高压灭菌锅(ZDX-35BI型座式自动电热压力蒸汽灭菌器).
1.2 基因克隆
1.2.1 总RNA的提取 番鸭经正常放血处死,无菌条件下取出脾脏,按Trizol试剂盒说明书进行操作并提取样品组织中的总RNA,同时采用变性琼脂糖凝胶电泳检测RNA电泳条带的清晰度和完整性,各泳道点样孔没有残留,条带清晰,无拖尾现象出现,表明RNA无降解,质量可靠.
1.2.2 RT-PCR扩增 以提取的RNA为模板,按M-MLV反转录试剂盒说明书逆转录合成cDNA.RT反应体系为 25 μL,含 2 μg 总 RNA、2 μL 0.4 pmol·L-1Oligo dT 引物、2 μL 0.4 mmol·L-1dNTP、4 μL DEPC处理水,于70℃变性5 min后立即放冰上冷却,再加入0.2 μL 8 U RNA酶抑制剂、0.5 μL 100 U M-MLV反转录酶、5 μL 5 × RT buffer、9.3 μL DEPC 处理水,于37 ℃反应60 min,95 ℃反应5 min.同时,用不加反转录酶的反转录体系作为阴性对照,用于检测总RNA样品中是否有基因组DNA污染.反转录产物(RT产物)分装后置-20℃保存备用.
1.2.3 克隆引物设计和PCR扩增 参照GenBank中已有的近缘物种NPS基因cDNA序列,分析NPS基因的保守序列,采用Primer Premier 5.0软件设计NPS基因克隆引物,通过对PCR反应条件和循环参数进行优化,建立最佳反应条件.PCR 反应体系为25 μL,含2 μL 模板(RT 产物),2.5 μL 10 ×PCR buffer[含50 mmol·L-1Tris-HCl(pH 9.0)、100 mmol·L-1NaCl、100 mmol·L-1DTT、0.1 mmol·L-1EDTA、50% 甘油、0.3%Triton-X-100],2 μL 2.5 mmol·L-1dNTPs,1.5 μL 镁离子,20 pmol·L-1上、下游引物各 1 μL,1.0 U Taq DNA聚合酶,加灭菌ddH2O补足.反应条件如下.(1)变性:94℃ 5 min;(2)复性:94℃ 30 s,60℃ 30 s,72℃ 30 s,35个循环;(3)延伸:72℃ 10 min.同时用灭菌的ddH2O和RNA样品分别取代RT产物作对照,以检验是否有外源和基因组DNA污染.扩增产物用2%琼脂糖凝胶进行电泳.用DNA片段胶回收试剂盒回收特异性条带.
1.2.4 克隆和序列测定 将回收产物连接到pMD-18T载体上,然后将连接产物转化到大肠杆菌DH5α感受态细胞中,蓝白斑筛选阳性克隆,最后用菌液PCR鉴定.挑选阳性克隆的菌液送交测序,序列测定由上海英骏公司完成.
1.2.5 序列分析 运用DNA Star和Clustalx软件将克隆所得序列与GenBank上已发表的NPS基因序列进行比对和分析.通过国家生物技术信息中心BLASP(http://www.ncbi.nlm.nih.gov/blasp)氨基酸序列分析NPS和其他物种的同源性.用综合指数的最大似然法计算进化距离和每个位点碱基替换的数量和单位,采用CLUSTAL W算法,用MEGA 4.0软件中的邻接法推断进化树.
1.3 番鸭脾脏的采集及其淋巴细胞的分离
番鸭经正常放血处死,无菌条件下取出脾脏,用PBS或无菌生理盐水冲洗3次,剪去被膜.置脾脏于研磨器中轻轻研碎,加40-60 mL Hanks液,用吸管反复吹打研碎组织,经200目筛网过滤,收集滤液,加入淋巴细胞分离液,于2000 r·min-1离心20 min,吸取中间云雾状的白细胞层,用Hanks液洗2次,用RPMI 1640营养液稀释成1×107个·mL-1的细胞悬液.台盼兰染色测定活细胞率大于95%,备用.
1.4 NPS对细胞增殖影响的测定
采用MTT法[14]测定NPS对番鸭脾淋巴细胞增殖的影响.分离培养的脾淋巴细胞分别经过20 ng·mL-1LPS 或 80 ng·mL-1PHA 的预处理后,再分别加入0.01、0.1、1、10、100 和 1000 nmol·L-1NPS 共同孵育,同时设置20 ng·mL-1LPS、80 ng·mL-1PHA、各浓度NPS和空白对照等作为对照组.试验设计如表1所示,每个组别重复6孔.加样后将96孔培养板置于37℃、饱和湿度、5%CO2的培养箱中培养24 h.终止培养前4 h置于超净工作台上,每孔加入20 μL MTT继续培养4 h后取出.各孔吸弃上清液,加入100 μL裂解液,室温放置20 min,用酶标仪检测波长570 nm处的光密度(D),作为脾淋巴细胞增殖的指标.

表1 NPS、PHA和LPS在脾淋巴细胞体外增殖试验的用量Table 1 The design of NPS and PHA/LPS used in proliferation experiment in vitro
1.5 数据分析
数据采用SPSS 16.0软件处理,结果采用多重比较、F-检验分析.
2 结果与分析
2.1 番鸭NPS基因的克隆
基因测序结果表明:本试验所克隆的番鸭NPS基因为181 bp的目的片段(图1);核苷酸的同源性分析显示,番鸭NPS基因与人、小鼠、大鼠、猪和兔等物种NPS基因的同源性分别为 74.6%、72.9%、74%、77.3% 和76.8%.番鸭NPS基因包含177个核苷酸的开放阅读框(ORF),编码59个氨基酸残基(图2),并在N末端包含7个氨基酸残基(SFRNGVG)(图3A),总分子质量为6.57981 ku.系统发育分析表明,番鸭NPS氨基酸序列与其他已知物种NPS氨基酸序列的同源性都很高,氨基酸的差异很小,尤其与鸡的同源性最高,仅在N末端出现一个氨基酸的差异(图3B).
2.2 NPS对脾淋巴细胞增殖的影响
2.2.1 NPS单独处理对脾淋巴细胞增殖的影响 图4(A)显示,与对照组相比,0.01-1000 nmol·L-1NPS可促进番鸭脾淋巴细胞在体外的增殖.其中,1、100和1000 nmol·L-1NPS显著促进脾淋巴细胞增殖(P<0.05);10 nmol·L-1NPS极显著促进脾淋巴细胞增殖(P <0.01);而 0.01 和0.1 nmol·L-1NPS 对脾淋巴细胞的增殖效果不显著(P >0.05).有趣的是,只有10 nmol·L-1NPS对脾淋巴细胞增殖有极显著作用,但当其浓度上升到100或1000 nmol·L-1时,NPS对脾淋巴细胞的增殖效果逐渐降低.

图1 番鸭NPS基因的RT-PCR结果Fig.1 RT-PCR results of moscovy duck NPS gene

图2 番鸭NPS前体基因的核苷酸序列及其推导的氨基酸序列Fig.2 The nucleotide sequence and the deduced amino acid residues of moscovy duck pre-NPS mRNA

图3 番鸭NPS序列的比较Fig.3 Sequence comparison and analysis of moscovy NPS

图4 不同浓度NPS对经LPS或PHA预处理的番鸭脾淋巴细胞增殖的影响Fig.4 Effect of NPS treatment on proliferation of moscovy duck splenic lymphocytes
2.2.2 NPS对经LPS预处理的脾淋巴细胞增殖的影响 图4(B)显示,所有NPS+LPS组的D570nm明显高于NPS组.NPS对经LPS预处理的番鸭脾淋巴细胞的增殖能力随着NPS浓度的增加而增强,但当NPS浓度升高到100 -1000 nmol·L-1时,这种增强的趋势急剧下降;当NPS 浓度为0.1 -10 nmol·L-1时,NPS+LPS组的D570nm极显著高于LPS组(P<0.01).当NPS浓度为10 nmol·L-1时,NPS对经 LPS预处理的脾淋巴细胞的增殖能力最强;然而,当NPS浓度为0.1 nmol·L-1时,NPS+LPS组的D570nm与LPS组的差异不显著(P>0.05);当NPS浓度为0.01 nmol·L-1时,NPS+LPS组对脾淋巴细胞的增殖能力极显著低于LPS 组(P <0.01).
2.2.3 NPS对经PHA预处理的脾淋巴细胞增殖的影响 图4(C)显示,所有NPS+PHA组的D570nm明显高于NPS组(P<0.05).当NPS浓度为100和1000 nmol·L-1时,NPS+PHA组的D570nm极显著低于PHA组(P<0.01);当NPS浓度为1 nmol·L-1时,NPS对经PHA预处理的番鸭脾淋巴细胞的增殖能力最强;当NPS浓度为0.1和10 nmol·L-1时,NPS+PHA组对脾淋巴细胞的增殖能力与PHA组的差异不显著(P>0.05).
2.2.4 NPS与LPS或PHA协同作用对番鸭脾淋巴细胞增殖的影响 图5显示,所有NPS+LPS组的D570nm及NPS+PHA组的D570nm均明显高于同一浓度下NPS组.表明0.01-1000 nmol·L-1NPS与LPS或PHA对番鸭脾淋巴细胞的增殖均具有协同作用.
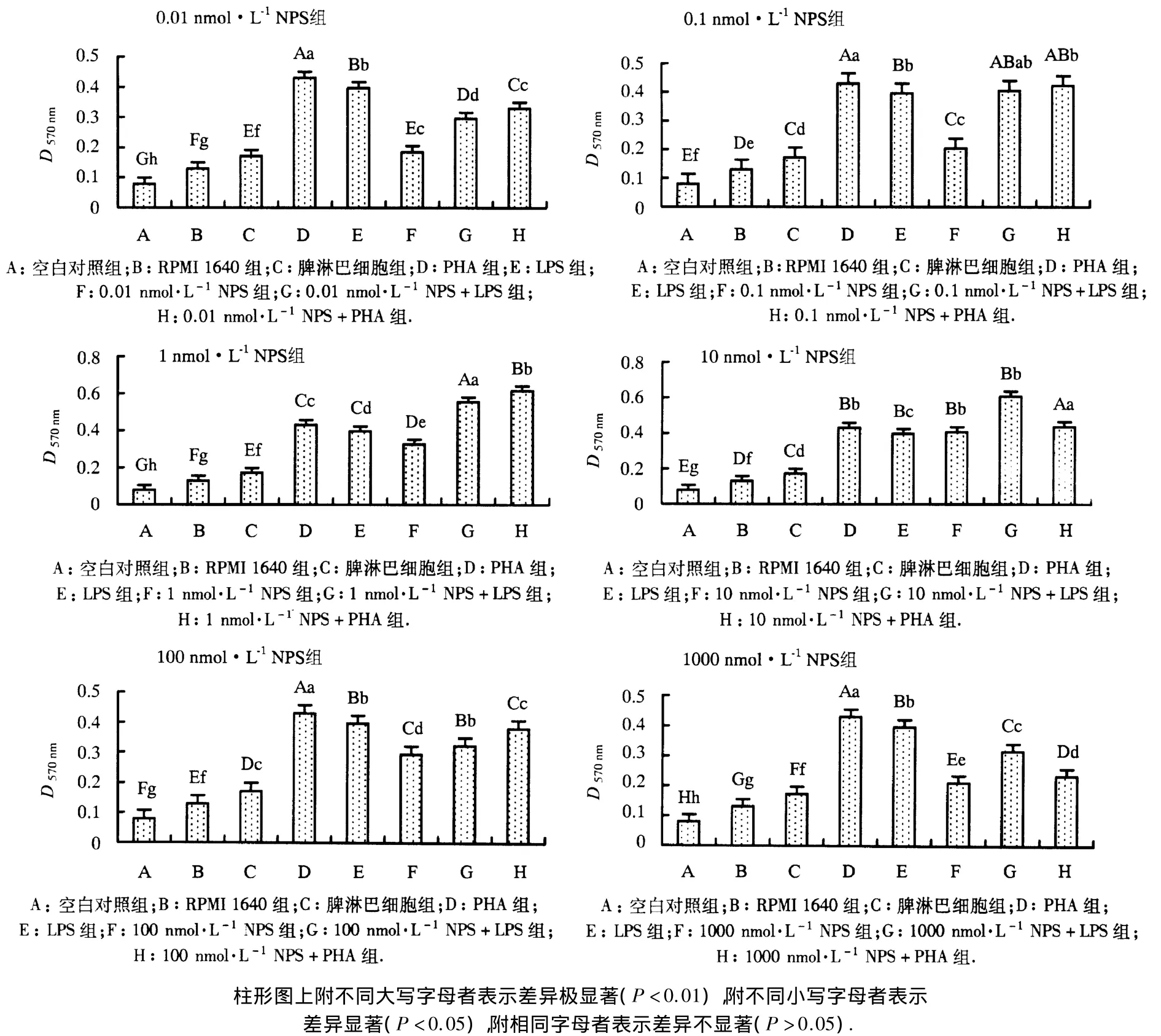
图5 不同浓度的NPS与LPS或PHA协同作用对番鸭脾淋巴细胞增殖的影响Fig.5 Effects of different dose of NPS and its cooperation with LPS and PHA on proliferation of moscovy duck splenic lymphocytes
3 讨论
研究表明,NPS在动物免疫器官中的分布及其介导参与调节免疫细胞的功能为NPS可参与动物机体的免疫调节作用提供了有利的证据.然而,上述的研究对象都侧重于人和猪[15].关于NPS是否参与禽类的免疫调节作用仍然不清楚.因此,本试验首先克隆了番鸭的NPS基因,并通过体外试验初步探讨NPS对番鸭脾淋巴细胞增殖的效果,为深入探讨NPS参与禽类免疫功能方面的调节提供了初步依据.
关于NPS氨基酸序列结构和活性的研究表明,所有物种NPS的前体基因似乎是相同的,只有少数位于肽中心、羧基末端和N末端部分显示序列变异,尤其Phe2-ARG3-Asn4是受体结合和生物活性至关重要的位点[16-18].本试验结果表明,番鸭NPS氨基酸序列与已知物种NPS氨基酸序列具有高度的保守性,而且其氨基酸序列也包含了在其他物种NPS中同样保守的7个氨基酸残基(SFRNGVG).番鸭NPS同样具有完全保守的7个氨基酸残基进一步反映了其为结合受体所必需的活性结构[2].番鸭NPS高度保守性的结构特点丰富了原先仅四足脊椎动物NPS保守性的特点.因此,确定番鸭NPS的氨基酸序列,为研究其生物学功能提供了依据.
NPS广泛分布于猪体内[15],关于NPS在番鸭体内的分布尚未见报道.本实验室成员在研究中发现,NPS阳性细胞在鸭脾脏和法氏囊均有分布,这为其参与禽类的免疫调节提供了形态学基础.特别是NPS的阳性细胞主要位于番鸭脾脏的浅层皮质区,表明NPS可对脾淋巴细胞发挥直接作用.Yao et al[19]对人源 NPS 调节猪脾淋巴细胞增殖能力的研究表明,1 nmol·L-1NPS、0.01 nmol·L-1NPS+LPS 和 1 nmol·L-1NPS+PHA均能促进猪脾淋巴细胞的增殖;而本试验结果表明,10 nmol·L-1NPS、10 nmol·L-1NPS+LPS、1 nmol·L-1NPS+PHA均可显著促进番鸭脾淋巴细胞的增殖.本试验结果与Yao et al[19]的研究结果相比,在增殖效应上相似,但存在着与NPS工作浓度有关的差异.导致这种差异的原因可能有以下几个方面:首先,所使用的肽源及试验动物之间的种属差异不同,本试验中,番鸭NPS与试验动物番鸭之间的亲缘性大于Yao et al[19]采用的人源NPS与试验动物猪的亲缘性;其次,分离自不同物种的脾淋巴细胞可能会导致不同的细胞增殖能力;第三,在动物个体不同的生长阶段分离培养的脾淋巴细胞的生长特性也是不同的.然而,应该指出的是,统计学上的效果显著是神经肽在纳摩尔范围内引起的,这是根据NPS在体外的大部分研究得出的[6].总之,虽然体外试验的结果不能完全反映体内的情况,但本试验的结果至少表明NPS可能参与番鸭体内的免疫调节反应,为其参与免疫功能方面的调节提供了分子生物学和免疫学方面的依据.
本试验所克隆的番鸭NPS核苷酸序列和氨基酸序列与已知亲缘物种NPS的相应序列之间存在极高的同源性,尤其与鸡的亲缘关系最近.0.01-1000 nmol·L-1NPS均能促进番鸭脾淋巴细胞的体外增殖,其中以10 nmol·L-1NPS的增殖效果最好;10 nmol·L-1NPS协同LPS及1 nmol·L-1NPS协同PHA对番鸭脾淋巴细胞的增殖效果分别高于各自的对照组.
[1]LAITINEN T,POLVI A,RYDMAN P,et al.Characterization of a common susceptibility locus for asthma-related traits[J].Science,2004,304:300 -304.
[2]REINSCHEID R K.Phylogenetic appearance of neuropeptide S precursor proteins in tetrapods[J].Peptides,2007,28:830 -837.
[3]XU Y L,REINSCHEID R K,HUITRON-RESENDIZ S,et al.Neuropeptide S:a neuropeptide promoting arousal and anxiolytic-like effects[J].Neuron,2004,43(4):487 -497.
[4]BERNIER V,STOCCO R,MOGUSKY M J,et al.Structure-function relationships in the neuropeptide S receptor:molecular consequences of the asthma-associated mutation N107I[J].The Journal of Biological Chemistry,2006,281(34):24704 -24712.
[5]ROTH A L,MARAZOLAA E,RIZZI A,et al.Structure-activity studies on neuropeptide S:identification of the amino acid residues crucial for receptor activation.[J]The Journal of Biology Chemistry,2006,281(30):20809 -20816.
[6]REINSCHEID R K,XU Y L,CIVELLI O.Neuropeptide S:a new player in the modulation of arousal and anxiety[J].Mol Interv,2005,5(1):42 -46.
[7]雷治海,姚远,李月,等.神经肽 S的研究进展[J].畜牧与兽医,2008,40(5):97 -100.
[8]常民,彭雅丽,李威,等.神经肽S的功能与构效关系研究进展[J].生物物理学报,2009,25(3):175-182.
[9]KOOB G F,GREENWELL T N.Neuropeptide S:a novel activating anxiolytic[J].Neuron,2004,43(4):441 -442.
[10]REINSCHEID R K,XU Y L.Neuropeptide S as a novel arousal promoting peptide transmitter[J].FEBS J,2005,272(22):5689-5693.
[11]REINSCHEID R K.Neuropeptide S:anatomy,pharmacology,genetics and physiological functions[J].Results and Problems in Cell Differentiation,2008,46:145 -158.
[12]REINSCHEID R K,XU Y L.Neuropeptide S and its receptor:a newly deorphanized G protein-coup led receptor system[J].Neuroscientist,2005,11(6):532 -538.
[13]OKAMURA N,REINSCHEID R K.Neuropeptide S:a novel modulator of stress and arousal[J].Stress,2007,10(3):221-226.
[14]何玉琴,杨小燕,林淑慧,等.鸡脾脏T淋巴细胞增殖试验优化条件的筛选[J].动物医学进展,2008,29(7):47-49.
[15]林小琴,姚远,雷治海,等.神经肽S及其受体在猪免疫器官中的表达及分布[J].畜牧与兽医,2010,42(8):57-62.
[16]CAMARDA V,TRAPELLA C,CALO G,et al.Synthesis and biological activity of human neuropeptide S analogues modified in position 2[J].J Med Chem,2008,51(3):655-658.
[17]CAMARDA V,TRAPELLA C,CALO G,et al.Structure-activity study at positions 3 and 4 of human neuropeptide S[J].Bioorg Med Chem,2008,16(19):8841 -8845.
[18]CAMARDA V,RIAZZI A,RUZZA C,et al.In vitro and in vivo pharmacological characterization of the neuropeptide S receptor antagonist[D-Cys(tBu)5]NPS[J].J Pharmacol Exp Ther,2009,328(2):549 -555.
[19]YAO Y,SU J,YANG G H,et al.Effects of neuropeptide S on the proliferation of splenic lymphocytes,phagocytosis,and proinflammatory cytokine production of pulmonary alveolar macrophages in the pig[J].Peptides,2011,32(1):118 -124.
