成肌细胞治疗DMD模型-mdx鼠体内骨骼肌细胞dystrophin/utrophin蛋白的表达
2015-12-21王银龙单铁英潘秀兰河北工程大学附属医院邯郸056002
王银龙 单铁英 潘秀兰河北工程大学附属医院 邯郸 056002
成肌细胞治疗DMD模型-mdx鼠体内骨骼肌细胞dystrophin/utrophin蛋白的表达
王银龙 单铁英 潘秀兰
河北工程大学附属医院 邯郸 056002
目的 研究成肌细胞移植入放疗的mdx鼠后dystrophin/utrophin的表达变化。方法 培养大鼠L6骨骼肌成肌细胞株(L6SkM),进行肌内注射于Duchenne型模型鼠-mdx鼠。移植后1个月、2个月、3个月分别取实验鼠的四肢骨骼肌,运用免疫荧光法、Western blot检测dystrophin及utrophin的表达情况。另分别取5只正常C57BL/6鼠和mdx鼠作阳性和阴性对照。结果 成肌细胞移植后1、2和3个月后mdx鼠的dystrophin表达随移植时间延长增多,而utrophin的表达随移植时间延长下降。结论 成肌细胞移植后dystrophin表达对utrophin有一定的抑制作用,两者存在互补关系。
成肌细胞;mdx鼠;细胞移植;抗肌萎缩蛋白;utrophin
成肌细胞移植(myoblast transfer thearpy,MTT)是用外源性正常的成肌细胞注射到宿主的肌细胞中,使之互相接触,按肌纤维细胞正常发育的成熟程序而相互融合成异核、多核的肌纤维细胞,从而诱导形成新的、健康的dystrophin阳性的肌纤维。Duchenne型肌营养不良症是一种X-性连锁隐性遗传病,在男性活婴中的发病率为1/3 500,居神经遗传病之首[1],一般3~5岁起病,常于20~30岁死于呼吸和(或)循环衰竭。病因主要由于X染色体短臂2区1带(Xp21)基因突变导致细胞膜骨架蛋白-抗肌萎缩蛋白(dystrophin)缺乏所致,病程进展快,预后差,目前临床尚无有效治疗方法[2]。
组织发生学表明,成肌细胞是骨骼肌前体细胞,来源于中胚层干细胞,随着胚胎的发育,成肌细胞分裂、融合到肌管而形成多核的骨骼肌纤维细胞[3-4]。研究发现,DMD模型mdx鼠由于抗肌萎缩蛋白的同源蛋白utrophin表达上调,可部分补偿抗肌萎缩蛋白功能使其肌肉萎缩的症状较轻[5],干细胞移植后证实来自供体的干细胞可在受体mdx鼠体内表达抗肌萎缩蛋白,但移植后utrophin表达情况较少见报道。本研究将L6骨骼肌成肌细胞(L6SKM)移植入放疗的mdx鼠检测dystrophin及utrophin的表达变化,以评价干细胞移植的治疗效果。
1 材料和方法
1.1 实验材料 大鼠L6骨骼肌成肌细胞株(L6SkM)(上海中华细胞库);PBS和DMEM培养基(Gibco公司),胎牛血清(杭州四季青生物制品公司)。山羊正常封闭血清、兔正常封闭血清(福州迈新生物技术开发公司);兔抗dystrophin多克隆抗体及兔抗utrophin多克隆抗体(Santa-Cruz公司);山羊抗兔IgG二抗(Santa-Cruz公司)。
1.2 实验动物及分组 受体鼠为龄鼠8~10周mdx鼠10只,购于美国Jackson实验室,体质量16~20g,雌雄不限,平均分为5组,设为未移植组和L6SKM细胞移植1、2和3个月组,另取5只正常C57BL/6鼠作阳性和阴性对照
1.3 L6SkM的培养 复苏的L6SkM接种在75cm2培养瓶,加DMEM培养基(含10%新生牛血清,青霉素100U/mL,链霉素100U/mL)置5%CO2、饱和湿度、37℃培养箱培养,每24h换液,为保持其理想未分化状态,当细胞达到60%~70%汇合时,即进行传代。取3~5代生长状态良好的细胞用于以下实验。
1.4 成肌细胞的肌内注射 mdx鼠和C57BL/6鼠,于注射前1周轻微挤压双下肢肌肉,注射前1d,用环孢素A 50 mg·kg-1·d-1皮下注射抗排斥反应,直至实验取材。注射前用戊巴比妥30mg/kg腹腔内注射轻度麻醉动物,剪开下肢皮肤,用30号微量注射针(直径30μm)沿45°斜角,相隔约1 mm,3个点将成肌细胞注射于胫骨前肌和腓肠肌。每只鼠的对侧下肢用DMEM培养基注射做对照。mdx鼠分成2组(1个月、2个月龄鼠各6只),成肌细胞注射剂量为50×104μL;C57BL/6鼠分2组(鼠龄分组与mdx鼠相同),成肌细胞注射剂量同mdx鼠。C57BL/6鼠于细胞移植后1~10d取骨骼肌观测注射细胞分布情况,mdx鼠于移植后2周~3个月取肌内组织检测各项指标。
1.5 冰冻切片制备及免疫荧光检测dystrophin及utrophin的表达 冰冻切片制备:取各组新鲜鼠的腓肠肌标本放于液氮预冷的异戊烷中速冻3~5s,然后放入-25℃恒冷切片机中行横断面冰冻切片,-70℃保存。
免疫荧光检测:空气风干15min,PBS水化5min共3次,3%H2O2封闭10min,即用型山羊血清封闭30min,1:200抗dystrophin和utrophin抗体4℃孵育过夜,1∶200山羊抗兔FITC-IgG孵育1h,碘化匹啶(propidine iodide,PI)反染。运用激光共聚焦显微镜照像,并用全自动图像分析系统(Alpha,美国)进行图像分析,得出抗肌萎缩蛋白阳性纤维数。
1.6 Western blotting 检测dystrophin及utrophin的表达取C57BL/6鼠、对照组mdx鼠及移植后各个时间点mdx鼠腓肠肌,组织裂解液裂解组织提取蛋白,变性后调整蛋白浓度20μg/μL,上样10μL进行4%~7%梯度SDS-PAGE凝胶电泳,500mA恒流转膜12~15h至PVDF膜,5%脱脂奶粉封闭1h;抗兔多克隆dystrophin抗体或抗山羊多克隆utrophin抗体(均以1∶600稀释)室温孵育1h,HRP标记的羊抗兔IgG或兔抗羊IgG(均为1∶1 000稀释)室温孵育1 h,化学发光剂显色。另外制备12%分离胶做GAPDH的Western blot作为内参对照,均以预染Marker作为分子量对照。结果用紫外线透射凝胶图像扫描仪进行图像分析。
1.7 统计学分析 采用SPSS 14.0软件进行处理,计量资料以均数±标准差(¯x±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 免疫荧光法检测L6SKM细胞移植后mdx鼠dystrophin的表达变化 抗肌萎缩蛋白抗体染色显示,对照C57BL/6鼠肌膜呈明显完整的网状绿色荧光,PI反染示细胞核居边;mdx鼠肌膜未见绿色荧光,大部分细胞核中移,部分居边。经成肌细胞L6SkM移植后2周的mdx鼠骨骼肌细胞膜无荧光显示。而在移植后1月骨骼肌细胞膜开始出现少量抗肌萎缩蛋白表达,大约占细胞总数的10%,随时间延长表达逐渐增多,2个月时阳性细胞数分别占细胞总数的18%,多呈簇状分布;3个月时进一步增多,约为35%,经成肌细胞L6SkM移植后mdx鼠骨骼肌细胞在形态学上细胞大小不一,且萎缩细胞与肥大细胞镶嵌存在,PI反染后见细胞移植后部分细胞核边移。
2.2 免疫荧光法检测L6SKM细胞移植后mdx鼠utrophin表达变化 正常C57BL/6鼠utrophin主要分布于神经肌肉接头处,表达量较少,mdx鼠utrophin主要分布于肌膜下,与dystrophin的分布基本一致,在一些横截面积较小的新生及纤维中表达尤为增强;但在实验中发现仍有少数体积较大的细胞肌膜未着色,胞浆匀染,较utrophin表达量高者着色深。经成肌细胞L6SkM移植移植后1个月、2个月和3个月,utrophin的表达量有随时间的延长呈逐渐减少趋势,可见utrophin在神经肌肉接头处的表达。见表1。

表1 免疫荧光法检测L6SKM细胞移植后mdx鼠dystrophin和utrophin表达变化(¯x±s)
2.3 Dystrophin的Western blotting表达 正常对照组C57BL/6鼠及mdx鼠的蛋白表达分别为强阳性及阴性,经L6SkM移植后1个月、2个月和3个月可见Dystrophin的表达呈逐渐增加趋势,与免疫荧光结果基本一致。见图1。
2.4 Utrophin的Western blotting表达 C57BL/6鼠Utrophin的表达量较少,mdx鼠表达量较C57BL/6鼠显著增多,经L6SkM移植后1、2和3个月可见utrophin的表达呈逐渐减少趋势,与免疫荧光结果基本一致。见图2。

图1 Western blotting检测L6SkM移植后Dystrophin表达1:C57BL/6鼠;2:mdx鼠;3~5:经L6SkM移植后1月、2月和3月mdx鼠
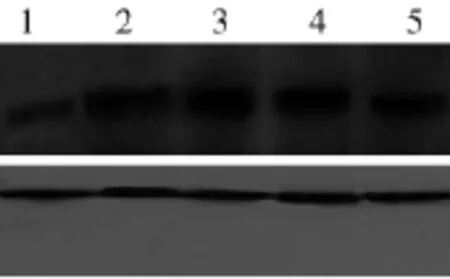
图2 Western blotting检测L6SkM移植后Utrophin的表达1C57BL/6鼠;2mdx鼠;3~5经L6SkM移植后1个月、2个月和3个月mdx鼠
3 讨论
成肌细胞属于一种干细胞,具有分裂增殖的潜能,成肌细胞可以相互融合,形成终末分化的肌纤维,一般认为其在肌原细胞谱系中处于分化进程中的倒数第2位。骨骼肌的组织发生学表明,成肌细胞(又名生肌细胞,包括胚胎中的成肌细胞和成熟肌组中的卫星细胞均为肌肉前体细胞)来源于中胚层干细胞,随着胚胎的发育,肌母细胞分裂、融合而形成多核的骨骼肌纤维细胞。在肌管阶段,有单个核细胞附着其表面,分化为卫星细胞。成熟后卫星细胞一般是静止的,当肌肉受损或受其他刺激时,肌卫星细胞变为成肌细胞,进行分裂并分化为肌细胞,填补其受损部位。
本实验用成肌细胞L6SkM给予mdx鼠进行移植后2周,mdx鼠注射肢的骨骼肌细胞未检测到有抗肌萎缩蛋白表达,而在移植后1个月、2个月、3个月表达抗肌萎缩蛋白的肌纤维百分比分别为10.86%,18.45%和35.68%,说明移植后的成肌细胞转化为宿主的骨骼肌细胞有一个时间过程,在转化肌纤维表达抗肌萎缩蛋白可能需要2周以上的时间,2周以后随时间增加表达的抗肌萎缩蛋白量增高,并能稳定地表达3个月以上。众多学者研究抗肌萎缩蛋白表达的持续时间不一,以Law等报道的持续时间最长,1例DMD患儿细胞移植后抗肌萎缩蛋白持续达6a,认为抗肌萎缩蛋白的表达与成肌细胞的纯度、注射时的操作方法以及注射的剂量均有一定关系[6-7]。Horsley等[8]报道,通过新的信号途径—钙调节转录因子(calcium-regulated transcription factor)能够调控成肌细胞与宿主细胞的融合,这一发现可能会给成肌细胞的移植研究带来新的机遇。Smythe[9]发现,在MyoD裸鼠,外源的成肌细胞在移植后3个月内迁移能力呈线性增加,而在对照的Balb/c鼠,移植后1周便停止迁移,表明MyoD缺乏能够促进外源成肌细胞与宿主的融合。
Radojevic等[10]还发现,分离正常人和猫的成肌细胞,然后分别与抗肌萎缩蛋白缺陷患者与猫的成肌细胞在一起培养,结果二者相互融合形成了杂交的肌管(hybrid myotube),这些杂交的肌管表达正常的抗肌萎缩蛋白、utrophin蛋白和抗肌萎缩蛋白关联蛋白(dystrophin associated protein,DAP),说明正常的抗肌萎缩蛋白基因能够恢复成肌细胞基因的正常表达。
utrophin与dystrophin在氨基酸序列上有很大同源性,分布于全身各个组织,其中以神经肌肉接头处最多[11],二者共同协同调控维持肌肉发育过程中肌肉正常的功能[12]。在DMD患者和mdx鼠utrophin表达上调可缓解因dystrophin缺失造成的伤害[13],推测可能与胚胎时期肌肉发育过程相关,utrophin和dystrophin竞争性争夺DAP结合位点。本研究结果显示mdx鼠的utrophin在肌膜上的表达明显多于C57BL/6鼠,说明在mdx鼠的骨骼肌中确存在utrophin表达上调,且与dystrophin的表达水平基本相反,与前述文献报道的结果一致[11]。成肌细胞L6SkM移植后1月和2月时utrophin的表达有下降趋势但不明显,可能由于虽dystrophin的表达持续增加,但不足以弥补mdx鼠的骨骼肌持续进行性变性坏死所致的utrophin表达量上调;3月时utrophin的表达有明显下降。
成肌细胞移植肌内注射的研究说明,移植后的外源性成肌细胞可以参与宿主的骨骼肌细胞的再生,与宿主细胞融合较长时间地表达抗肌萎缩蛋白,移植的成肌细胞达到一定的数量就可表达抗肌萎缩蛋白,是否能够改善mdx鼠运动功能,还需进一步的研究。但本实验所观察到的结果至少说明这种移植方法可行。但在DMD患者中应用仍然面临很多需要解决的问题,如安全的成肌细胞获取方式,安全有效的抗免疫移植剂的使用,更加优化的能够改善膈肌、呼吸肌功能的细胞移植途径与方法,移植细胞与宿主细胞长时、有效地融合并能够改善患者的运动功能、延长寿命等。
[1]Strober JB.Therapeutics in Duchenne muscular dystrophy[J].Neurol Res,2006,3(2):225-234.
[2]Lorenzon P,Bernareggi A,Degasperi V,et al.Properties of primary mouse myoblasts expanded in culture[J].Exp Cell Res,2002,278(1):84-91.
[3]Montarras D,Morgan J,Collins C,et al.Direct isolation of satellite cells for skeletal muscle regeneration[J].Science,2005,309(5 743):2 064-2 067.
[4]Ustanina S,Carvajal J,Rigby P,et al.The myogenic factor Myf5supports efficient skeletal muscle regeneration by enabling transient myoblast amplification[J].Stem Cells,2007,25(8):2 006-2 016.
[5]Deol JR,Danialou G,Larochelle N,et al.Successful compensation for dystrophin deficiency by a helper-dependent adenovirus expressing full-length utrophin[J].Mol Ther,2007,11(5):2 015-2 018.
[6]Partridge T.Myoblast transplantation[J].Neuromuscul Disord,2002,12(Suppl)1:S3-6.
[7]Law PK,Goodwin TG,Fang Q.First human myoblast transfer therapy continues to show dystrophin after 6years[J].Cell Transplant,1997,6(11):95-100.
[8]Horsley V,Pavlath GK.Forming a multinucleated cell:molecules that regulate myoblast fusion[J].Cells Tissues Organs,2004,176(1/3):67-78.
[9]Smythe GM,Grounds MD.Absence of MyoD increases donor myoblast migration into host muscle[J].Exp Cell Res,2001,267(2):267-274.
[10]Radojevic V,Oppliger C,Gaschen F,et al.Restoration of dystrophin expression in cultured hybrid myotubes[J].Neuropathol Appl Neurobiol,2002,28(5):397-409.
[11]Jasmin BJ,Angus LM,Bélanger G,et al.Multiple regulatory events controlling the expression and localization of utrophin in skeletal muscle fibers:insights into a therapeutic strategy for Duchenne muscular dystrophy[J].J Physiol Paris,2002,96(1/2):31-42.
[12]Roma J,Munell F,Fargas A.Evolution of pathological changes in the gastrocnemius of the mdx mice correlate with utrophin and beta-dystroglycan expression[J].Acta Neuropathol(Berl),2004,108(5):443-452.
[13]Cerletti M,Negri T,Cozzi F,et al.Dystrophin phenotype of canine X-linked muscular dystrophin is mitigated by adenovirus-mediated utrophin gene transferr[J].Gene Ther,2003,10(9):750-757.
(收稿2014-03-14修回2014-10-07)
Effects of skeletal muscle myoblast transplantation on the dystrophin and utrophin expression in mdx rats after radiotherapy
Wang Yinlong,Shan Tieying,Pan Xiulan
The Affiliated Hospital of Hebei Engineering University,Handan056002,China
Objective To investigate the effects of skeletal muscle myoblast transplantation on the dystrophin and utrophin expression in mdx rats after radiotherapy.Methods The skeletal muscle myoblast was transplanted into mdx mice by intramuscular injection.The dystrophin and utrophin expression of limb skeletal muscle of laboratory mice were detected with immunofluorescence assay and Western blotting at 1,2and 3months after transplantation.Results The dystrophin expression level was gradually increasing but the utrophin expression level was gradually decreasing with the time extension of implantationat 1,2and 3months after transplantation.Conclusion Skeletal muscle myoblast transplantation can up-regulate the dystrophin expression level and down-regulate the utrophin expression level.
Myoblast;mdx mice;Cell transplantation;Dystrophin;Utrophin
R-332
A
1673-5110(2015)04-0004-03
