不同处理水稻秸秆对体外瘤胃发酵模式、甲烷产量和微生物区系的影响
2015-12-20辛杭书刘凯玉张永根王明君李仲玉王志博潘春方李欣新刘可园
辛杭书 刘凯玉 张永根 王明君 李仲玉 王志博 潘春方 李欣新 刘可园
(东北农业大学动物科学与技术学院,哈尔滨 150030)
甲烷是除二氧化碳(CO2)以外最主要的温室气体之一。据政府间气候变化专门委员会(IPCC)统计,畜牧业排出的温室气体占8% ~10.8%,尤其是反刍动物养殖产业[1]。而在各种温室气体中,甲烷的温室效应潜势远大于CO2,但由于其存在时间低于CO2,可以作为优先减排对象[2]。研究表明,通过改良饲粮组分可以有效降低反刍动物温室气体的排放量,进而减缓环境恶化的趋势[3]。
水稻秸秆是反刍动物重要的粗饲料原料之一,加工处理后的水稻秸可以有效减少动物的甲烷排放量。华金玲等[4]研究表明,经过青贮和氨化处理的水稻秸秆能显著降低反刍动物的甲烷排放量。然而,青贮或氨化处理降低甲烷产量的机理如何,是否是通过影响瘤胃微生物区系这一途径来实现的,此类研究还鲜有报道。针对这一问题,设计了本试验,通过体外产气法,研究不同处理水稻秸秆(青贮、氨化和碱化)对甲烷生成、瘤胃发酵模式以及瘤胃微生物区系的影响,应用实时定量PCR(RT-PCR)方法对甲烷生成相关的微生物群落,如甲烷菌、黄色瘤胃球菌、白色瘤胃球菌、原虫、真菌等进行相对定量分析,旨在探究各处理的水稻秸秆对甲烷产生的影响是否通过改变某些微生物区系来实现的,为生产实践提供理论科学依据。
1 材料与方法
1.1 不同处理水稻秸秆的制备
由东北农业大学香坊农场提供优质的水稻秸秆[干物质(DM)32%],切割成为2~3 cm长度后,分别对其进行不同的加工处理,每个处理设3个重复,每个重复制作5 kg。
青贮秸秆:选用复合乳酸菌制剂(1×105CFU/g),按秸秆DM的8%进行喷洒添加,充分混合,使其含水量达到75%(每5 kg秸秆中菌剂水溶液的添加量约为1.4 kg),在青贮袋中压实并密封,青贮处理45 d。复合乳酸菌制剂由东北农业大学动物科学技术学院反刍动物营养实验室提供,主要由植物乳酸菌(L.plantarum)、布氏乳杆菌(L.buchneri)和干酪乳杆菌(L.casei)构成。
氨化秸秆:将新鲜秸秆晾晒至其含水量达到30%,然后将秸秆DM 5%的尿素溶于水中(每5 kg秸秆中尿素水溶液的添加量约为1.4 kg),均匀地喷洒于秸秆上,使其含水量达到45%,然后装入塑料袋中并密封,氨化处理30 d。
碱化秸秆:将新鲜秸秆晾晒至其含水量达到30%,取秸秆DM 4%的氢氧化钠溶于水中(每5 kg秸秆中氢氧化钠水溶液的添加量约为0.8 kg),均匀地喷洒于秸秆上,使其含水量达到40%,装入塑料袋中并密封,碱化处理7 d。
未处理干秸秆:晾晒至风干样,作为对照。
1.2 体外培养产气量和瘤胃发酵参数的测定
体外发酵产气量的测定采用 Menke等[5]及Schofield等[6]方法进行。瘤胃液取自3头装有永久性瘤胃瘘管的健康奶牛,于晨饲2 h后由瘤胃的不同位点采集瘤胃液,装入事先预热并通入CO2的保温瓶中,立即盖严瓶口,迅速返回实验室。将采集的瘤胃液充分混合后经4层纱布过滤(在39℃温水浴中进行,通入CO2,保持厌氧环境),按比例与缓冲液混合后(瘤胃液∶缓冲液=1∶2,体积比),利用瓶口分配器迅速分装(30 mL)至已预热好,通有CO2并装有0.200 0 g(DM 基础)发酵底物的培养瓶中。其中缓冲液参照Menke等[5]的方法进行配制。每个处理设3个重复,3个空白(只装有瘤胃液与缓冲液)。发酵装置主体为HZS-H型恒温水浴摇床,其水浴温度和振荡速率均可调;培养单位是用容积约100 mL的培养瓶,其上安装有带塑料管的橡皮塞,用于密封培养瓶;塑料管上带有可调开关的三通阀以保证厌氧发酵环境;三通阀与医用玻璃注射器(可计量容积为50 mL)相连。注射器每次使用之前须洗净、烘干,然后用少量液体石蜡涂在活塞筒的四周,以防漏气,并可减少气体产生过程中活塞向上移动的阻力。记录 1、2、3、4、5、6、8、10、12、14、16、20、24、32、36、40、48 和 72 h 的产气量,并在 4、8、12、16、24、48和72 h用气体样品袋收集气体,立即测定甲烷产量[7]。在发酵24 h后,迅速测定培养液中的pH(sartorius PB-10型酸度计,赛多利斯科学仪器北京有限公司),然后取10 mL培养液以测定挥发性脂肪酸(VFA)的含量。甲烷产量及VFA浓度的测定均采用岛津GC-2010气相色谱仪进行,其中甲烷产量测定时的色谱条件为:热导检测器(TCD);填充柱TDX-01色谱柱;测定条件为柱温150℃,检测器180℃,进样口温度180℃;载气为氮气(N2),流速30 mL/min;进样量200 μL。VFA浓度测定时的色谱条件为:汽化室参数为载气 N2,分流比40∶1,进样量0.4 μL,温度 220℃;色谱柱参数为HP-INNOWax毛细管色谱柱恒流模式,流量2.0 mL/min,平均线速度38 cm/s;柱温箱参数为程序升温 120℃(3 min)——10℃/min——180℃(1 min);检测器参数为氢气(H2)流量 40 mL/min,空气流量 450 mL/min,柱流量+尾吹气流量45 mL/min,火焰离子检测器(FID)温度250℃。另取10 mL培养液快速转移至-80℃冰箱内保存,用于微生物DNA的提取。
1.3 瘤胃微生物总DNA的提取
采用珠磨-十六烷基三甲基溴化铵(CTAB)法[8]提取瘤胃微生物总DNA。提取后,用紫外可见分光光度计测定提取的总DNA浓度和纯度,样品的 OD260nm与 OD280nm比值应在 1.6~1.8之间(平均在1.75左右),且用琼脂糖凝胶电泳检测所提取的总DNA在加样孔附近呈现一致密亮带时,-20℃保存备用。
1.4 应用RT-PCR技术检测微生物相对数量
从瘤胃微生物总DNA中扩增真细菌16S rDNA。PCR反应体系:10×缓冲液 2μL,10 mmol/L的 dNTP 0.4 μL,10 μmol/L 的引物各0.8 μL,25 mmol/L 的 MgCl21.6 μL,模板(瘤胃总 DNA)0.4 μL,TaqDNA 聚合酶2 μL,ddH2O 为13.6μL,总体积为20μL。PCR反应参数:95℃变性7 min;95℃ 1 min,55℃ 1 min,72℃ 3 min,35个循环;72℃延伸7 min。RT-PCR的引物参照Denman等[9]报道的瘤胃总细菌、甲烷菌、黄色瘤胃球菌、白色瘤胃球菌和真菌引物序列[表1,由上海生工生物工程(上海)股份有限公司]。所用仪器为ABI7500型RT-PCR仪,RT-PCR的反应条件参照SYBR Premix Ex TaqTM试剂建立25μL反应体系。

表1 实时定量PCR引物序列Table 1 Primer sequences for RT-PCR[9]
1.5 计算公式
根据下面公式将瘤胃微生物相对数量表示为相对于瘤胃总细菌16S rDNA的百分比:
目标菌相对数量(%)=2-(Ct目标菌-Ct总细菌)×100[3]。
式中:Ct目标菌为以目标菌引物所测的 Ct值,Ct总细菌为以总细菌为引物所得的Ct值。
采用下列模型计算动态产气参数:y=B ×[1 - e-c×(t-lag)]。
式中:y为t时间点0.200 0 g底物DM 的产气量(mL),B为0.200 0 g底物DM 理论最大产气量(mL),c为样本的产气速度(h-1),t为体外培养时间(h),lag为产气延滞期(h)。
1.6 数据统计分析
试验数据用Excel初步记录并做简单处理,利用7500 System Software分析RT-PCR结果。然后采用SAS 9.1软件包进行数据统计分析,并用混合模型(mixed procedure)进行多重比较。
2 结果
2.1 不同处理水稻秸秆对72 h产气量及甲烷产量的影响
由表2可知,与未处理的干秸秆相比,不同处理方法可显著提高秸秆72 h体外培养的产气量(P<0.05),青贮、氨化和碱化处理分别将产气量提高了 5.62%、9.37%和 21.38%。甲烷产量的变化趋势与产气量相似,各处理秸秆的甲烷产量由高到低依次为碱化秸秆、氨化秸秆、青贮秸秆和干秸秆,其中碱化处理效果显著(P<0.05)。碱化秸秆的产气速度最快,显著高于其他3种秸秆(P<0.05)。秸秆经青贮处理后,其产气延滞期显著低于其他3种秸秆(P<0.05),干秸秆、氨化秸秆和碱化秸秆之间的差异不显著(P>0.05)。在72 h体外培养过程中,产气量的动态变化参见图1,在12 h之前,青贮秸秆产气量最高,其他由高到低为碱化秸秆、氨化秸秆和干秸秆;而在12 h之后,碱化秸秆的产气量一直处于最高水平,干秸秆最低,青贮和氨化秸秆居中。甲烷产量的动态变化趋势与体外产气量相似(图2)。
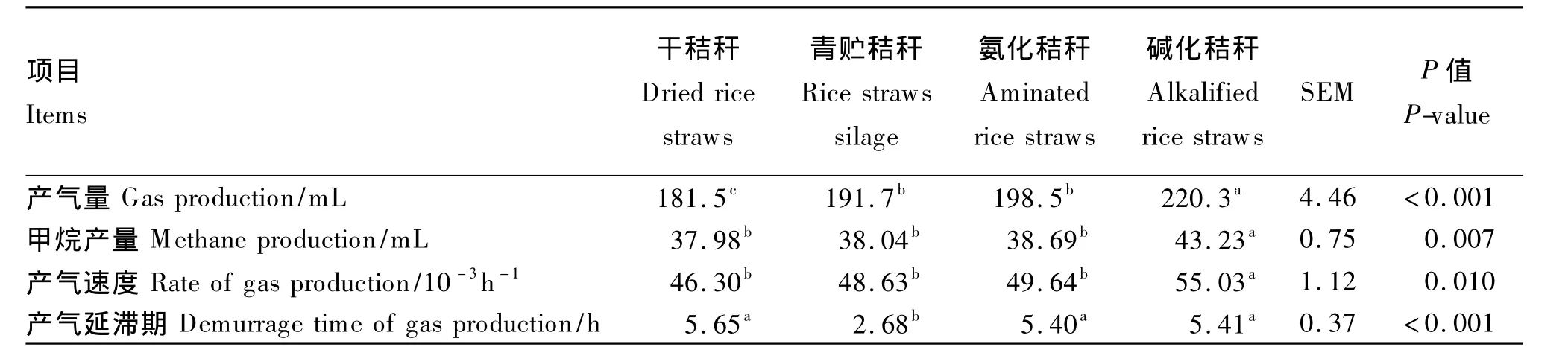
表2 不同处理水稻秸秆对体外培养72 h产气量及甲烷产量的影响Table 2 Effects of different treated rice straws on rumen gas production and methane production after 72 h in vitro incubation

图1 不同处理水稻秸秆的72 h体外产气量的动态变化Fig.1 The dynamic change of gas production of different treated rice straws in 72 h
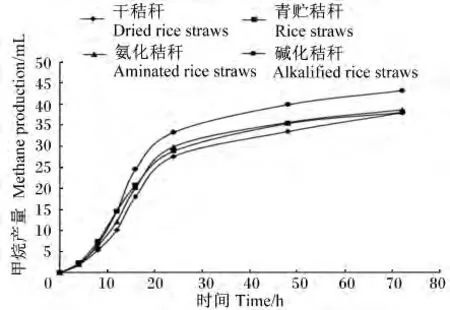
图2 不同处理水稻秸秆的72 h体外甲烷产量的动态变化Fig.2 The dynamic change of methane production of different treated rice straws in 72 h
2.2 不同处理水稻秸秆对瘤胃发酵参数的影响
由表3可知,不同处理方法对水稻秸秆体外培养氨态氮(NH3-N)浓度有显著的影响(P<0.05),其中氨化秸秆的NH3-N浓度最高,其次为青贮秸秆和碱化秸秆,而干秸秆的NH3-N浓度最低。与未处理的干秸秆相比,不论是青贮、氨化还是碱化,均显著提高了体外培养的挥发性脂肪酸(TVFA)浓度(P<0.05),其中青贮秸秆和氨化秸秆显著提高了丙酸的含量(P<0.05),降低了乙酸/丙酸(P<0.05),碱化秸秆与干秸秆具有相似乙酸/丙酸(P>0.05)。而对于甲烷/TVFA而言,氨化秸秆显著低于干秸秆和碱化秸秆(P<0.05)。
2.3 不同处理水稻秸秆对瘤胃微生物区系的影响
由表4可知,与未处理的干秸秆相比,秸秆经不同加工处理后,显著影响了培养液中琥珀酸丝状杆菌和甲烷菌相对数量(P<0.05),其中氨化和碱化处理显著提高了瘤胃培养液中琥珀酸丝状杆菌的相对数量(P<0.05),而氨化处理显著降低了培养液中甲烷菌的相对数量(P<0.05),但各处理方式对瘤胃培养液中白色瘤胃球菌、黄色瘤胃球菌、真菌和原虫的相对数量没有显著影响(P>0.05)。
由图5可知,不同处理的秸秆对各时间点的瘤胃微生物区系有明显的影响,并且各处理中的各种微生物相对数量均随着时间的变化而变化,虽然变化规律并不是很一致,但均呈现一定的持续性。其中,各处理的白色瘤胃球菌随着时间的增加而呈现先升高后下降,再升高再下降的趋势,但产生变化的时间各点略有不同。黄色瘤胃球菌和真菌则随着时间的增加而呈现先增加后下降的趋势。在12 h前,青贮秸秆培养液中琥珀酸丝状杆菌的相对数量显著高于干秸秆,其变化趋势与黄色瘤胃球菌相似。对于甲烷菌而言,各处理后秸秆在12 h前相对稳定,而在12 h后,呈现出先增加后下降,而后再增加再下降的趋势,尤其是青贮秸秆,在12 h前几乎没有明显的变化。各处理秸秆随着时间的变化对原虫相对数量变化趋势类似,总体趋于增加,但变化幅度很小。

表3 不同处理水稻秸秆对体外培养24 h瘤胃发酵参数的影响Table 3 Effects of different treated straws on rumen fermentation parameters after 24 h in vitro incubation

表4 不同处理水稻秸秆体外培养24 h的微生物区系的影响Table 4 Effects of different treated rice straws on microflora after 24 h in vitro incubation %
3 讨论
体外发酵产气量是衡量饲料可消化性的重要指标之一,而产气量与营养物质的消化率往往呈正相关性[10],本试验选用的3种处理方法均显著提高了体外发酵的产气量,表明青贮、氨化及碱化均能一定程度上改善水稻秸秆的质量,这与前人研究结果相一致[11-12]。这是由于对秸秆进行处理后,能改变其纤维类成分的相对含量,从而有利于瘤胃微生物的发酵[13]。而青贮处理后的秸秆,其体外发酵的产气延滞期显著低于其他3种秸秆,这可能由于青贮秸秆含有较高含量的有机酸和乳酸菌,从而缩短了秸秆的发酵产气延滞期[14]。
通过青贮、氨化或碱化处理的秸秆的产气量显著高于干秸秆,说明此3种处理能有效提高秸秆的消化率。而氨化秸秆的甲烷/TVFA最低,说明甲烷能的损失量降低,这与前人的研究结果一致[15-16]。Getachew 等[17]通过体外发酵研究得出,饲料中的慢速降解部分能产生更多的甲烷。水稻秸秆通过氨化处理后,显著降低了秸秆中性洗涤纤维(NDF)的含量,而NDF是生成乙酸的前体物质,所以NDF含量的降低会使瘤胃发酵模式发生变化(由乙酸型转向丙酸型发酵),进而使参与生成甲烷的底物H2有所减少。
经过处理的水稻秸秆体外发酵后的NH3-N浓度都有明显的增加,这是由于处理后的秸秆,其发酵能力提高,进而使粗蛋白质的降解速度加快[18]。其中氨化秸秆的培养液NH3-N浓度高于青贮秸秆和碱化秸秆,原因是氨化处理由于添加了氮源,为微生物发酵提供更多含量的含氮底物来生成NH3-N所致。

图5 不同处理水稻秸秆对体外培养72 h微生物相对数量的影响Fig.5 Effects of different treated rice straws on microbe number during 72 h in vitro incubation
VFA是反刍动物能量利用的主要形式,主要包括乙酸、丙酸和丁酸,这3种酸约占瘤胃发酵VFA 总产量的95%[19-20]。在本试验中,3 种不同处理水稻秸秆的试验组中TVFA浓度均高于干秸秆,这可能由于青贮、青贮和氨化处理可以将秸秆的细胞壁变疏松,有利于微生物的发酵,进而产生更多的VFA。并且,青贮秸秆和氨化秸秆的乙酸/丙酸有显著降低,这也进一步表明,这2种处理方法可通过降低乙酸/丙酸来降低甲烷的产量,这与Russell[21]和 Cao 等[16]报道结果相吻合。
瘤胃中的纤维降解细菌主要有黄色瘤胃球菌、白色瘤胃球菌、琥珀酸丝状杆菌和溶纤维丁酸弧菌。Fernando等[22]研究发现在高粗饲粮条件下,琥珀酸丝状杆菌为瘤胃发酵中的优势菌群。这与本试验的研究结果相似。尿素氨化处理提高了秸秆在瘤胃发酵中产生的琥珀酸丝状杆菌相对数量,这与陈伟健等[23]研究结果一致。Wanapat等[24]采用RT-PCR技术进行动物体内试验,发现氨化处理后的水稻秸秆,显著提高了瘤胃培养液中白色瘤胃球菌和黄色瘤胃球菌的数量。然而,本试验并未发现相似的结果,这可能是由于体内试验和体外试验条件差异原因所产生不同的瘤胃内环境条件所致。在培养前期,青贮秸秆能显著提高琥珀酸丝状杆菌的相对数量,琥珀酸丝状杆菌在瘤胃发酵中的主要产物为乙酸和琥珀酸,并不产生H2。所以,青贮处理可能通过促进不产氢菌的生长来降低秸秆发酵中H2的产生,从而减少甲烷的生成[25]。
真菌在瘤胃纤维降解中同样发挥重要的作用。Wood等[26]通过体外研究表明,瘤胃真菌和产甲烷菌对纤维的降解存在促进作用,而甲烷菌的存在能改变瘤胃真菌的活性、改变发酵产物,使其趋于产生更多的乙酸、甲烷和CO2。本试验表明,在培养初期,青贮秸秆的培养液中真菌和甲烷菌的相对数量最低,表明青贮处理不利于甲烷菌和真菌的生长。而真菌相对数量并不受处理条件的影响。
在16 h前青贮秸秆的培养液中,甲烷菌相对数量低于其他3种秸秆,这可能是由于青贮秸秆含较高的有机酸,致使甲烷菌的生长受到抑制所致[27]。所以在体外培养初期,青贮秸秆的单位甲烷产量最低。而氨化秸秆降低了24 h体外发酵甲烷菌的相对数量,这与瘤胃培养液内纤维类物质代谢有关。有研究表明,甲烷菌数量与秸秆中NDF的含量呈明显的正相关性[28]。当纤维类物质含量低时(如氨化秸秆),培养底物发酵能力增强,甲烷生成底物H2的供给量相对充足,从而使甲烷的排放量增多;而对于干秸秆而言,由于纤维类物质含量高,通过增加甲烷菌数量来提高甲烷产量,进而保持瘤胃内环境稳定。
3种不同处理方法均没有显著影响秸秆发酵中瘤胃原虫相对数量,原虫在瘤胃中以细菌、真菌等为其主要捕食对象[29],并且与甲烷菌存在共生关系。因此可以通过驱除原虫来减少甲烷菌,进而降低甲烷的排放量[30]。本试验结果表明,原虫相对数量与甲烷菌变化并不一致。
4 结论
①对水稻秸秆进行青贮,、氨化和碱化处理,可以不同程度地改变体外瘤胃的发酵模式,甲烷生成以及瘤胃微生物区系的组成。
②从甲烷减排角度考虑,可选择青贮和氨化的处理方式。
[1] VELLINGA TH V,DE HAAN M H A,SCHILS R L M,et al.Implementation of GHG mitigation on intensive dairy farms:farmer’preferences and variation in cost effectiveness[J].Livestock Science,2011,137(1/2/3):185-195.
[2] 张博,陈国谦,陈彬.甲烷排放与应对气候变化国家战略探析[J].中国人口·资源与环境,2012,22(7):8-14.
[3] VERMEULEN S J,AGGARWAL P K,AINSLINE A,et al.Options for support to agriculture and food security under climate change[J].Environmental Science and Policy,2012,15(1):136 -144.
[4] 华金玲,张永根,王立克,等.水稻秸青贮对反刍动物甲烷排放的影响[J].东北林业大学学报,2012,40(7):135-138.
[5] MENKE K H,STEINGASS H.Estimation of energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J].Animal Research and Development,1988,28:7 -55.
[6] SCHOFIELD P,PELL A N.Measurement and kinetic analysis of the neutral detergent-soluble carbohydrate fraction of legumes and grasses[J].Journal of Animal Science,1995,73(11):3455 -3463.
[7] 胡伟莲,王佳堃,吕建敏,等.瘤胃体外发酵产物中的甲烷和有机酸含量的快速测定[J].浙江大学学报:农业与生命科学版,2006,32(2):217 -221.
[8] BÜRGMANN H,PESARO M,WIDMER F,et al.A strategy for optimizing quality and quantity of DNA extracted from soil[J].Journal of Microbiological Methods,2001,45(1):7 -20.
[9] DENMAN S E,MCSWEENEY C S.Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J].FEMSMicrobiology Ecology,2006,58(3):572-582.
[10] MENKE K H,RAAB L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J].The Journal of Agriculture Science,1979,93(1):217-222.
[11] 张文举,晏向华,龚月生,等.青贮对玉米秸营养价值及其瘤胃有效降解率的影响[J].中国草食动物,2003,23(1):8 -9.
[12] 刘丹.化学处理对稻草超微结构和瘤胃微生物活力的影响[D].硕士学位论文.杭州:浙江大学,2004:15-16.
[13]范华,裴彩霞,董宽虎.不同保存方法对秸秆营养价值的影响[J].中国农学通报,2007,23(11):24 -28.
[14] 华金玲.水稻秸青贮制作、营养价值和利用效果的比较[D].博士学位论文.哈尔滨:东北农业大学,2008:72-73.
[15] BLÜMMEL M,GIVENS D I,MOSS A R.Comparison of methane produced by straw fed sheep in opencircuit respiration with methane predicted by fermentation characteristics measured by an in vitro gas procedure[J].Animal Feed Science and Technology,2005,123-124:379-390.
[16] CAO Y,TAKAHASHI T,HORIGUCHI K-I,et al.Effect of adding lactic acid bacteria and molasses on fermentation quality and in vitro ruminal digestion of total mixed ration silage prepared with whole crop rice[J].Japanese Society of Grassland Science,2010,56(1):19-25.
[17] GETACHEW G,ROBINSON P H,DEPETERS E J,et al.Methane production from commercial dairy rations estimated using an in vitro gas technique[J].Animal Feed Science and Technology,2005,123 -124:391-402.
[18] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[19] 李炯明,庄苏,王恬,等.海南霉素对人工瘤胃体外发酵调控的影响[J].家畜生态学报,2007,28(1):41-46.
[20] 李旺.瘤胃挥发性脂肪酸的作用及影响因素[J].中国畜牧杂志,2012,48(7):63 -66.
[21] RUSSELL JB.The importance of pH in the regulation of ruminal acetate to propionate ratio and methane production in vitro[J].Journal of Dairy Science,1998,81(12):3222-3230.
[22] FERNANDO S C,PURVIS H T,NAJAR F Z,et al.Rumen microbial population dynamics during adaptation to a high-grain diet[J].Applied and Environmental Microbiology,2010,76(22):7482 -7490.
[23] 陈伟健,王翀,王佳堃,等.体外法研究氨化处理对稻草发酵特性及其微生物数量的影响[J].中国奶牛,2011(14):11-14.
[24] WANAPAT M,CHERDTHONG A.Use of Realtime PCR technique in studying rumen cellulolytic Bacteria population as affected by level of roughage in swamp buffalo[J].Current Microbiology,2009,58(4):294-299.
[25] 池振明.现代微生物生态学[M].2版.北京:科学出版社,2010.
[26] WOOD T M,WILSON C A,MCCRAE S I,et al.A highly active extracellular cellulase from the anaerobic rumen fungus Neocallimastix frontalis[J].FEMS Microbiology Letter,1986,34(1):37 -40.
[27] 郭嫣秋,胡伟莲,刘建新.瘤胃甲烷菌及甲烷生成的调控[J].微生物学报,2005,45(1):145 -148.
[28] 郭嫣秋.瘤胃产甲烷菌定量检测与微生物菌群调控研究[D].博士学位论文.杭州:浙江大学,2008:119-120.
[29] JOUANY J P,USHIDA K.The role of protozoa in feed digestion review[J].Asian-Australasian Journal of Animal Sciences,1999,12(1):113 -128.
[30] 陈丹丹,刁其玉,姜成钢,等.反刍动物甲烷的产生机理和减排技术研究进展[J].中国草食动物科学,2012,32(4):66 -69.
