氧葡萄糖剥夺-再恢复后小胶质细胞Toll样受体9信号通路的激活
2015-12-19王艺东杨碧莹潘经锐彭晴霞
王艺东 杨碧莹 潘经锐 纪 原 彭晴霞
(中山大学孙逸仙纪念医院神经科,广州510120)
小胶质细胞作为中枢神经系统内的免疫细胞,是脑内炎症反应的主要执行者。脑缺血发生后,小胶质细胞被激活。在缺血早期小胶质细胞是促炎因子的主要脑内来源,起神经毒性作用。而在缺血后期,小胶质细胞释放神经保护因子,促进组织修复[1,2]。导致小胶质细胞发挥这种“双刃剑”作用的机制是什么?目前还不清楚。Toll样受体(Tolllike receptors,TLRs)是小胶质细胞对外来刺激产生信号传导的一种很关键的受体蛋白,特别是TLR9具有促炎症和细胞保护两条不同的信号转导通路:⑴通过核因子kappa B(Nuclear factor kappa B,NF-κB)途径,诱导促炎症因子(肿瘤坏死因子TNF-α、白介素IL-1)的产生;⑵通过干扰素调节因子7(Interferon Regulatory Factor 7 ,IRF7)途径,诱导I型干扰素(IFN-β、IFN-α)的产生[3]。因此,我们推测TLR9可能在小胶质细胞的“双刃剑”效应中发挥重要的作用。实验在体外采用氧葡萄糖剥夺-再恢 复 (Oxygen-glucose deprivation/recovery,OGDR)模型模拟脑缺血再灌注的体内过程,用BV-2细胞作为体外研究小胶质细胞的细胞模型,观察OGDR后BV-2细胞TLR9下游信号分子的变化规律,为深入研究TLR9在小胶质细胞的“双刃剑”效应中的作用打下基础。
材料和方法
1.实验材料
小鼠BV-2细胞(中山大学孙逸仙纪念医院唐亚梅馈赠),DMEM/F12培养基、胎牛血清(FBS)、0.25%胰酶购自美国GIBCO公司,WST-8试剂盒购自日本同仁化学研究所,免疫细胞化学试剂盒购自福州迈新公司,大鼠抗小鼠单克隆CD68抗体购自美国ABD公司,TRIzol、逆转录试剂盒、TLR9 PCR引物购自日本 TaKaRa公司,β-actin PCR引物购自上海英潍捷基公司,BCA蛋白浓度测定试剂盒购自武汉博士德公司,小鼠TLR9蛋白单克隆抗体购自英国Abcam公司,小鼠NF-κB(P65)蛋白单克隆抗体、磷酸化NF-κB(P-P65)蛋白单克隆抗体、IRF7蛋白单克隆抗体、磷酸化IRF7(P-IRF7)蛋白单克隆抗体购自美国CST公司,小鼠GAPDH蛋白单克隆抗体购自杭州宝科生物公司,PhosSTOP磷酸化酶抑制剂,小鼠IL-1β和TNF-αELISA试剂盒购自美国R&D公司,小鼠IFN-βELISA试剂盒购自美国Life technology公司。
2.细胞培养
BV-2细胞接种于含10%胎牛血清的DMEM/F12培养液中,置于37℃、5%CO2的细胞培养箱中培养。0.25%胰酶消化传代,3-5d传代一次。至细胞生长良好时开始实验。
3.OGDR模型的建立
先调设三气培养箱至缺氧状态(37℃,1%O2,5%CO2,95%N2)。把 BV-2细胞以合适密度分别接种于6、24、96孔板,吸出培养基,加入EBSS平衡盐溶液,置于缺氧箱内培养。4h后将细胞取出,此时细胞损伤达约30%-40%。换回原培养基,置于普通培养箱(37℃,19%O2,5%CO2)继续培养。根据复氧时间不同,分为0h、6h、12h、24h、48h、72 h组。以常氧培养的BV-2细胞作对照。
4.SP法细胞免疫染色
BV-2细胞悬液接种于预置有消毒盖玻片的六孔培养板中,制作成细胞爬片。细胞予OGDR处理后24h取出培养箱。PBS洗一次,4%多聚甲醛1ml每孔固定10min。将细胞爬片放入0.5%过氧化氢溶液中30min,消除内源性过氧化酶活性。蒸馏水洗3次,滴加山羊血清封闭液,室温下10min,封闭非特异性抗源。甩去山羊血清,滴加大鼠抗小鼠CD68单克隆抗体,孵育1h。PBS洗3次,滴加Supervision过氧化物酶-山羊抗大鼠IgG,置37℃湿盒中30min。PBS洗4次,DAB显色,至显微镜下观察出现棕褐色阳性信号,水洗终止反应。苏木素轻度复染,梯度酒精脱水,二甲苯透明,光学树脂封片,镜下观察拍照。BV-2细胞中出现棕褐色粗大颗粒为阳性,反之为阴性。
5.荧光定量PCR检测
按TRIzol操作说明提取总RNA并鉴定,选择纯度及完整性高的RNA用于后续实验。首先将总RNA逆转录为cDNA(37℃,15min;85℃,5s),得到的cDNA用LC480荧光定量PCR仪进行荧光定量PCR反应。TLR9引物序列为GAGACCCTGGTGTGGAACATC (forward)and ACTGCAGCCTGTACCAGGAG (reverse)。PCR 反应重复 3次。反应条件为:95℃30s;95℃5s,60℃ 20s,95℃0s,65℃15s,95℃0s,共46个循环。
6.Western Blot检测
提取总蛋白,BCA法测定蛋白浓度。以GAPDH为内参。8%SDS-PAGE电泳分离蛋白后,电转法将目的蛋白转移到PVDF膜上,脱脂奶粉封闭1h。分别 加 入 一 抗 (NF-κB(P65),NF-κB(P-P65),IRF7,P-IRF7和 GAPDH 一抗稀释倍数均为1∶1000)4°C孵育过夜,TBST洗膜3次,加入二抗(1∶5000)室温孵育1h,TBST洗膜三次,化学发光法显色。采用Image J分析软件对目的蛋白条带与GAPDH灰度值的比值进行统计分析。
7.ELISA检测
各组分别在相应时间收集细胞上清液,于-80℃保存备用。分别按照各试剂盒说明检测各样本细胞上清中IL-1β、TNF-α和IFN-β含量,每个样本重复三个复孔,加好终止液后5min内以酶标仪450 nm 测定吸光度,待测样本中IL-1β、TNF-α和IFN-β浓度与OD 450值成正比,通过绘制标准曲线求出各组细胞中IL-1β、TNF-α和IFN-β浓度。
8.统计学分析
结 果
1.免疫细胞化学染色结果
OGDR组BV-2细胞胞体较大,发出多个突起,呈阿米巴样,胞膜和胞浆中可见棕褐色粗大颗粒,呈强阳性染色,其中淡蓝色为细胞核的衬染。说明经OGDR处理BV-2细胞的CD68蛋白阳性表达,即小胶质细胞被激活。对照组中正常BV-2细胞细胞体呈细长或椭圆,发出细长而有分支的突起,只见细胞核的衬染,胞浆及胞膜未见阳性染色(图1)。
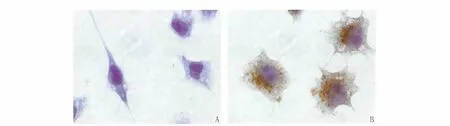
图1 BV-2细胞免疫细胞化学染色。A.对照组,BV-2细胞胞浆及胞膜未见阳性染色(×1000);B.OGDR组,OGDR 24 h BV-2细胞胞膜和胞浆中可见棕褐色粗大颗粒,呈强阳性染色(×1000)。Fig.1CD68immunocytochemical staining of BV-2cell.A.Control group.There was no positive staining in BV-2cell plasma and membrane(×1000);B.OGDR group.Brown coarse particle appeared in BV-2cell membrane and cytoplasm at 24 hour,showed strong positive staining(×1000).
2.OGDR后BV-2细胞TLR9mRNA表达的变化
经鉴定,提取的RNA完整性好。对照组各时间点BV-2细胞TLR9mRNA表达差异无统计学意义(F=0.250,P=0.932);OGDR组随着时间延长TLR9mRNA表达逐渐升高,24h达高峰,后表达逐渐降低,但72h仍高于0h时间点,差异有统计学意义(F=5.400,P=0.008)。相同时间点比较,OGDR组的TLR9mRNA表达量高于对照组,除0 h外,其他时间点的结果均有统计学意义的差异(P值均<0.05)(图2)。
3.OGDR后BV-2细胞 NF-κB (P65)、NF-κB(P-P65)、IRF7、P-IRF7蛋白表达的变化
对照组各时间点 BV-2细胞 NF-κB (P65)、NF-κB(P-P65)、IRF7、P-IRF7蛋白表达均无显著差异(P值均>0.05)。OGDR组各时间点BV-2细胞 NF-κB(P65)和IRF7表达无明显变化(P 值均>0.05)。与对照组相同时间点比较,OGDR组NF-κB(P-P65)在0h、6h、12h明显增高(P 值均<0.05),24h、48h、72h表达无明显增高(P 值均>0.05);P-IRF7在0h、6h无明显增高,从12h起明显增高(P 值均<0.05)。P-P65/P65的比值在0h-12h表达增高,而 P-IRF7/IRF7的比值在12h-72h增高(图3、4)。
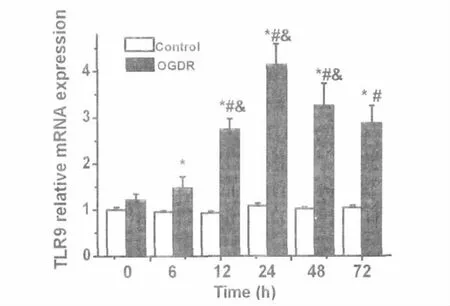
图2 荧光定量PCR检测BV-2细胞TLR9mRNA的表达。*与相同时间点对照组比较P<0.05;#与OGDR组0 h比较P<0.05;&与前一时间点OGDR组比较P<0.05。Fig.2The expression levels of TLR9mRNA in BV-2 cell were detected by fluorescence quantitative PCR.* P<0.05,vs the control group at the same time;# P<0.05,vs the OGDR group at 0hour;&P<0.05,vs the OGDR group at the previous point in time.
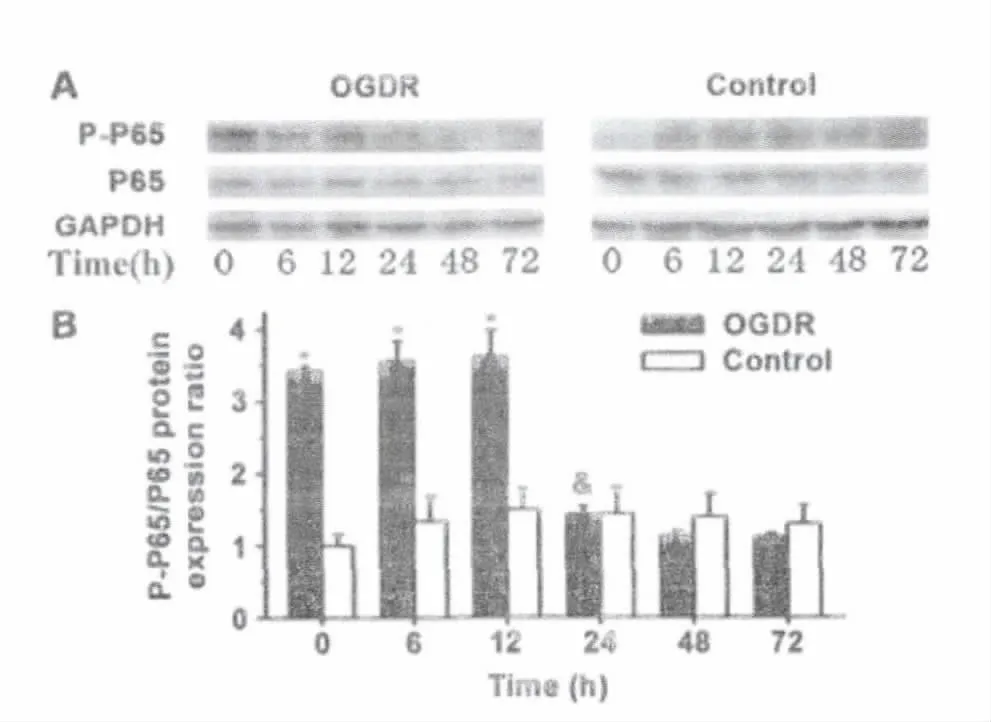
图3 Western Blot检测BV-2细胞 NF-κB(P65)、磷酸化 NF-κB(P-P65)蛋白表达。* 代表与与相同时间点对照组比较P<0.05,&与前一时间点OGDR组比较P<0.05。Fig.3The expression levels of NF-κB (P65)and phosphorated NF-κB (P-P65)protein in BV-2cell were detected by Western Blot.* P<0.05,vs the control group at the same time;&P<0.05,vs the OGDR group at the previous point in time.
4.OGDR 后 BV-2细胞上清中 TNF-α、IL-1β和IFN-β水平的变化
对照组各时间点 BV-2细胞 TNF-α、IL-1β和IFN-β水平均无显著差异(P值均>0.05)。OGDR组各时间点之间TNF-α、IL-1β表达水平有统计学差异(P 值均<0.05),IFN-β水平无显著差异(P>0.05),但在24h、48h、72h与对照组相同时间点比较有统计学意义的增加(P 值均<0.05)。TNF-α在OGDR后12h明显增高,于24-48h达峰,后下降。IL-1β表达在OGDR后6h明显增高,至48h达峰,后显著下降(表1)。
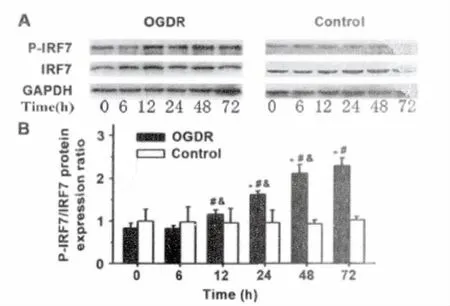
图4 Western Blot检测BV-2细胞IRF7、磷酸化IRF7(P-IRF7)蛋白表达。*与相同时间点对照组比较P<0.05,#与OGDR组0h比较P<0.05,&与前一时间点OGDR组比较P<0.05。Fig.4The expression levels of IRF7and phosphorated IRF7 (P-IRF7)protein in BV-2cell were detected by Western Blot.*P<0.05,vs the control group at the same time;#P<0.05,vs the OGDR group at 0hour;&P<0.05,vs the OGDR group at the previous point in time.
讨 论
小胶质细胞是中枢神经系统最重要的免疫细胞,在神经胶质细胞中占约20%。作为中枢神经系统常驻的抗原提呈细胞和巨噬细胞,小胶质细胞起着免疫监视的关键作用[4]。小胶质细胞的激活是脑缺血再灌注后炎症反应中最重要的改变之一。在正常情况下,小胶质细胞处于静息状态,脑缺血再灌注后,小胶质细胞迅速被激活,发挥其重要的生物学效应。本研究采用OGDR方法模拟脑缺血再灌注的体内过程,观察到OGDR后存活的小胶质细胞形态发生明显改变,由静止的分枝状变成阿米巴样的激活状态。免疫细胞化学染色证明OGDR后小胶质细胞激活的其中一个标志物CD68染色强阳性。这与Lyons和 Colton等的研究结果[5,6]一致,显示OGDR处理后存活的小胶质细胞被激活。
TLR9是小胶质细胞对外来刺激产生信号传导的重要的受体蛋白,脑缺血再灌注后小胶质细胞的激活与TLR9是否相关,小胶质细胞上TLR9信号通路的表达是否发生改变,还未见文献报道。本研究利用脑缺血再灌注的体外模型,首次观察到小胶质细胞上TLR9信号通路的动态变化,发现OGDR后小胶质细胞上TLR9mRNA表达上调,提示TLR9被激活。
表1 ELISA检测TNF-α、IL-1β和IFN-β表达水平(pg/mL)(),n=3)Table 1 The expression levels of TNF-α、IL-1βand IFN-βwere determined by ELISA(pg/mL)(),n=3)
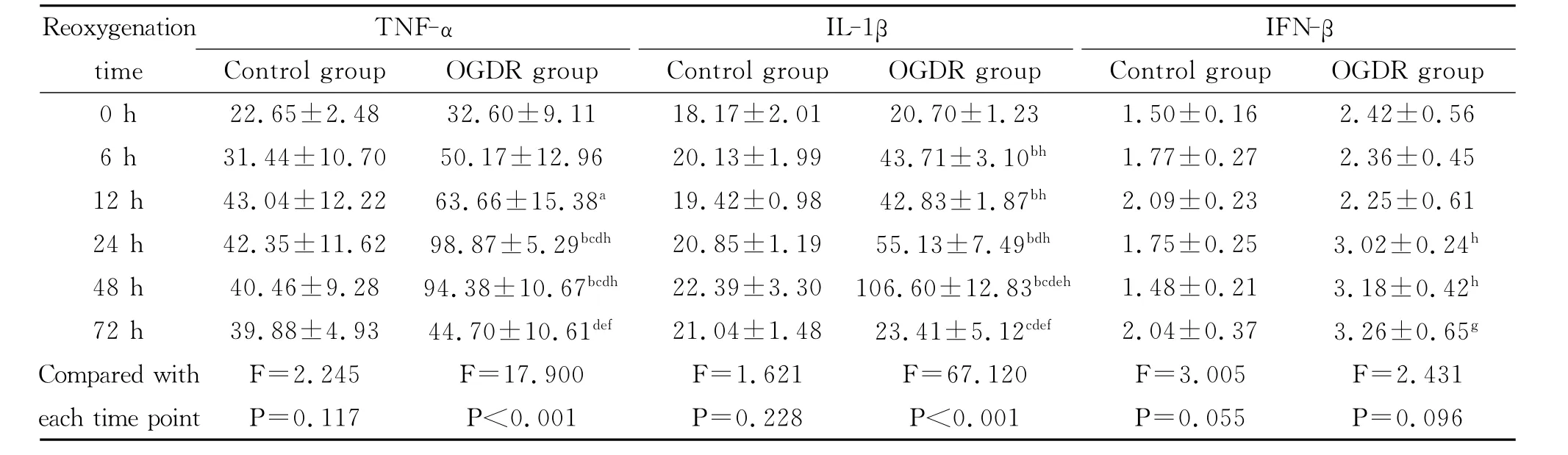
表1 ELISA检测TNF-α、IL-1β和IFN-β表达水平(pg/mL)(),n=3)Table 1 The expression levels of TNF-α、IL-1βand IFN-βwere determined by ELISA(pg/mL)(),n=3)
注:与OGDR组0h比较,aP<0.05,b P<0.01;与OGDR组6h比较,c P<0.01;与OGDR组12h比较,d P<0.01;与OGDR组24h比较,e P<0.01;与 OGDR组48h比较,f P<0.01;与对照组相同时间点比较,g P<0.05,h P<0.01Note:aP<0.05and b P<0.01,vs the OGDR group at 0hour;c P<0.01,vs the OGDR group at 6hour;d P<0.01,vs the OGDR group at 12hour;e P<0.01,vs the OGDR group at 24hour;f P<0.01,vs the OGDR group at 48hour;g P<0.05and h P<0.01,vs the control group at the same time.
Reoxygenation time TNF-α Control group OGDR group IL-1β Control group OGDR group IFN-β Control group OGDR group.23 1.50±0.16 2.42±0.56 6h 31.44±10.70 50.17±12.96 20.13±1.99 43.71±3.10bh 1.77±0.27 2.36±0.45 12h 43.04±12.22 63.66±15.38a 19.42±0.98 42.83±1.87bh 2.09±0.23 2.25±0.61 24h 42.35±11.62 98.87±5.29bcdh 20.85±1.19 55.13±7.49bdh 1.75±0.25 3.02±0.24h 48h 40.46±9.28 94.38±10.67bcdh 22.39±3.30 106.60±12.83bcdeh 1.48±0.21 3.18±0.42h 72h 39.88±4.93 44.70±10.61def 21.04±1.48 23.41±5.12cdef 2.04±0.37 3.26±0.65g Compared with F=2.245 F=17.900 F=1.621 F=67.120 F=3.005 F=2.431 each time point P=0.117 P<0.001 P=0.228 P<0h 22.65±2.48 32.60±9.11 18.17±2.01 20.70±1 0.001 P=0.055 P=0.096
既往研究发现,TLR9的激活导致转录因子NF-κB发生磷酸化并发生核转位,导致一系列基因转录使下游炎症因子TNF-α和IL-1β等表达增多;另一方面,TLR9通过介导IRF7的激活继而导致IFN-α和IFN-β表达增多[3]。本研究也发现OGDR后 TLR9/NF-κB/TNF-α、IL-1β通路的激活,NF-κB(P-P65)0-12h增高,TNF-α逐渐增高,于24-48h达峰,而IL-1β表达在48h达峰。这些结果说明,OGDR后小胶质细胞的激活伴随着TLR9炎症通路的活化。然而,在本实验中我们也观察到,尽管OGDR后磷酸化IRF7表达在12-72h增高,IFN-β在24h、48h、72h与对照组相同时间点比较有明显增加,但没有发现OGDR后各时间点IFN-β有统计学意义的改变,而且IFN-β水平远比 TNF-α、IL-1β水平低。原因可能是IFN-β在72h后才升高,也可能与其他因素有关。Holley等 和Liu等各自的研究均发现TLR2和TLR9可能存在拮抗关系[7,8]。同时给予TLR2和TLR9的激动剂,TLR2的激活可以阻止TLR9活化并诱导I型干扰素表达。而已有研究报道OGDR可以导致TLR2的激活[9],所以我们推测,以炎症作用为主的TLR2的激活可能抑制了TLR9的细胞保护通路。Coccia等研究发现,给予TLR9特异的配体CpG-DNA刺激,在树突状细胞能诱导所有的IFN-α亚型和IFN-β的表达,而TLR3配体polyI:C和TLR4配体LPS的刺激,在单核细胞来源的树突状细胞却只能诱发IFN-β,而无IFN-α的表达[10]。另一个来自Leung等的研究表明,给予TLR7特异的配体预刺激处理,在小鼠大脑中动脉闭塞模型中检测到脑组织中只有IFN-α的升高而无IFN-β的升高[11]。据此,推测 OGDR后BV-2细胞中只有IRF-7的升高而未见IFN-β的表达增多也可能与细胞的种类以及处理的方式和强度有关。
综上所述,OGDR处理在72h内主要活化小胶质细胞上TLR9的炎症通路。由于OGDR可能同时激活了其他TLRs,不同TLRs之间可能存在复杂的交互作用(Crosstalk)[12],导致IFN-β的表达受抑制。此外,由于受BV-2细胞株生长速度影响,本实验未能观察OGDR 72h后小胶质细胞TLR9信号通路的激活情况,还需要进一步通过体内实验进行更长时间的研究,以明确TLR9信号通路的激活与小胶质细胞双向作用的相关性。
[1]Weinstein JR,Koerner IP,Moller T.Microglia in ischemic brain injury.Future Neurol,2010,5:227-246
[2]Jin R,Yang G,Li G.Inflammatory mechanisms in ischemic stroke:role of inflammatory cells.J Leukoc Bi-ol,2010,87:779-789
[3]Marsh BJ,Williams-Karnesky RL,Stenzel-Poore MP.Toll-like receptor signaling in endogenous neuroprotection and stroke.Neuroscience,2009,158:1007-1020
[4]Tambuyzer BR,Ponsaerts P,Nouwen EJ.Microglia:gatekeepers of central nervous system immunology.J Leukoc Biol,2009,85:352-370
[5]Lyons SA,Kettenmann H.Oligodendrocytes and microglia are selectively vulnerable to combined hypoxia and hypoglycemia injury in vitro.J Cereb Blood Flow Metab,1998,18:521-530
[6]Colton CA,Wilcock DM.Assessing activation states in microglia.CNS Neurol Disord Drug Targets,2010,9:174-191
[7]Holley MM,Zhang Y,Lehrmann E,et al.Toll-Like Receptor 2 (TLR2)-TLR9Crosstalk Dictates IL-12 Family Cytokine Production in Microglia.Glia,2012,60:29-42
[8]Liu YC,Simmons DP,Li X,et al.TLR2signaling depletes IRAK1and inhibits induction of type I IFN by TLR7/9.J Immunol,2012,188:1019-1026
[9]Lv M,Liu Y,Zhang J,et al.Roles of inflammation response in microglia cellthrough Toll-like receptors 2/interleukin-23/interleukin-17pathway in cerebral ischemia/reperfusion injury.Neuroscience,2011,176:162-172
[10]Coccia EM,Severa M,Giacomini E,et al.Viral infection and Toll-like receptor agonists induce a differential expression of type I and lambda interferons in human plasmacytoid and monocyte-derived dendritic cells.Eur J Immunol,2004,34:796-805
[11]Leung PY,Stevens SL,Packard AE,et al.Toll-like receptor 7preconditioning induces robust neuroprotection against stroke by a novel type I interferon-mediated mechanism.Stroke,2012,43:1383-1389
[12]Ghosh TK,Mickelson DJ,Solberg JC,et al.TLRTLR cross talk in human PBMC resulting in synergistic and antagonistic regulation of type-1and 2interferons,IL-12and TNF-alpha.Int Immunopharmacol,2007,7:1111-1121
