离子对色谱-ELSD检测麦类中植酸的方法研究
2015-12-18鞠兴荣
袁 建 王 艳 范 哲 李 倩 何 荣 鞠兴荣
(南京财经大学食品科学与工程学院,南京 210046)
Yuan Jian Wang Yan Fan Zhe Li Qian He Rong JuXingrong
(College of Food Science&Engineering,Nanjing University of Finance and Economics,Nanjing 210046)
离子对色谱-ELSD检测麦类中植酸的方法研究
袁 建 王 艳 范 哲 李 倩 何 荣 鞠兴荣
(南京财经大学食品科学与工程学院,南京 210046)
建立了应用离子对色谱-蒸发光散射检测(IPC-ELSD)麦类作物中植酸含量的方法,并结合电喷雾质谱(ESI-MS)分析鉴定了各组分。色谱条件:C18色谱柱(5μm,4.6 mm×150 mm);流动相:甲醇-水(体积比60∶40,含0.4%正戊胺,甲酸调节pH为4.5);流速1.0 mL/min;柱温35℃。结果表明,植酸含量在0.25~5.0mg/mL范围内线性关系良好(R2=0.999 1),检测限为40μg/mL,平均回收率为90.44%,相对标准偏差为3.13%。该方法快速、准确,适用于麦类中植酸含量的测定。
离子对色谱 蒸发光散射检测 麦类 植酸
植酸(phytic acid,InsP6)化学名肌醇-1,2,3,4,5,6-六磷酸二氢脂或肌醇己糖磷酸[1],是一种小分子有机磷酸类化合物,广泛存在于常见的食物中,在谷物种子、豆类及油料作物中含量较高,块茎类和园艺产品中含量较低[2]。作为植物种子中磷酸和肌醇的主要贮存形式,植酸磷可达到总磷含量的70%[3]。植酸是一种多齿螯合剂,能够与生物体内的矿物质离子及蛋白质结合成复合物,对机体产生抗营养作用,因此,被认为是一种抗营养因子[4]。然而,随着研究的深入,植酸独特的生理活性引起广泛关注,并被开发应用到食品、药物等领域[5]。
小麦、大麦、燕麦是我国主要的麦类作物,Lolas等[6]研究发现,三者中的植酸质量分数依次为0.39%~1.35%,0.38%~1.16%,0.42%~1.16%,但麦类中植酸分析尚缺少有效的手段,麦类作物中植酸含量基础数据也还较为缺乏。
目前,植酸的分析常采用测铁分光光度法[7]。该方法操作简便,但不能区分植酸及其降解产物(IP5-IP4-IP3),精确度较低。结合现代色谱技术,国外学者做了大量的研究,包括了紫外检测器和差示折光检测器的应用,但是植酸极性强,易电离,因此在反向色谱柱上保留时间极短;其结构中无发色团,因此无法直接利用紫外或荧光检测器测定[8],而采用示差折光检测器时,对流动相要求高,无法进行梯度洗脱,待测组分与干扰成分分离较为困难。本试验以小麦为原料,采用离子对色谱分离,结合蒸发光散射检测,以改善植酸的保留、分离及检测问题,以期建立一种新的有效的植酸检测方法,为麦类资源综合利用提供参考依据。
1 材料
1.1 材料与试剂
小麦:市售,粉碎过80目筛,冰箱4℃保存。
植酸钾(纯度≥95%)、正戊胺(纯度99%)、Dowex1×8氯型阴离子交换树脂(200~400目):Sigma;甲醇,色谱纯:Merck;甲酸,色谱纯:Roe。
1.2 仪器与设备
DionexUltimate3000高效液相色谱仪,配Acclaim 120 C18(5μm,4.6 mm×150 mm)色谱柱:美国Thermo Fisher公司;Alltech3300蒸发光散射检测器(ELSD):美国Grace公司;Agilent 1100 HPLC/MS(SL)型液质联用仪:美国Agilent公司;4.5 L冷冻干燥机:美国labconco公司;Millpore超纯水器:美国Millpore公司;JXFM110锤式旋风磨:上海嘉定粮油仪器有限公司;离子交换柱(d1.4 cm×30 cm):自制。
2 试验方法
2.1 样品前处理
2.1.1 阴离子交换柱的制备
称取1 g树脂用低浓度氯化钠溶液浸泡后,加入预先铺好脱脂棉、无水硫酸钠并装好3 cm水柱高的离子交换柱中,树脂床形成后用蒸馏水淋洗至无盐状态[7]。柱子用15 mL,2 mol/L的盐酸溶液平衡后用30 mL蒸馏水冲洗至无Cl-,备用[9]。整个操作过程中应保持柱床垂直、稳定。
2.1.2 植酸的提取与纯化
样品前处理参照Lee等[10]的方法略有改动。样品经粉碎过80目筛后,精确称取1.000 g于具塞锥形瓶中,加入20 mL,0.7 mol/L的盐酸溶液,30℃条件下恒温振荡提取1 h。将提取后的混合液倒入离心管中,4 000 r/min离心10 min。取上清液进行纯化。
将上清液全部转移入制备好的阴离子交换柱中后,先后以30 mL,0.1 mol/L的氯化钠溶液和30 mL蒸馏水冲洗以去除杂质和无机磷[11]。柱子中保留的植酸以30 mL,2 mol/L的盐酸溶液,1 mL/min的流速洗脱,收集洗脱液于蒸发皿中,冻干并于-18℃保存。测定前用超纯水溶解并定容至10 mL,经0.22 μm滤膜过滤后测定。
2.2 离子对色谱及液质条件
2.2.1 离子对色谱条件
流动相∶甲醇-水(60∶40,0.4%正戊胺,用甲酸调pH至4.5);流速:1.0 mL/min;柱温:35℃;进样量:20μL。
ELSD参数:雾化气体:压缩空气;漂移管温度:110℃;流量:2.5 L/min;增益:1。
2.2.2 液质条件
液相:同2.2.1略有差异,由于质谱对流动相离子化的要求,流动相调整为甲醇-水(60∶40,0.4%正戊胺,1%乙酸),进样量:10μL。
质谱:电喷雾离子源(ESI):负离子扫描模式,雾化气N2∶25 psi,干燥气N2∶9 psi,毛细管温度:350℃,扫描范围:100~2 000 m/z。
2.3 植酸标准溶液和水解液的制备
植酸钾中磷元素的含量为24%,1mg植酸钾固体中植酸的含量为0.86mg。因此,储备液的制备可以准确称取0.059 0 g植酸钾纯品于10 mL容量瓶中,加超纯水溶解并定容至刻度,作为标准品储备液,冰箱4℃保存。
植酸水解液:取一定浓度的植酸钾储备液于试管中,水浴120℃加热2 h,得到植酸不完全水解液,用于质谱对植酸降解产物的分析。
3 结果与分析
3.1 样品前处理方法的优化
3.1.1 提取条件的优化
通过单因素试验和响应面试验优化了植酸提取的前处理方法。首先比较了盐酸-水、盐酸-甲醇及盐酸-丙酮溶液3种提取剂对植酸的提取效果,并在此基础上对提取液浓度、提取时间及提取温度进行了优化。试验结果显示,盐酸水溶液对植酸的提取效果较好(提取率达1.27%),优化得到的提取条件为盐酸浓度0.7 mol/L,提取时间1 h,提取温度30℃。
3.1.2 纯化条件的优化
提取后得到的溶液中杂质较多,尤其是含有的无机磷酸盐,会使测试结果偏高。通过纯化可以对样品进行有效的净化和富集。试验通过考察阴离子交换树脂的吸附洗脱性能,确定了树脂的用量(1 g树脂~60mg植酸)及洗脱液体积(1 g树脂~30 mL洗脱液)。经过色谱分析,纯化后得到的植酸粗产品中基本无杂质峰,见图1。

图1 ELSD检测样品中植酸及其降解产物色谱图
3.2 离子对色谱法的建立
3.2.1 检测器的选择
以甲醇和水为流动相,采用液相DAD检测器在200~400 nm波长范围对其进行3D图谱采集,结果显示,植酸在200~400 nm范围内无明显吸收,与运用紫外-可见分光光度计进行全波长扫描得到的结果一致。因此,从小麦中提取得到的植酸无紫外吸收,不宜用紫外检测器进行直接检测。
蒸发光散射检测器是通用型质量检测器,不依赖于物质的光学特性,对检测室中的非挥发性化合物也具有响应[12],可用于测定植酸及可能存在的降解产物。如图1,蒸发光散射检测器对样品中的植酸及其降解产物存在响应,检测效果良好。
3.2.2 流动相及离子对试剂的选择
植酸为离子型化合物,极性较大,在反相键合相色谱柱上的保留时间相对较短,难以与液相色谱柱死时间进行区分。选择甲醇-水为流动相,随着甲醇比例的增大,植酸的保留时间略有延长。调整甲醇和水的比例对样品进行分离时,植酸及其降解产物在甲醇60%时分离效果较佳,但始终不能完全分离。综合出峰时间及分离度2个因素考虑,确定流动相基本组成为甲醇-水(60∶40)。
在流动相中添加离子对试剂可以增加溶质与非极性固定相的作用,使分配系数增加,改善分离效果。试验选用了不同的离子对试剂,包括广泛用于酸性化合物分析的四丁基氢氧化铵溶液以及正戊胺溶液。结果表明,铵盐溶液由于不具有挥发性,因此在蒸发光散射检测器内产生较大的噪音,不适合直接检测。正戊胺溶液易挥发,且对植酸的分离和保留效果良好,见图2。

图2 流动相中加入正戊胺后的分离及保留图
3.2.3 流动相离子对浓度及pH优化
试验考察了离子对试剂正戊胺的浓度及流动相pH值对植酸保留及样品分离效果的影响。结果显示,植酸的保留时间随离子对浓度的增加而增加。低浓度时,保留及分离效果不理想;高浓度时,峰明显变宽并发生拖尾,如图3。

图3 流动相中离子对浓度对分离及保留效果的影响
C18柱pH使用范围一般为2~9。植酸呈酸性,应调节流动相的pH为酸性以抑制其解离,增加在固定相上的保留。选用甲酸调节流动相的pH值,可同时改善峰形。流动相pH过低时,保留时间较短,如图4。

图4 流动相pH对样品分离及保留效果的影响
综合保留时间、分离度及峰形等因素,确定色谱条件为:甲醇-水(体积比60∶40,含有0.4%正戊胺,甲酸调节pH为4.5),流速为1.0 mL/min,柱温35℃。在该条件下,标准品及样品中各组分完全分离,峰形良好,如图5。

图5 植酸标准品与样品的色谱图
3.2.4 植酸及杂质峰定性
运用质谱对植酸标准品及试验样品进行分析。由于色谱条件略有改变及仪器本身的差异,在两台液相色谱仪上出峰时间以及峰形上略有差异,但整体峰图一致。
对植酸钾标准溶液进行直接进样MS分析和色谱柱分离后MS检测分析,得到的ESI质谱图如图6所示。其中,经色谱分离后得到的主峰的质谱图(图6b)与直接进样所得到的质谱图(图6a)一致。
对纯化浓缩后得到的样品进行LC-MS分析,得到各个峰的质谱图。结果表明,样品中主峰[植酸峰(IP6)峰]的质谱图(图6c)与纯品基本一致,证明该峰为植酸峰。图5a中的IP5峰质谱图(图6d)通过质谱解析得出。此外,经过液相空白进样及质谱定性,表明样品中的图5a中的杂质峰为进样峰。

图6 植酸及杂质峰质谱图
3.2.5 离子对色谱法分离效果考察
植酸在自然界中比较稳定,样品中的植酸可能会受到某些因素(如生长环境、加工方式等)的影响而发生降解,所以不同样品中植酸降解产物的种类和含量各有不同。为了进一步了解该离子对色谱方法对植酸及其降解产物的分离、检测效果,运用2.2的色谱及质谱条件对2.3中制备好的植酸水解液进行分析,得到的色谱图如图7所示。
经过色谱分析,植酸水解液出现4个组分峰,其中2个与样品中的IP5、IP6一致。经过质谱解析,4个组分峰丰度值最强的质荷比依次为398.9、499.0、578.7、658.7,依次对应IP3、IP4、IP5、IP6,前三者分别为植酸钾纯品的各级水解产物。4个峰的分离度值依次为2.27,3.15,3.91,2.87,由此可见,该方法对于植酸及其多级降解产物的分离效果良好。

图7 植酸水解液的色谱图
3.3 线性范围考察及检出限、定量限测定
取已制备的5mg/mL标准储备液逐级稀释,得到标准系列的最终质量浓度分别为0.25、0.5、1、2、4、5mg/mL。按2.2.1色谱条件,取各浓度标准品溶液进样20μL,以峰面积为纵坐标,以质量浓度为横坐标绘制标准曲线。结果表明,植酸钾在0.25~5.0mg/mL内线性关系良好,线性方程为y=262.79-69.115,R2=0.999 1。
将标准储备液逐步稀释并进样,并以信噪比为3时对应的植酸浓度为检出限(LOD),信噪比为10时对应的植酸浓度为定量限(LOQ)。结果为检出限40 μg/mL,定量限70μg/mL。
3.4 精密度试验
取植酸的标准品溶液,按2.2.1色谱条件进样20μL,连续进样6次,测定各自的峰面积,植酸峰面积平均值为58.126 5,计算得到植酸的RSD为2.01%,表明该方法具有良好的精密度。
3.5 重复性试验
称取相同质量的粉碎过筛后的麦粉6份,按2.1的方法进行样品前处理,并按2.2.1的方法进样测定,记录峰面积,得到的峰面积平均值为193.238 2相对标准偏差为1.90%,表明该方法具有良好的重复性。
3.6 稳定性试验
取一份3.5中得到的样品溶液(4℃低温、避光贮存),在2.2.1的色谱条件下,分别于0、2、4、6、8 h进样20μL,记录植酸的峰面积,峰面积平均值为205.168 8,相对标准偏差为2.40%,表明植酸溶液在上述储存条件下的稳定性较好。
3.7 加标回收率试验
精确称取已知植酸含量的同一样品3份,分别向其中添加一定量的植酸钾纯品,并按2.1方法制备液相待检溶液,按2.2.1离子对色谱方法进样测定植酸含量并计算回收率。试验结果见表1,植酸的平均回收率为90.44%,RSD为3.13%,回收效果在可接受范围内。
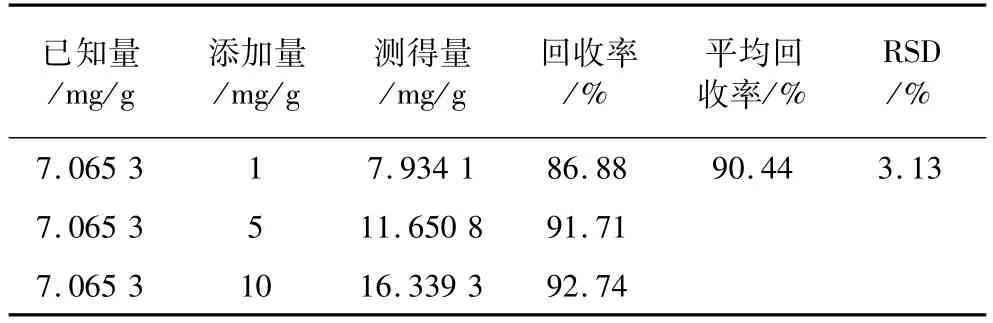
表1 加标回收试验结果
3.8 样品色谱图
以小麦麸为试验材料,经植酸提取、分离及纯化的样品前处理后,用建立的离子对色谱-蒸发光散射检测法测定植酸的样品色谱图如图8所示。

图8 样品色谱图
4 结论
以小麦麸为试验材料,选择和优化了植酸提取、分离及纯化的样品前处理技术,使植酸及其多级降解产物得到了有效的分离,获得了纯度较高的植酸产品,建立了离子对色谱-蒸发光散射检测法测定植酸含量的方法。本研究建立的HPLC方法精密度、重复性及稳定性良好,由于麦类的结构与组分类别相似,因此前处理及检测方法适用于大麦、燕麦等麦类中植酸含量的检测。
[1]Reddy N R,Sathe SK,Salunkhe D K.Phytates in legumes and cereals[J].Advances in Food Research,1982,28:1-92
[2]Alabaster O,Tang Z,Shivapurkar N.Dietary fiber and the chemopreventive modelation of colon carcinogenesis[J]. Mutation Research,1996,350:185-197
[3]Cosgrove D J.The chemistry and biochemistry of inositol phosphates[J].Advances in Pure and Applied Chemistry,1966,16:209-224
[4]Patearroyo M A,Fernandez-Quintela C C.Sustancias antinutritivas en alimentos de origen vegetal[J].Su significado en la alimentacion humana.Alimentaria,1995,6:115-120
[5]吴澎,田纪春,王凤成.谷物中植酸及其应用的研究进展[J].中国粮油学报,2009,3(24):137-143
[6]Lolas G M,Palamids N,Markakis P.The phytic acid,total phosphorus relationship in barley,oats,soybeans,and wheat[J].Cereal Chemistry,1976,53:867-871
[7]Latta M,Eskin M.A simple and rapid colorimetric method for phytate determination[J].Journal of Agricultural and Food Chemistry,1980,28:1313-1315
[8]蒋晔,谢赞,张嫡群.离子对反相高效液相色谱法测定阿仑膦酸钠含量及其有关物质[J].分析化学研究简报,2006,6(34):835-838
[9〛廖明星,顾振新,麻浩,等.大豆植酸分离方法对测定结果的影响[J].食品与发酵工业,2003,29(5):37-40,44
[10]Lee K,Abendroth JA.High performance liquid chromatographic of phytic acid determination in foods[J].Food Science,1983,48:1344-1345
[11]Hee-Ra Park,Hyun-Joo Ahn,So-Hee Kim,etal.Determination of the phytic acid levels in infant foods using different analytical methods[J].Food Control,2006,17:727-732
[12]魏泱,丁明玉.蒸发光散射检测技术[J].色谱,2000,5(18):398-401.
Determination of Phytic Acid in Triticeae Crops by Ion-Pair High-Performance Liquid Chromatography with ELSD
Yuan Jian Wang Yan Fan Zhe Li Qian He Rong JuXingrong
(College of Food Science&Engineering,Nanjing University of Finance and Economics,Nanjing 210046)
An ion-pair HPLC-ELSDmethod has been established through the research in the paper for determination of phytic acid in triticeae crops,which was combined with ESI-MS to identify the components.A C18 column(5μm,4.6 mm×150 mm,column temperature 35℃)was used jointly with themobile phase ofmethanolwater(60∶40,0.4%n-pentylamine,formic acid pH 4.5),at a flow rate of 1.0 mL/min.The calibration curve expressed a good linearity in the range of 0.25~5.0mg/mL(R2=0.999 1).The detection limit was 40μg/mL,and average recovery of 91.11%with RSD of 5.94%.Themethod is rapid and accurate,which is appropriate for the detection of phytic acid in triticeae crops.
IPC-ELSD,detection,triticeae crops,phytic acid
O657.7+2
A
1003-0174(2015)
863计划(2012AA101609)
2013-11-26
袁建,男,1965年出生,教授,食品质量与安全03-0128-06
