酶解工艺对燕麦浆稳定性和糖组分的影响
2015-12-18汪丽萍,朱亚婧,冯叙桥等
酶解工艺对燕麦浆稳定性和糖组分的影响
汪丽萍1朱亚婧1,2冯叙桥2谭 斌1
(国家粮食局科学研究院1,北京 100037)(沈阳农业大学2,沈阳 110866)
淀粉酶解是解决燕麦浆稳定性下降的一种有效手段,研究了α-淀粉酶和糖化酶酶解工艺对燕麦浆稳定性的影响,确定了最优的酶解工艺条件,并对比分析了2种酶酶解后燕麦浆中糖组分的变化情况。结果表明,使用0.5%α-淀粉酶70℃酶解1.0 h和使用0.8%糖化酶40℃、pH 4.0~5.0酶解4.0 h时的燕麦浆稳定性最好,α-淀粉酶酶解的浆液酶解效果和稳定性均优于使用糖化酶的浆液。α-淀粉酶酶解后的燕麦浆中糖组分以葡萄糖和麦芽低聚糖为主;糖化酶酶解的燕麦浆中糖组分几乎全部为葡萄糖。α-淀粉酶酶解是较好的一种酶解工艺。
燕麦浆 稳定性 糖组分 α-淀粉酶 糖化酶
谷物杂粮饮品近年来发展迅速,市场占有率逐步扩大,正逐渐成为新兴的饮料发展方向。但是谷物饮品是一个富含碳水化合物、蛋白质、脂肪等的复杂基质体系,经过较长时间的存放后易出现分层、沉淀等不稳定现象,造成饮品感官品质的下降。因此,体系的稳定性一直是加工和贮藏中需要攻克的难题,在加工过程中提高浆液体系的稳定性十分重要。造成谷物饮品不稳定的原因主要是由于谷物原料中淀粉含量较高,淀粉易老化凝胶,形成沉淀而分层。在饮料加工过程中,对淀粉进行适度水解可以很好的解决淀粉的凝胶沉淀,同时还能减轻淀粉的味感,改善饮品的品质[1]。目前,对于水解淀粉提高谷物饮品稳定性的研究主要集中于利用α-淀粉酶进行液化提高溶解度、降低颗粒细度[2-4]。而糖化酶也是常用的一种淀粉水解酶,在小曲酒酿造中使用糖化酶可以提高淀粉利用率、增加产量[2];在啤酒生产中应用糖化酶可提高麦汁可发酵糖的比例[3]。在谷物饮品加工中,糖化酶多和液化酶配合使用提高酶解效率,在苦荞饮料加工酶解时先液化后再进行糖化,可明显提高葡萄糖值(DE值)和黄酮提取率[4]。本试验以燕麦为原料制成燕麦浆,分别研究了α-淀粉酶和糖化酶的酶解工艺条件对燕麦浆稳定性的影响,使用LUMisizer稳定性分析仪比较了不同酶解工艺条件下浆液的稳定性[5],同时对浆液的可溶性固形物含量进行了测定,比较了2种酶作用后浆液的稳定性和可溶性固形物含量,确定了最佳酶解工艺。试验还使用离子色谱法分别对未酶解和使用α-淀粉酶、糖化酶获得的燕麦浆进行了糖谱测定,分析了经过不同酶制剂酶解前后的燕麦浆中糖谱的变化情况,以期对实际生产中酶制剂的选择和酶解工艺的确定起到一定的指导意义。
1 材料与方法
1.1 材料与设备
1.1.1 材料
优选燕麦米:吉林普康有机农业有限公司;α—淀粉酶:北京奥博星生物技术有限责任公司;糖化酶:江苏博立生物制品有限公司;D-葡萄糖(≥99.9%)、D-麦芽糖(≥99%)、D-麦芽四糖(≥96%)、D-麦芽五糖(≥95%)、D-麦芽六糖(≥93%)、D-麦芽七糖(≥94%):SUPELCO公司;D-果糖(≥99.5%)、D-蔗糖:CHEM SERVICE公司;D-半乳糖(≥99%)、D-鼠李糖(≥99%)、D-阿拉伯糖(≥98%)、D-阿拉伯糖(≥98%)、NaAc(≥99%):sigma公司;D-甘露糖(≥99.5%):Fluka公司;D-麦芽三糖(≥98%):TCI公司;离子色谱用水为超纯水。
1.1.2 设备
Dispersion Analyser Lumisizer 611稳定性分析仪:德国L.U.M.GmbH公司;Dionex ICS3000离子色谱仪(配脉冲安培检测器):美国戴安公司;Milli-Q超纯水整体净化系统:美国Millipore公司;OnGuard II固相萃取柱:美国Dionex公司;0.22μm水相尼龙针式滤器:上海安谱科学仪器有限公司;JJ-1精密定时电动搅拌器:江苏省金坛市荣华仪器制造有限公司;WYA-2WA1阿贝折射仪:上海易测仪器设备有限公司。
1.2 试验方法
1.2.1 燕麦浆的制作
燕麦经过清理和筛选,放入烘箱中150℃烘烤40 min,期间不时翻动以防烤焦。烘烤后燕麦呈金黄或黄褐色,伴有烘烤后特有的燕麦香气。烤好的燕麦放入清水中浸泡13~15 h[6]。将浸泡后的燕麦沥水后以一定的加水比放入组织捣碎机打浆,先低速20 s,后高速60 s;打浆后过200目筛。
1.2.2 燕麦浆的酶解
将300 mL燕麦浆置于酶解罐中,在一定的温度和pH条件下加入一定量的淀粉酶进行恒温酶解,酶解过程中用搅拌器不停的搅拌,防止底部凝块;酶解结束后煮沸灭酶活,并过筛去掉浮沫和较大的颗粒,得到燕麦浆的酶解液[7],测定可溶性固形物含量和稳定性指标。
1.2.3 稳定性指标的测定
使用Lumisizer稳定性分析仪对不同酶解条件下得到的燕麦浆酶解液进行稳定性比较。仪器采用Stokes Law的离心加速方法和Lambert-Beer Law光学技术监测样品的稳定性、全程分离步骤、沉降及悬浮并存的复杂分离行为[8]。在软件设定检测条件(温度、离心转速、光散射系数、扫描间隔时间、扫描次数)后,软件记录每隔一定时间样品在离心作用下每个位置的红外透光率并绘制谱线,如图1所示为25℃、离心转速3 500 r/min、光散射系数1.00条件下,每10 s扫描1次,共扫描200次的透光率变化图(本试验所有稳定性指标的测定均采用此检测条件),图1中横坐标为样品管的位置:左侧为样品管顶部,右侧为样品管底部。样品管水平放置在仪器中(管顶在中心,管底在外侧),在离心作用下,样品中的沉淀逐渐沉积在管底。图谱中的谱线以红色开始,逐渐向绿色过渡。从图1中可以看出,浆液中主要呈现出沉降行为。此外,软件还生成积分透光率(Integral Transmission)对时间(Time)的曲线,如图2,并给出曲线的斜率值。通过斜率值的大小比较样品的稳定性。斜率值越大,在一定的时间内样品的透光率变化越快,即样品的移动分层速度变化越快,样品越不稳定;反之斜率值越小,样品越稳定。
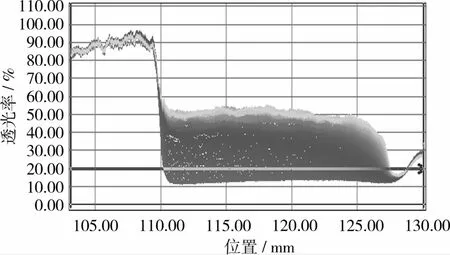
图1 稳定性分析仪光信号图谱
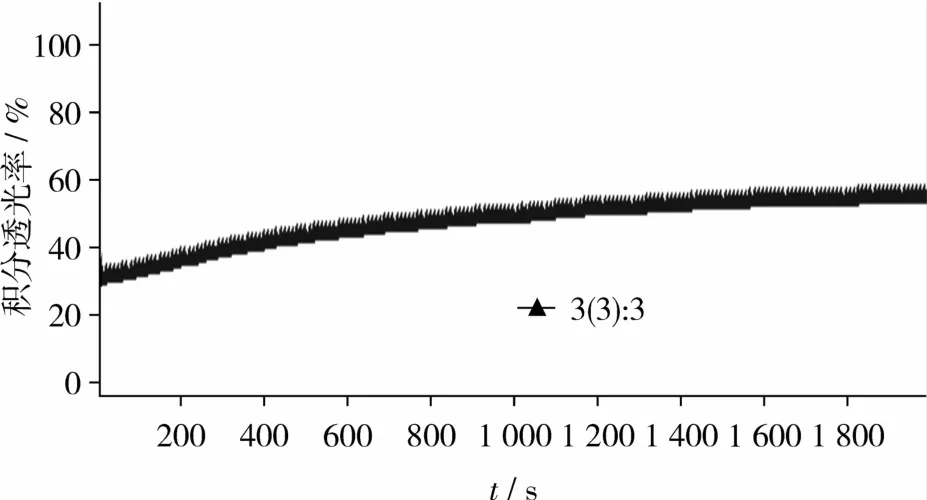
图2 稳定性分析仪积分曲线
1.2.4 可溶性固形物含量测定
参照GB 12143.1—1988折光计法[9-10]。
1.2.5 离子色谱条件
样品前处理方法:用超纯水稀释样品10倍,摇匀后通过0.22μm尼龙滤膜和OnGuard IIRP小柱(2.5 mL,小柱使用前预先用10 mL甲醇和15 mL水进行活化),弃去起初的6 mL后收集2 mL样品用于测定[11-12]。
单糖测定色谱条件:色谱柱:CarboPac PA10阴离子交换柱,包括分离柱(4 mm×250 mm)和保护柱(4 mm×50 mm);淋洗条件:15 mmol/L NaOH等度洗脱,淋洗液速度:0.5 mL/min;柱温:30℃;进样体积:25μL;检测条件:采用四电位脉冲安培检测[11]。
低聚糖测定色谱条件采用潘媛媛等[12]对啤酒和麦汁中糖的检测色谱条件。
1.2.6 数据分析
数据处理采用SPSS软件分析。
2 结果与分析
2.1 燕麦浆加水比的确定
取一定量(100 g)烘烤后的燕麦,按照不同加水比进行磨浆,测定可溶性固形物含量[13],结果见表1。

表1 不同加水比对原料浸出物、组织状态和口感的影响
从表1可以看出,随着加水量的增加,可溶性固形物的浓度逐渐减少,但是总的转移到液相中可溶性成分有所增加。当加18倍水时,加水量过大,转移到液相中的有效成分增加量有限,过大的加水比使液相中的可溶性固形物的浓度降低。此外,加水过多或过少也会造成浆液的组织状态过于浓稠或稀薄、口感过于厚重或寡淡。因此,综合考虑以上因素,磨浆加水比以1∶12为宜。此时转移到液相中的总可溶性固形物含量达到13 g,可溶性固形物浓度为1.0%。
2.2 α-淀粉酶酶解条件对燕麦浆稳定性的影响
2.2.1 α-淀粉酶添加量对浆液稳定性的影响
固定酶解温度50℃、酶解时间1.0 h。α-淀粉酶加酶量为0.08%、0.10%、0.30%、0.50%、0.70%、0.90%时,燕麦浆稳定性和可溶性固形物含量变化见表2。从表2可以看出,随着加酶量的提高,浆液的稳定性先下降后上升。加酶量在0.10%以下和0.70%以上时,稳定性不再有显著变化。0.30%加酶量时的浆液稳定性最差。随着酶量的逐渐增加,可溶性固形物含量逐渐上升,起初上升较为缓慢,当加酶量为0.50%时,固形物含量显著提高,此后酶量继续增加,可溶性固形物含量不再有显著变化,这表明0.50%的加酶量已达到完全水解浆液中淀粉的要求。因此,α-淀粉酶的最适加酶量为0.50%,此时燕麦浆中可溶性固形物含量不再上升,浆液也较稳定。
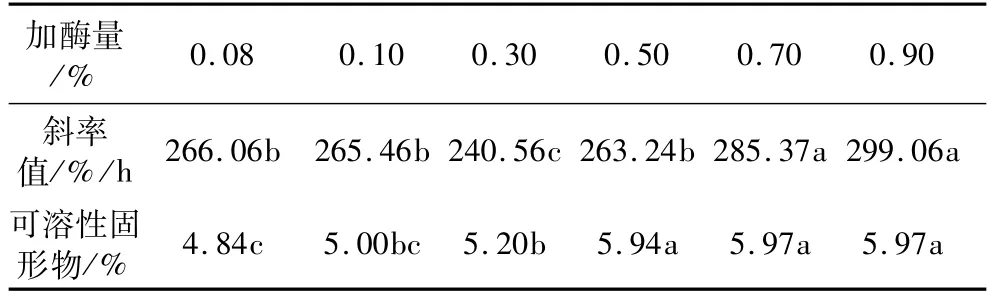
表2 α-淀粉酶不同加酶量各指标差异性分析
2.2.2 α-淀粉酶酶解时间对浆液稳定性的影响
固定酶的添加量0.5%、酶解温度50℃。α-淀粉酶酶解时间为0.5、1.0、1.5、2.0 h时燕麦浆的稳定性和可溶性固形物含量变化见表3。从表3可以看出,随着酶解时间的延长,斜率值先下降后上升,酶解时间不同,稳定性结果间差异明显,酶解1.0 h时浆液稳定性最高。随着酶解时间的延长,可溶性固形物的含量先上升后下降,造成这种趋势的原因可能是随着酶解时间的延长,淀粉水解达到动态平衡,而此时浆液中的蛋白质等成分因长时间加热逐渐变性析出,使得可溶性固形物总量逐渐下降。当酶解时间超出1.5 h后,可溶性固形物含量的下降不再显著。从2个指标来看,α-淀粉酶酶解时,最适酶解时间为1.0 h。
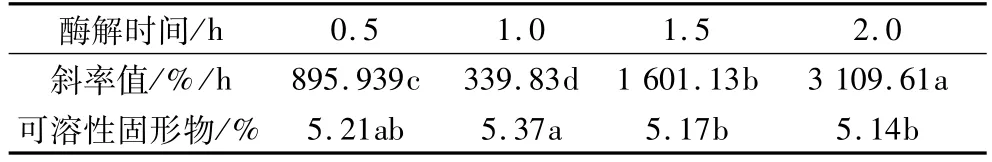
表3 α-淀粉酶不同酶解时间各指标差异性分析
2.2.3 α—淀粉酶酶解温度对浆液稳定性的影响
固定酶的添加量为0.5%、酶解时间1.0 h。α-淀粉酶酶解温度为40、50、60、70、80℃时,燕麦浆稳定性和可溶性固形物含量变化见表4。从表4可以看出,随着酶解温度的上升,稳定性不断上下波动。50℃和70℃酶解时稳定性较高。随着酶解温度的升高,可溶性固形物含量起初快速增加,后变化不大。70℃条件下的浆液稳定性和可溶性固形物含量略好于50℃酶解的浆液,因此,α-淀粉酶酶解时的最适酶解温度为70℃。
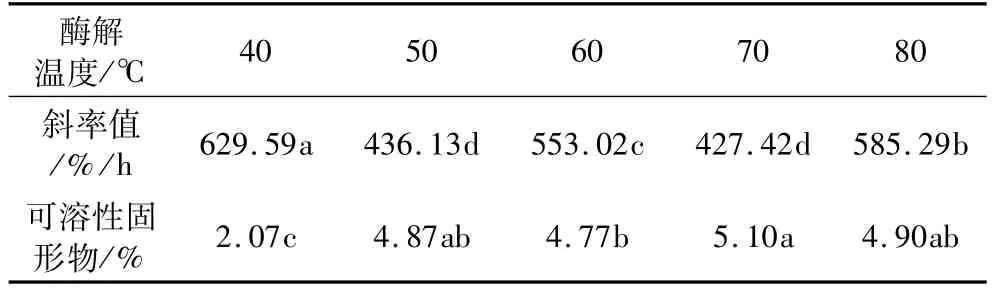
表4 α-淀粉酶不同酶解温度各指标差异性分析
2.3 糖化酶酶解条件对燕麦浆稳定性的影响
2.3.1 糖化酶添加量对浆液稳定性的影响
固定酶解温度40℃、酶解时间1.0 h、pH 5.0,糖化酶加酶量为0.05%、0.20%、0.40%、0.60%、0.80%、1.00%时,燕麦浆稳定性和可溶性固形物含量变化见表5。从表5可以看出,随着酶的添加量逐渐增加,可溶性固形物含量呈整体上升趋势,加酶量为0.80%时,可溶性固形物含量达到最大值,之后继续增加酶用量,可溶性固形物含量不再继续增加。随着加酶量的增加,斜率值的变化较大。糖化酶量小于0.40%时,随着酶量增加稳定性下降;酶量在0.40%~0.80%时,随着酶量的增加,浆液的稳定性逐渐提高;之后酶量继续增加,稳定性下降明显。这可能是由于加酶量在0.80%时,可溶性固形物含量已达到最大值,酶量已接近饱和,若继续增加酶用量,可溶性固形物含量不再增加,不溶的酶颗粒造成稳定性的下降。因此,综合考虑稳定性和可溶性固形物2个因素,糖化酶最适加酶量为0.80%。
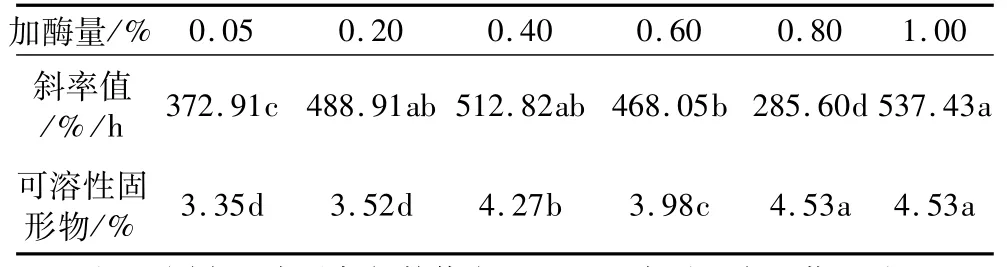
表5 α-淀粉酶不同酶解温度各指标差异性分析
2.3.2 糖化酶酶解pH对浆液稳定性的影响
固定酶的添加量0.8%、酶解温度40℃、酶解时间1.0 h,糖化酶酶解pH为3.0、4.0、5.0、6.0时,燕麦浆稳定性和可溶性固形物含量变化见表6。从表6可以看出,随着pH的逐渐变大,酸性逐渐减弱,斜率值先下降后上升,pH 4.0和pH 5.0时,饮品的稳定性最好;可溶性固形物含量随酸性减弱逐渐上升,pH 3.0时可溶性固形物含量低,pH 4.0~6.0时可溶性固形物含量较高,且没有明显差异。因此,糖化酶酶解的最适酶解pH为4.0~5.0。

表6 糖化酶不同pH各指标差异性分析
2.3.3 糖化酶酶解温度对浆液稳定性的影响
固定酶的添加量0.8%、酶解时间1.0 h、pH 4.0,糖化酶酶解温度为30、40、50、60℃时,燕麦浆稳定性和可溶性固形物含量变化见表7。从表7可以看出随着酶解温度的上升,可溶性固形物含量波动较大,40℃时含量最高。斜率值则随温度上升先下降后上升,在40℃的斜率值最小,稳定性最好。因此,糖化酶的最适酶解温度为40℃。

表7 糖化酶不同酶解温度各指标差异性分析
2.3.4 糖化酶酶解时间对浆液稳定性的影响
固定酶的添加量0.8%、酶解温度40℃、pH 5.0,糖化酶酶解时间为1.0、2.0、3.0、4.0、5.0 h时,燕麦浆稳定性和可溶性固形物含量变化见表8。从表8可以看出,随着酶解时间的延长,斜率值逐渐下降,稳定性逐渐上升。酶解超出4.0 h后,稳定性上升不显著。可溶性固形物含量呈先下降后上升的趋势,同稳定性一样,超过4.0 h后继续酶解,可溶性固形物的含量不再显著上升。因此,使用糖化酶酶解燕麦浆时,最适酶解时间为4.0 h。
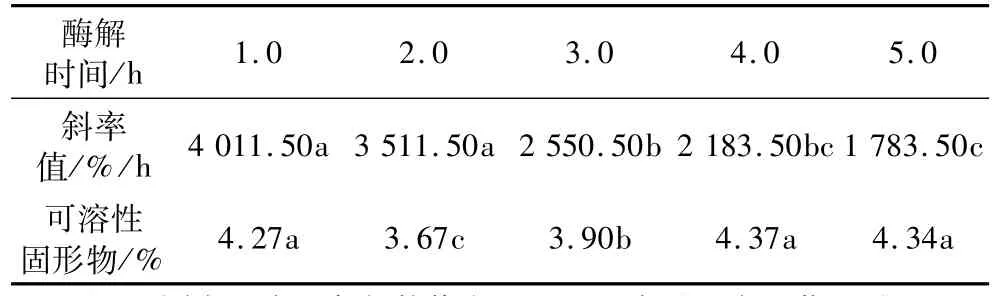
表8 糖化酶不同酶解时间各指标差异性分析
2.4 α-淀粉酶和糖化酶酶解效果比较
将A、B 2组燕麦浆分别用α-淀粉酶和糖化酶在其最佳酶解条件下进行酶解,即A组添加0.50%的α-淀粉酶在70℃下酶解1.0 h,B组添加0.80%的糖化酶在40℃、pH 4.0条件下酶解4 h。分别测定A、B 2组燕麦浆的稳定性和可溶性固形物含量(见表9)。由表9中数据发现,使用α-淀粉酶酶解的A组稳定性好,且酶解后浆液中可溶性固形物含量高,酶解效果明显优于使用糖化酶酶解的B组。
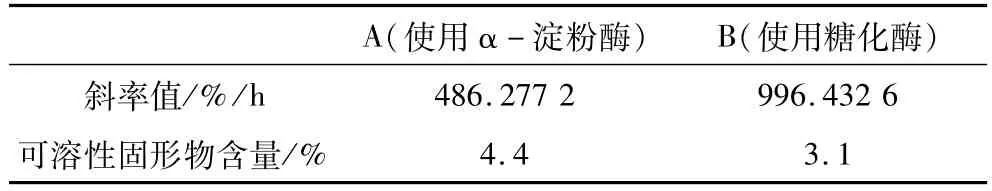
表9 α-淀粉酶和糖化酶酶解效果比较
2.5 不同淀粉酶酶解燕麦浆的糖组分分析
试验分别对未酶解、使用0.5%α-淀粉酶70℃条件下酶解1.0 h和使用0.8%糖化酶40℃、pH 4.0条件下酶解4.0 h的燕麦浆进行单糖和低聚糖糖组分的分析。
2.5.1 燕麦浆单糖组分分析
单糖糖分的离子色谱图见图3。从图3可以看出,未经酶解的燕麦浆单糖主要以阿拉伯糖和葡萄糖为主,此外还含有少量的半乳糖和痕量的鼠李糖、果糖;燕麦浆经α-淀粉酶处理后,单糖成分以葡萄糖为主,还有少量阿拉伯糖和痕量的鼠李糖、果糖;糖化酶处理过的燕麦浆中,单糖主要是葡萄糖,阿拉伯糖和果糖含量与葡萄糖含量差距非常大。

图3 单糖测定的离子色谱图
为了更直观的反映出酶解处理后燕麦浆中单糖成分的变化,将3组燕麦浆中各单糖含量作图4,从图4可看出,燕麦浆中的单糖以葡萄糖为主要成分,还含有部分阿拉伯糖,果糖、半乳糖等其他单糖成分含量较低。经过酶解处理后的燕麦浆中单糖含量明显增加,单糖总量的增加主要体现在葡萄糖含量的增加。使用糖化酶处理的样品比使用淀粉酶处理的样品单糖含量增加更显著。
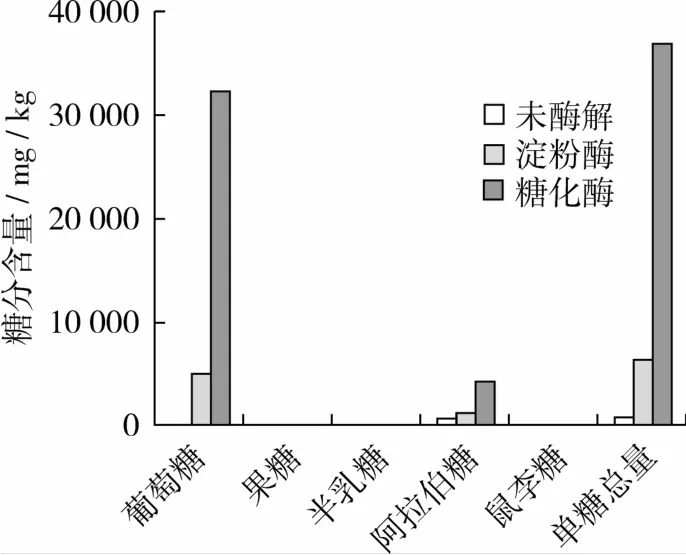
图4 燕麦浆中单糖的变化
2.5.2 燕麦浆低聚糖组分分析
燕麦浆中低聚糖糖分的离子色谱图见图5。从图5可以看出,未经酶解的燕麦浆低聚糖主要以蔗糖为主,此外还含有少量的蜜三糖和麦芽糖;燕麦浆经α-淀粉酶处理后,低聚糖主要以麦芽低聚糖(麦芽糖~麦芽五糖)形式存在;糖化酶处理过的燕麦浆中,低聚糖只有极少量的蔗糖。
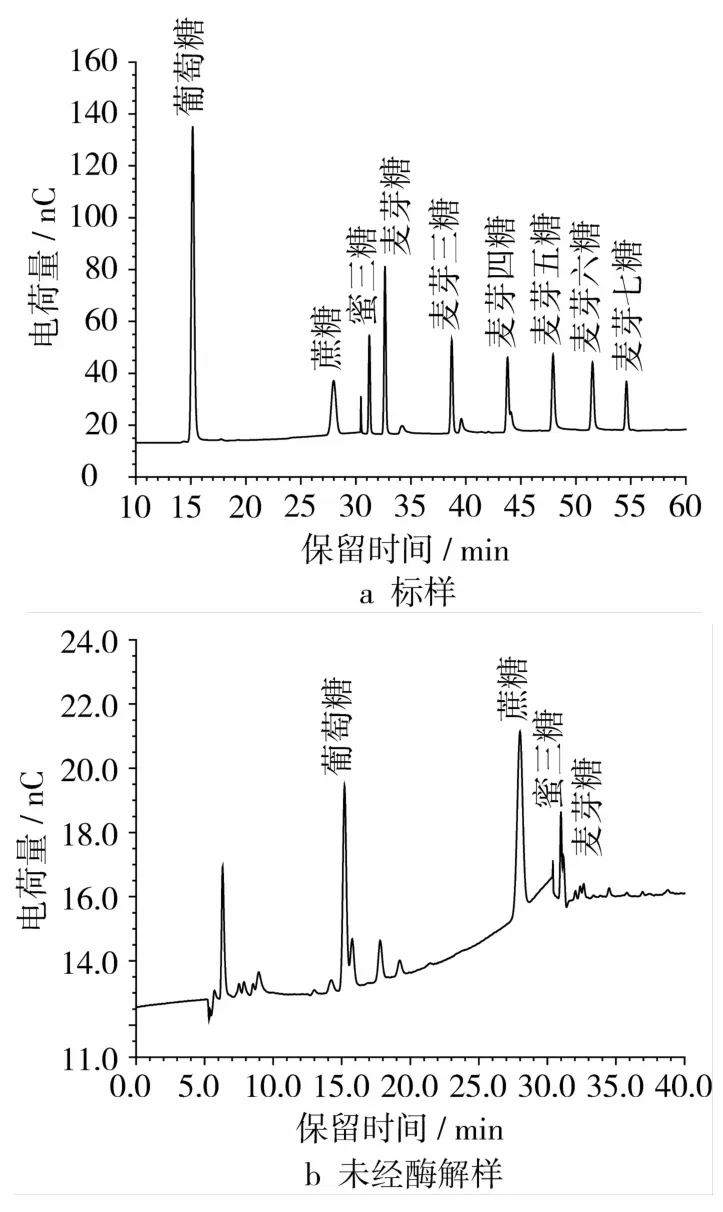
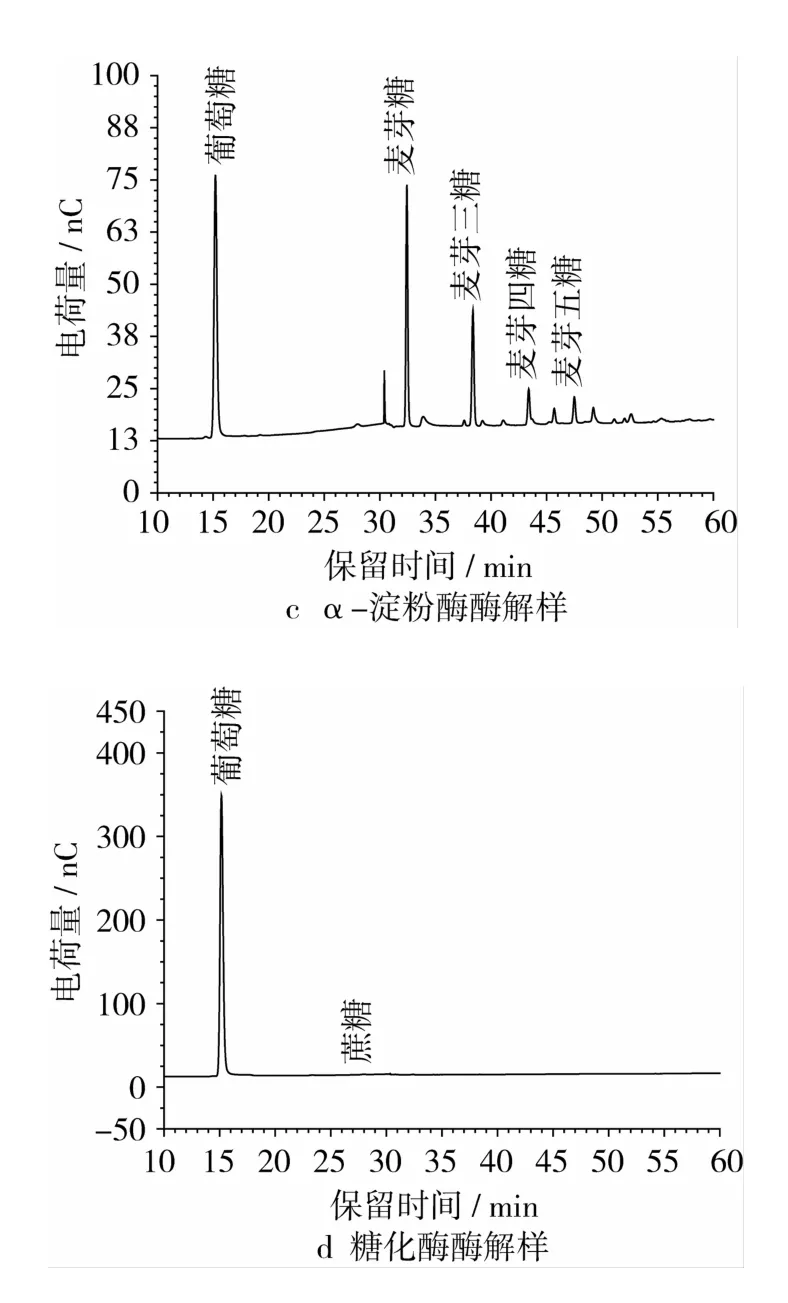
图5 葡萄糖、低聚糖离子色谱图
为了更直观的反映出酶解处理后燕麦浆中低聚糖成分的变化,将3组燕麦浆中各低聚糖含量作图6,由图6可看出,经α-淀粉酶酶解后,燕麦浆中的淀粉除了被水解为葡萄糖外,还积累了麦芽低聚糖,而糖化酶酶解后的产物几乎全部为葡萄糖。这主要是由于2种酶的作用方式不同导致的,α-淀粉酶在切断糖苷键时是随机的,产物中会积累大量葡萄糖和麦芽低聚糖,而糖化酶是从淀粉末端逐个切断糖苷键,因此糖化酶的产物几乎全部为葡萄糖。

图6 燕麦浆中糖分的变化
3 讨论
从试验结果可以看出,使用α-淀粉酶和糖化酶酶解后的燕麦浆糖组分发生较大变化,使用α-淀粉酶酶解的样品中有葡萄糖还有一些低聚糖,而糖化酶酶解后的样品中只有葡萄糖。造成这种情况的原因主要是α-淀粉酶和糖化酶在酶解淀粉颗粒时的作用方式不同。α-淀粉酶既作用于直链淀粉,亦作用于支链淀粉,无差别地切断α-1,4糖苷键,终产物在分解直链淀粉时以麦芽糖和葡萄糖为主,分解支链淀粉时,除麦芽糖和葡萄糖外还有部分糊精。而糖化酶从淀粉分子的非还原性末端水解α-1,4葡萄糖苷键,也能缓慢水解α-1,6糖苷键,转化为葡萄糖。此外,使用α-淀粉酶酶解的样品稳定性高于糖化酶酶解的样品,可能是由于α-淀粉酶酶解后的样品中含有较多的麦芽低聚糖成分,与糖化酶酶解后形成的葡萄糖样品相比,黏度较高,对饮品起到了增稠稳定的作用。
4 结论
4.1 燕麦浆的磨浆加水比以1∶12为宜。此时转移到液相中的总可溶性固形物含量达到13 g,可溶性固形物浓度为1.0%。
4.2 使用α-淀粉酶酶解燕麦浆时,最适加酶量为0.5%、最适酶解时间为1.0 h、最适酶解温度为70℃;使用糖化酶酶解燕麦浆时,最适加酶量为0.8%、最适酶解时间为4.0 h、最适酶解温度为40℃,最适pH 4.0~5.0;最适酶解条件下,α-淀粉酶酶解后的燕麦浆稳定性和可溶性固形物含量均优于糖化酶酶解的浆液。
4.3 使用α-淀粉酶酶解后的燕麦浆中糖组分以葡萄糖和麦芽低聚糖(麦芽糖~麦芽五糖)为主;使用糖化酶酶解的燕麦浆中糖组分几乎全部为葡萄糖。
[1]Kaahwa A R,Okoth M W,Imungi JK.The effect of homogenisation,stabiliser and amylase on cloudiness of passion fruit juice[J].Food Control,2000(11):305-311
[2]赵金松,罗惠波,吴士业.糖化酶在清香型小曲酒生产中的应用[J].食品科技,2006(3):94-95
[3]左永泉.应用糖化酶制干啤酒的研究[J].四川食品与发酵,1997(4):37-40
[4]马坤,张晖,王立.苦荞麦饮料的酶解工艺研究[J].食品工业科技,2009,30(10):265-269
[5]Tomás M C,ScuriattiM P,Wagner JR.Influence of soybean protein isolates-phosphatidycholine interaction on the stability on oil-in-water emulsions[J].Journal of Oil&Fat Industries,2003,80(11):1093-1100
[6]黄艾祥,杨振生,董文明.营养燕麦乳的研制[J].食品科技,2001(2):53-54
[7]徐康,傅亮,孙颖莺,等.酶法制备燕麦乳饮料的工艺研究[J].食品与机械,2009,25(4):138-140
[8]许朵霞,王小亚,尤嘉,等.蛋白质-多糖复合物对β-胡萝卜素乳液的影响[J].食品研究与开发,2012,33(4):9-13
[9]无锡轻工大学、天津轻工业学院.食品分析[M].北京:中国轻工业出版社,2000
[10]曹盼,朱科学,彭伟.酶法制备燕麦浆工艺研究[J].食品工业科技,2012,33(8):309-313
[11]刘晓玲,李东刚,史娟,等.离子色谱-脉冲安培检测器分析饮料中单糖和二糖[J].光谱实验室,2010,27(2):441-445
[12]潘媛媛,梁立娜,蔡亚岐,等.高效阴离子交换色谱-脉冲安培检测法分析啤酒和麦汁中的糖[J].色谱,2008,26(5):626-630
[13]陶兴无.α-淀粉酶在甜玉米饮料生产中的应用研究[J].湖北工业大学学报,2006,21(2):17-20.
Influence of Enzymatic Hydrolysis Processing on the Stability and Saccharide Distribution of Oats Milk
Wang Liping1Zhu Yajing1,2FengXuqiao2Tan Bin1
(Academy of State Administration of Grain1,Beijing 100037)(Shenyang Agriculture University2,Shenyang 110866)
Enzymatic hydrolysis of starch is an efficientmethod to solve the oatsmilk stability decline.The influence ofα-amylase and glucoamylase on the oatsmilk stability was studied in this paper.The optimal enzyme hydrolysis conditionswere determined and the change of sugar in oatsmilk after enzymatic hydrolysis of two enzymewas compared.The optimum conditions ofα-amylase showed as follows:dosage ofα-amylase 0.5%,temperature 70℃and hydrolysis time 1.0 h.The optimum conditions of glucoamylase was dosage of glucoamylase 0.8%,temperature 40℃,pH 4.0~5.0 and hydrolysis time 4.0 h.The enzymolysis and stability of theα-amylase sample were superior to the glucoamylase sample.Sugar of oatsmilk afterα-amylase enzymolysiswas glucose and maltooligosaccharide and sugar of oatsmilk was only glucose after glucoamylase enzymolysis.α-Amylase hydrolysis was bettermethod to improve the stability of oatsmilk.
oatsmilk,stability,sugar,α-amylase,glucoamylase
“十二五”国家科技支撑计划(2012BAD34B08)
2013-11-22
汪丽萍,女,1978年出生,副研究员,粮食加工与安全
谭斌,男,1972年出生,研究员,粮油深加工
TS275.4
A
1003-0174(2015)03-0012-07
