这道计算题应该怎样解
2015-12-14金汝俊
金汝俊

题目如取100 mL 3 mol/L的H2SO4溶液(密度为1.18 g/cm3)与足量的锌反应,冷却至10℃,计算理论上能生成七水合硫酸锌的质量)(10℃时硫酸锌的溶解度是32 g)。
解法一设此硫酸溶液与足量锌反应可生成硫酸锌x g,ZnSO4·7H2O y g。
Zn+H2SO4ZnSO4+H2↑
1 mol161 g
3×0.1 molx
1∶161=3×0.1∶xx=48.3 g
ZnSO4+7H2OZnSO4·7H2O
161289
48.3y
161∶289=48.3∶yy=65.34 g
答:理论上能生成65.34 g七水合硫酸锌。
解法二理论上可生成x g硫酸锌,同时生成y g氢气。
Zn+H2SO4ZnSO4+H2↑
1 mol1612
3×0.1 molxy
1∶161=3×0.1∶xx=48.3 g
1∶2=3×0.1∶yy=0.6 g
100 mL 3 mol/L硫酸溶液中含硫酸
3×0.1×98=29.4 g
含有水1.18×100-29.4=88.6 g
反应后溶液中含水88.6-0.6=88 g
设88 g水中含ZnSO4 z g
88∶z=100∶32z=28.16 g
结晶出来的ZnSO4:48.3-28.16=20.14 g
又设20.14 g ZnSO4与足量水反应可生成
七水合硫酸锌m g。
ZnSO4+7H2OZnSO4·7H2O
161289
20.14m
161∶289=20.14∶mm=36.15 g
答:理论上可生成七水合硫酸锌36.15 g。
解法三100 mL 3mol/L硫酸溶液中含硫酸:
3×30.1×98=29.4 g
含水:1.18×100-29.4=88.6 g
H2SO4~ZnSO4
0.3 molZnSO4=161×0.3=48.3 g
设有x g ZnSO4析出,含结晶水y g
则溶液还含有ZnSO4(48.3-x)g,有水
(88.6-y)g
故(48.3-x)∶(88.6-y)=32∶100①
由ZnSO4~ZnSO4·7H2O
x∶y=161∶126②
由①与②得:
(48.3-x)∶(88.6-y)=32∶100
x∶y=161∶126
解之得x=26.61 g
y=20.83 g
所以析出ZnSO4·7H2O为:
20.83+26.61=47.44 g。
显然上述三处答案只有一种是正确的,到底哪一种对呢?笔者将上述答案的情况做了统计,分别占全班总人数的45.7%、23.8%、14.3%(还有一部分学生未动笔或只做了几步),并对答者的思路进行如下分析。
第一种解题思路是物质在反应过程中:H2SO4~ZnSO4~ZnSO4·7H2O,根据硫酸的质量求出ZnSO4·7H2O的质量,这种解法显然是错误的,他们忽视了溶解度的意义,误认为生成的硫酸锌全部转化成了ZnSO4·7H2O,而事实确不是这样。
第二种解题思路是Zn与H2SO4反应生成ZnSO4和H2,H2的产生不能引起水的质量减少,即1.18×100-3×0.1×98-0.6=88 g显然是错误的。
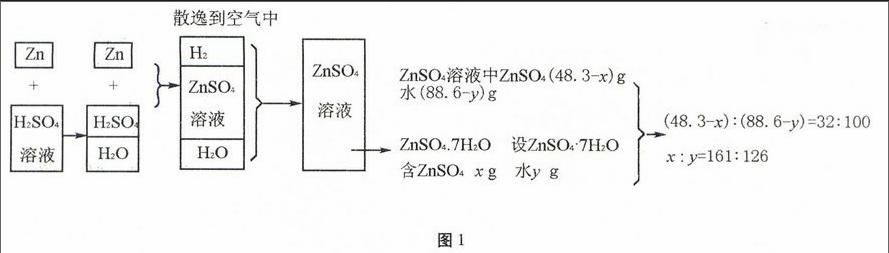
第三种解法思路清晰,对Zn与H2SO4完全反应的最终产物进行了分析:将生成的ZnSO4分成两部分,一部分在溶液中,一部分在结晶水合物中。设晶体中有x g ZnSO4,溶液中有ZnSO4(48.3-x)g。100 mL H2SO4溶液中的水也分成两部分,一部分在溶液中,一部分在结晶水合物中,设晶体中有y g水,溶液中有水(88.6-y)
g。找出这两组关键的量,然后根据溶解度的定义和ZnSO4转化成ZnSO4·7H2O的关系列出两个方程,最后联立求解。
笔者建议解答此题首先要抓住下列几个问题进行分析。
1.与Zn反应的物质是什么。
2.生成的ZnSO4是不饱和溶液还是饱和溶液。
3.ZnSO4析出时含有结晶水。含有结晶水的物质析出时溶液中的溶剂将会怎样变化。
然后根据上述的分析,采用图解示意(图1),即可找到解题途径。
图1
(收稿日期:2015-06-10)
