HPLC法测定聚(乳酸—乙醇酸)中的乳酸、乙醇酸含量
2015-12-14尹情胜王小董任翠丽
尹情胜,王小董,任翠丽
(1.合肥工业大学控释药物研究室;2.安徽中人科技有限责任公司,安徽 合肥 230009)
聚(乳酸—乙醇酸)[poly(lactic-co-glycolic acid),PLGA]是由乳酸(lactic acid,LA)和乙醇酸(glycolic acid,GA)聚合而成,在生物体内可降解为内源性物质乳酸和乙醇酸,具有良好的生物相容性,无毒副作用,其广泛应用于制药、生物工程等领域[1-3]。PLGA中乳酸、乙醇酸的含量既是优化生产工艺、反映样品纯度的一个重要指标,同时它们也反映PLGA在存贮期间的质量变化和产品的稳定性能。因此有必要建立灵敏的、可靠的乳酸、乙醇酸的测定方法来监测PLGA的质量。高效液相色谱法(high-performance liquid chromatography,HPLC)是目前测定食品、果汁饮料、生物样品等中乳酸、乙醇酸的较优方法[4-6]。吕兆林等[4]用 HPLC 法测定苹果酒中苹果酸及乳酸的含量,黄光晓等[5]用反相高效液相色谱法测定在乙醇酸甲酯存在下的乙醇酸含量。而将HPLC法用于同时测定PLGA中微量的乳酸和乙醇酸,未见有文献报道。本文建立了HPLC法测定PLGA中乙醇酸、乳酸的方法,并按照相关的技术指导原则[7]进行验证。
1 仪器与材料
1.1 仪器 LC-15C高效液相色谱仪,日本岛津公司;TU-1901紫外可见分光光度计,北京普析通用公司;AE240电子天平,梅特勒公司。
1.2 材料 聚(乳酸—乙醇酸)(25/75),安徽生建可降解聚乳酸新材料有限公司;乙醇酸、乳酸,分析纯,SIGMA公司;乙腈、甲醇、磷酸均为色谱纯市售试剂;三氯甲烷为市售分析纯;色谱柱,填料Kromasil C18,5 μm,规格 4.6 mm ×250 mm,天津兰博公司。
2 方法与结果
2.1 色谱条件与系统适用性 用十八烷基键合硅胶为填充剂,以0.12%(v/v)磷酸溶液—乙腈(98∶2)为流动相,流速为1.00 mL·min-1,检测波长为210 nm,柱温30℃。理论板数按乳酸峰计算不低于2 000。
2.2 PLGA中乳酸与乙醇酸的测定方法 精密称取PLGA约0.1 g,加三氯甲烷4 mL溶解试样,精密加0.12%磷酸溶液1 mL,涡旋5 min,静置,取上清液作为供试品溶液;另取乙醇酸和乳酸适量,精密称定,用0.12%(v/v)磷酸溶液溶解,作为对照溶液。精密量取供试溶液20μL,注入色谱仪,记录谱图。按外标法以峰面积计算样品中乳酸和乙醇酸的含量。
2.3 方法的专属性 按“2.2”项下分别制备空白样品、加标样品、供试样品的溶液,3种样品的色谱图见图1。图1A显示空白样品仅含有1个小杂质峰,图1B显示乳酸、乙醇酸与相邻杂质间两两完全分离,图1C显示供试样品含少量的乳酸、乙醇酸。
2.4 线性与范围 取乳酸、乙醇酸各约20 mg,精密称定,配制系列浓度的标准溶液,测定两酸的峰面积。结果显示乳酸、乙醇酸溶液浓度在0.5~2 000 mg·L-1时,两酸的峰面积(A)对其浓度(C)的线性回归方程分别为A=921C+1 099和A=807C+608,r均为 1.000 0。
2.5 方法的准确度 精密称取PLGA(含LA、GA分别为 0.036%和 0.013%)约 0.1 g,共 9 份,分成3组,各组分别定量加入LA和GA,按“2.2”项下方法制备成低、中、高浓度的加标供试品溶液。按本法测定各样品中LA、GA的量,扣除各样中已有的LA、GA的量得回收量,结果见表1。表1显示低、中、高浓度的加标回收率均在96% ~101%(RSD<1.0%,n=3)。
2.6 重复性与中间精密度考察 取PLGA约0.1 g,精密称定,按照“2.5”准确度项下的方法制备6份中浓度加标供试品溶液,测定其中乙醇酸、乳酸的含量,考察方法的重复性;另一分析人员同时测定6份,考察方法的中间精密度,结果见表2。结果表明方法的重复性和中间精密度均较好,RSD均小于10%,符合有关物质分析方法的标准规定[9]。
2.7 方法的检测限与定量限 分别称取乳酸、乙醇酸适量,精密称定,用0.12%磷酸溶液逐级稀释成系列低浓度标准溶液,进柱分析。S/N为3时,LA、GA的浓度(即检测限)分别为0.09和0.10 mg·L-1;在S/N约为10,LA、GA相应的浓度为0.38和 0.36 mg·L-1,RSD 分别为 3.2% 和 3.3%(n=6)。
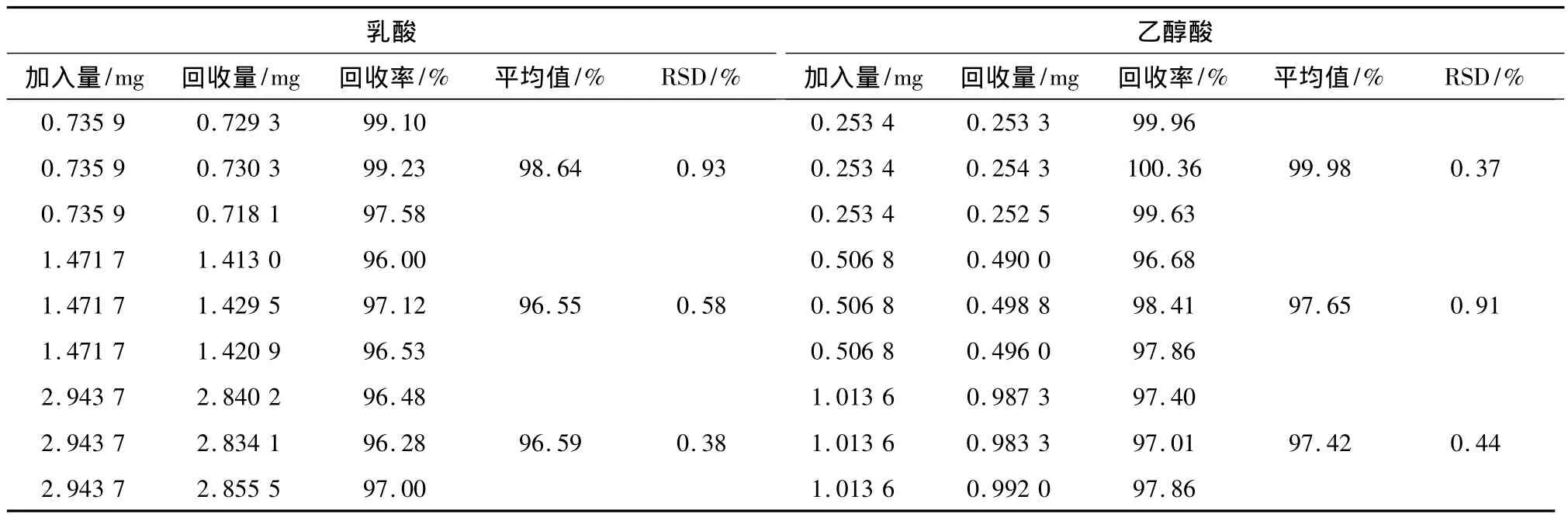
表1 方法的准确度(加标回收率)试验结果
2.8 供试溶液的稳定性 按“2.6”项分别配制中 浓度加标供试品溶液和乳酸、乙醇酸的对照溶液,分别置于4℃冰箱和室温条件下,于1、2、3、5、7 d 时按本法测定。结果表明,乳酸和乙醇酸含量变化的绝对值在±0.1%以内,未出现新的大于报告限度的杂质,符合要求。
2.9 方法的耐用性 按“2.6”项分别配制中浓度加标供试品溶液和乳酸、乙醇酸的对照溶液,在波长变化±5 nm、柱温变化±5℃以及采用三根不同色谱柱的条件下,进柱分析,考察本法的耐用性。结果表明,供试样品中乳酸、乙醇酸含量测定值的相对标准偏差(n=6)均小于2.0%,符合方法学验证要求。
2.10 供试样品测定 取PLGA供试品3批,按照本法测定乳酸、乙醇酸的含量,结果见表3。结果表明,供试样品中乳酸、乙醇酸的含量极低,远小于限度要求。
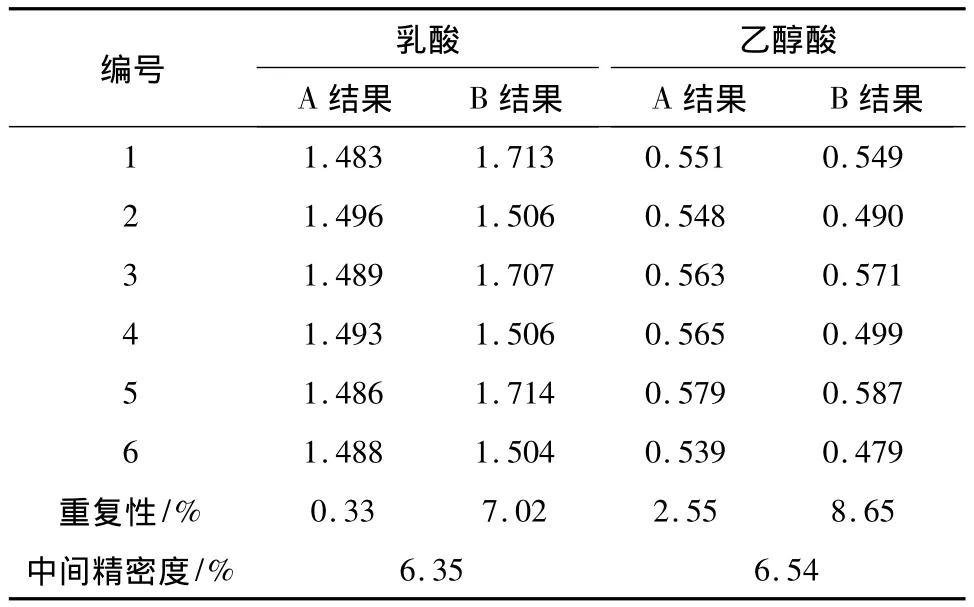
表2 方法的精密度考察结果/mg
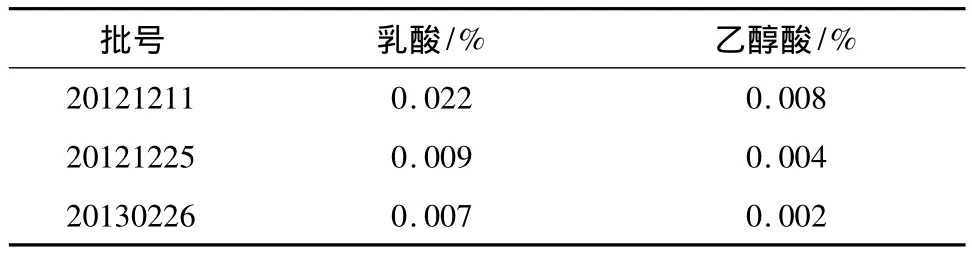
表3 3批PLGA供试品中乳酸与乙醇酸的含量
3 讨论
3.1 色谱条件的确定 乳酸、乙醇酸最大吸收波长分别为210 nm和206 nm,因溶剂在低波长处有较大的吸收,对测定有干扰,选用210 nm作为检测波长。
流动相中用乙腈代替甲醇时,柱效较高。两酸的p K a值分别为3.86和3.83,只有在较低pH溶液中,它们绝大部分才以分子状态存在,峰形对称,柱效较高。但过低的pH值易破坏色谱柱填料,故流动相水系选择pH1.9(0.12%磷酸溶液)。
3.2 供试样品处理方法的优选 三氯甲烷为PLGA的良溶剂,而乳酸、乙醇酸为水溶性的酸。故本文采用三氯甲烷将PLGA溶解,再用0.12%磷酸进行液液萃取。
3.3 PLGA中乳酸和乙醇酸的限度 乳酸、乙醇酸是人体代谢途径的副产物,属内源性物质,因此,它们对人体没有毒性。参照国家食品药品监督管理局颁布的有关PLGA的质量标准[8],将PLGA中乳酸与乙醇酸的限度分别设定1.5%和0.5%。
[1]李方园,姜永莉,成 颖.PLGA纳米粒抗肿瘤药物载体的研究进展[J].西北药学杂志,2013,28(6):656-660.
[2]李祥伟,王丽芹,张颖丽,等.载辛伐他汀PLGA缓释微球的制备及表征[J].口腔医学研究,2013,29(3):217-220.
[3]任翠丽,尹情胜,俞 敏,等.HPLC法测定地塞米松植入剂的含量[J].安徽医药,2013,17(8):1294-1295.
[4]吕兆林,林 西,邓文红,等.HPLC法测定苹果酒中苹果酸及乳酸含量[J].精细与专用化学品,2012,20(1):9-13.
[5]黄光晓,徐 艳,赵玉军,等.反相高效液相色谱法测定在乙醇酸甲酯存在下的乙醇酸含量[J].化学工业与工程,2012,29(1):48-51.
[6]马 瑞,欧阳嘉,李 鑫,等.高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J].色谱,2012,30(1):62-66.
[7]黄晓龙.有关物质分析方法验证的可接受标准简介[A]//国家食品药品监督管理局审评中心.药品技术评价文集:第二辑.北京:中国医药科技出版社,2007:114-117.
[8]国家食品药品监督管理局.YBF00042009,乙交酯-丙交酯共聚物(25∶75)[S].
