阿米卡星在严重败血症患者体内的药代动力学研究
2015-12-14陈平雄
陈平雄,齐 芸
(海南省海口市人民医院急诊外科,海南海口 570208)
重症感染患者具有高发病率和高死亡率的特点,50%的严重败血症患者很可能会死于医院中,不合适抗生素治疗很可能会导致最后治疗失败,增加患者的死亡率[1-4]。阿米卡星是氨基糖苷类抗生素的典型代表药物[5-6]。阿米卡星具有剂量依赖性,血清药物高峰浓度具有很强的抗感染作用[7-8],因此,临床上对于ICU败血症患者,最佳阿米卡星剂量可能要高于常规剂量,才能达到更好的疗效[9-10]。但是,高剂量的阿米卡星应用于ICU败血症患者体内的药代动力学研究很少[10-15]。因此,我们初步探讨首剂量25 mg·kg-1阿米卡星在重症败血症患者体内的代谢动力学和血液动力学的关系,为此药的临床应用提供一定的临床研究资料。
1 资料与方法
1.1 一般资料 收集于2012年1月—2013年7月来我院ICU住院的30例严重败血症患者。我们的研究已经通过人与动物医学研究伦理学委员会的批准,每名患者被告知研究目的,并签下知情同意书。
我们纳入入住ICU的革兰阴性(G-)败血症患者接受阿米卡星药物治疗。排除标准如下:年龄低于18周岁,或者高于65周岁患者,怀孕患者,大面积烧伤患者(>20%体表面积),腹水,肾功能不全患者(肌酐清除率小于6 060 mL·min-1),耳蜗前庭功能异常患者,重症肌无力患者,氨基糖苷类药物过敏患者,脑膜炎患者,心内膜炎,免疫缺陷患者,氨基糖苷类药物治疗超过2周者。根据抗生素治疗的经验,首剂量25 mg·kg-1阿米卡星静脉注射超过60 min,可以联合应用β内酰胺类或者青霉素类抗生素。
1.2 血药浓度检测 在静脉输液的0、0.25、0.5、1.5、4.0、8.0、12.0、18.0、24.0 h 时,通过输液装置对每名患者采集5 mL血液标本(不加抗凝剂),当血液完全凝集后(15~30 min),4℃离心,收集血清放入-80℃冰箱保存。通过荧光偏光免疫测定法,应用TDx分析仪 (Germany)检测血清中阿米卡星的药物浓度。根据仪器使用说明,仪器检测的低限值是0.6 mg·L-1,低浓度时(5 mg·L-1),中等浓度(15 mg·L-1)和高浓度(30 mg·L-1)的精确度分别是 3.18%,2.62%和 2.50%。
1.3 数据收集整理 记录所有患者住院的基本信息包括:年龄,性别,体重(TBW),根据 APACHEII(the Acute Physiology and Chronic Health Evaluation)对疾病进行严重性分级[16],记录中心静脉压(CVP),并进行入院和24 h后各项实验室检查:全血细胞计数(CBC),血清肌酸酐(SCr),血尿素氮(BUN),肝功能实验,电解质检测等。通过Cockcroft and Gault方程式评估肌酸酐清除率(CCr)[17]。
1.4 药代动力学检测 应用non-compartmental模型分析每名患者阿米卡星的药物代谢动力学的各个指标[18],药物分布的总容量 Vd(Total volume of distribution),总体清除率Cl(total body clearance),代谢半衰期(t1/2),24 h内曲线下面积AUC(area under the curve),峰值(完全输液阿米卡星30 min后的浓度),波谷(开始输液24 h后的浓度)。通过预测 Vd 平均值0.4 L·kg-1,峰值 > 64 mg·L-1被认为是最佳浓度,毒性的阈值通过波谷>5 mg·L-1来确定[10,12]。
2 结果
2.1 研究对象基本资料 30例重症患者被确诊为严重败血症,具有阿米卡星治疗适应证,其基本信息和实验室检查结果见表1。

表1 研究对象的基本信息表
2.2 药物代谢动力学结果 阿米卡星的中间剂量是1 500 mg(1 300~2 000)mg,通过静脉输液60 min以上。阿米卡星主要药代动力学参数见表2,阿米卡星的血清浓度—时间曲线见图1。阿米卡星在重症患者体内 Vd19和 Cl20分别是(0.36±0.07)L·kg-1,(3.88 ±0.94)mL·min-1·kg-1,与非重症患者体内 Vd为0.25 L·kg-1和 Cl为1.37 mL·min-1·kg-1进行比较,具有统计学差异(P <0.05)[19-20]。
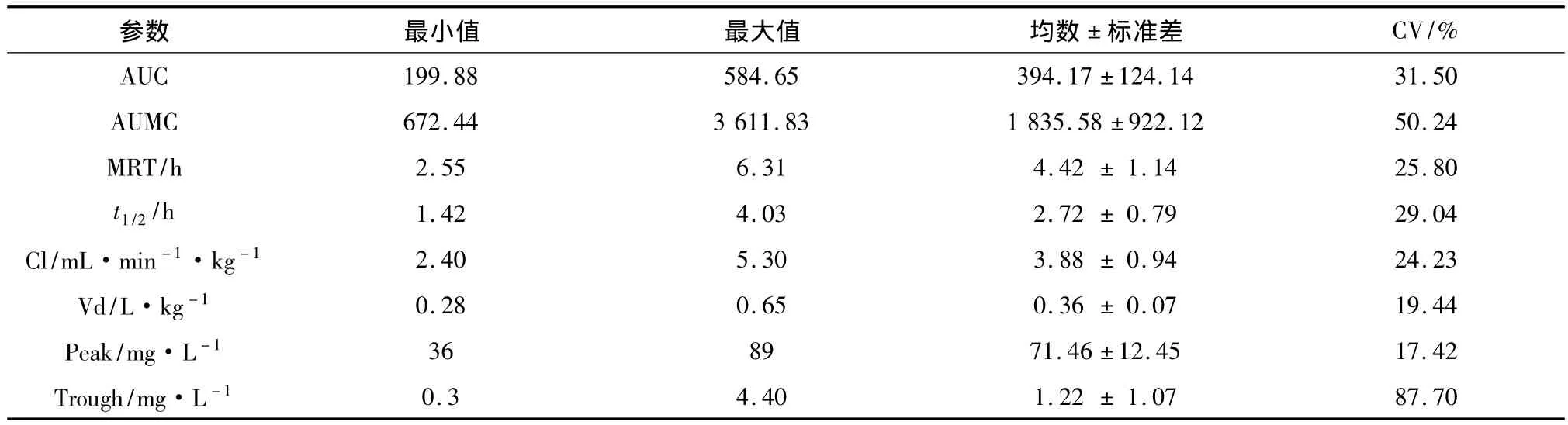
表2 研究对象的药代动力学参数结果
2.3 阿米卡星血液药物检测结果 75%重症患者血清中阿米卡星的峰值浓度是>64 mg·L-1(见图2),没有患者具有波谷浓度>5 mg·L-1(见图3)。阿米卡星药代动力学各个参数之间的关系,患者Vd,Cl和患者的年龄,体重,APACHEⅡ评分,CCr和SCr之间都具有一定的相关性,见表3。APACHEⅡ评分与阿米卡星的Vd之间具有明显的相关性(P<0.05)。患者阿米卡星 Cl中,CCr与 SCr之间具有明显的相关性(P<0.05)。其他变量与阿米卡星Cl,Vd之间未发现明显的相关性。

表3 阿米卡星药代动力学与患者相关因素间的关系
3 讨论
目前,高剂量阿米卡星对ICU败血症患者的应用研究很少[10,13]。我们研究结果展现了,首剂量25 mg·kg-1阿米卡星的药代动力学和此剂量阿米卡星对严重败血症患者的影响。当前的研究结果提示,对于重症败血症患者,阿米卡星的药代动力学具有很大的变化。因此,对于重症败血症患者,有效血药浓度需要给予更高剂量阿米卡星。重症患者一般不会局限于同一种族人群,表现在疾病种类,严重程度和器官功能上都具有不同[14]。大部分在ICU应用药物的剂量都是参考非ICU病人或者正常志愿者临床实验研究的结果,这些研究结果都是基于ICU患者药代动力学参数和非ICU患者相同[21-22]。
重症患者的氨基糖苷类药物的药代动力学会受到很多因素的影响,表现为Vd增加,可以导致氨基糖苷类药物的血清药物峰值浓度下降[23-24]。在我们的研究中,重症患者体内Vd在第一阶段是(0.43 ±0.12)L·kg-1,而有人研究评估了阿米卡星在30名重症患者体内的药物代谢情况,指出Vd的平均值是0.47 L·kg-1,明显高于正常志愿者具有统计学差异[12]。有两个研究发现,对ICU里G-菌感染患者应用阿米卡星,Vd平均值分别是0.37和 0.41 L·kg-1[10,25]。重症患者体内 Vd 的变化受到许多因素的影响。细菌的内毒素可以导致大量炎性介质产生,影响血管内皮功能和增加渗透性[26]。水肿可以通过增加Vd和降低抗生素的血药浓度,导致临床上抗生素药物治疗的失败[27-28]。我们研究发现,阿米卡星的Vd结果受到APACHEⅡ评分的影响,这与相关研究结果基本一致[29-30]。阿米卡星的首剂量与药物的Vd具有一定的比例关系,因此,充足的首剂量药物对于保持有效的药物浓度具有重要的作用,从而也可以减少细菌耐药性发生的可能性。
通过本研究显示了败血症患者的生理变化相关的重要因素,及其临床相关因素对阿米卡星的药代动力学影响。因此,根据患者的血液动力学变化,调整阿米卡星药物首剂量达到最佳药效,这对于重症患者败血症的快速有效的控制具有重要的意义。
[1]Mertens K,MoralesI,Catry B.Infections acquired in intensive care units:results of national surveillance in Belgium,1997-2010[J].Journal of HospitalInfection,2013,84:120-125.
[2]Zeni F,Freeman B.Anti-inflammatory therapies to treat sepsis and septic shock:A reassessment[J].Crit Care Med,2012,25(12):1095-1100.
[3]Kumar A,Roberts D.Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock[J].Crit Care Med,2011,34(6):1589-1596.
[4]Leibovici L,ShragaI.The benefit of appropriate empirical antibiotic treatment in patients with blood-stream infection[J].JIntern Med,2011,244(11):379-386.
[5]Fauvelle F,Perrin P.Fever and associated changes in glomerular filtration rate erase anticipated diurnal variations in aminoglycoside pharmacokinetics[J].Antimicrob Agent Chemother,2012,38(12):620-623.
[6]Qi R,Li W,Yu S.FK506 inhibits the mice glomerular mesangial cells proliferation by affecting the transforming growth factor-βand Smads signal pathways[J].Ren Fail,2014,36:589-592.
[7]Lortholary O,Tod M.Aminoglycosides[J].Med Clin North Am,2012,79(13):761-787.
[8]Olsen KM,Rudis MI.Effect of once-daily dosing vs.multiple daily dosing of tobramycin on enzyme markers of nephrotoxicity[J].Crit Care Med,2012,32(22):1678-1682.
[9]Buijk SE,Mouton JW.Experience with a once-daily dosing program of aminoglycosides in critically ill patients[J].Intens Care Med,2012,28(25):936-942.
[10]李仁宝,章安庆.108例阑尾炎病原菌菌谱及耐药分析的临床价值[J].安徽医药,2014,18(1):162-164.
[11]Bressolle F,Gouby A.Population pharmacokinetics of amikacin in critically ill patients[J].Antimicrob Agents Chemother,2012,40(9):1682-1689.
[12]Lugo G.Relation between hemodynamic and vital support measures and pharmacokinetic variability of amikacin in critically ill patients with sepsis[J].Crit Care Med,2011,25(21):806-811.
[13]DelattreIK.Population pharmacokinetic modeling and optimal sampling strategy for Bayesian estimation of amikacin exposure in critically ill septic patients[J].Ther Drug Monit,2011,32(17):749-756.
[14]Yamamura S.Clinical application of artificial neural network(ANN)modeling to predict pharmacokinetic parameters of severely ill patients[J].Adv Drug Deliv Rev,2013,55(9):1233-1251.
[15]Bone RC.Sepsis syndrome:A valid clinical entity[J].Crit Care Med,2012,17(24):389-393.
[16]Knaus WA.APACHEII:A severity of disease classification system[J].Crit Care Med,2011,13(17):818-829.
[17]王崇薇,刘琳琳,孙言才.某三甲医院2005—2011年10097例药品不良反应报告分析[J].安徽医药,2013,17(1):162-165.
[18]Norwich KH.Non compartmental models of whole-body clearance of tracers:A review[J].Ann Biomed Eng,2011,25(18):421-439.
[19]Yu M,Ren Q,Yu SY.Role of nephrin phosphorylation inducted by dexamethasone and angiotensinIIin podocytes[J].Mol Biol Rep,2014,41:3591-3595.
[20]Bauer LA.Influence of weight on aminoglycoside pharmacokinetics in normal weight and morbidly obese patients[J].Eur JClin Pharmacol,2011,24(21):643-647.
[21]Mckindley DS.Hepatic drug metabolism in critical illness[J].Pharmacotherapy,2008,18(20):759-778.
[22]Yu SY,Qi R.Role of Bad in podocyte apoptosis induced by puromycin aminonucleoside[J].Transplantation proceedings,2013,45(2):569-573.
[23]潘学琴,王东萍,王 庆.肺结核合并呼吸系统细菌感染病人的病原菌构成及其耐药性分析[J].安徽医药,2013,17(1):93-95.
[24]Yeung CK,Shen DD,Thummel KE,et al.Effects of chronic kidney disease and uremia on hepatic drug metabolism and transport[J].KidneyInternational,2014,85:522-528.
[25]Hoekstra R,Nibourg GA,Van Der Hoeven TV,et al.Phase 1 and Phase 2 Drug Metabolism and Bile Acid Production of HepaRG Cells in a Bioartificial Liver in Absence of Dimethyl Sulfoxide[J].DMD,2013,41(3):562-567.
[26]Yang L,Price ET,Chang CW.Gene expression variability in human hepatic drug metabolizing enzymes and transporters[J].PLoS One,2013,8(4):e60368.
[27]Hansen M.Gentamicin dosing in critically ill patients[J].Acta Anaesthesiol Scand,2011,45(6):734-740.
[28]张侠家,徐元宏.肠球菌对氨基糖苷类高水平耐药机制的临床研究进展[J].安徽医药,2013,17(11):1833-1836.
[29]Marik PE.Aminoglycoside volume of distribution and illness severity in critically ill septic patients[J].AnaesthIntens Care,2013,21:172-173.
[30]Lugo-Goytia G.Bayesian approach to control of amikacin serum concentrations in critically ill patients with sepsis[J].Ann Pharmacother,2012,34:1389-1394.
