木犀草素-7-O-芸香糖苷的半合成
2015-12-08闻永举申秀丽
闻永举, 申秀丽, 张 洁
(1.宜春学院,江西宜春336000;2.军事医学科学院,北京100850)
木犀草素-7-O-芸香糖苷的半合成
闻永举1, 申秀丽1, 张 洁2
(1.宜春学院,江西宜春336000;2.军事医学科学院,北京100850)
目的 设计橙皮苷一步法半合成木犀草素-7-0-芸香糖苷。方法 橙皮苷与三氯化铝络合后溶于含吡啶的甲醇溶液中,经过碘脱氢,生成地奥明与铝的络合物,密闭蒸馏除去吡啶和甲醇,进行脱甲基反应,得到木犀草素-7-0-芸香糖苷。结果 HPLC测定木犀草素含有量为38.2 g/kg、木犀草苷为75.0 g/kg、地奥司明为80.4 g/kg,扣除上述杂质后,木犀草素7-0-芸香糖苷含有量为806.4g/kg,收率为65.7%。结论 该路线工艺简单,试剂用量少,反应条件温和,收率良好,具有一定的工业化生产潜力。
木犀草素7-0-芸香糖苷;橙皮苷;半合成
柑橘是世界上产量最大的水果,而我国的种植及产量均居世界第一。然而,对柑桔的利用仅局限在果实上,对果皮还没引起足够的重视,柑橘皮渣作为加工副产品,占30%~50%,仅有少部分被回收作为陈皮和提取橙皮苷使用,其余大部分被丢弃,造成极大浪费和环境污染。 《中国药典》规定,青皮含橙皮苷量不得低于5.0%,陈皮含橙皮苷量不得低于3.5%[1],并且该成分来源丰富,提取工艺简单,价格低廉,每公斤90%橙皮苷仅约为180元。
木犀草素及其糖苷具有抗痴呆[2-3]、 抗菌[4-6]、 抗癌[7]、心脑血管保护[8-11]等作用,但其在天然植物中的含有量较低,《中国药典》2005年版规定,金银花中木犀草苷的含有量不得少于0.10%,但很多金银花难以达到此标准;《中国药典》2010年版规定,金银花中木犀草苷含有量不得少于0.050%,菊花中木犀草苷含有量不得少于0.080%。橙皮苷半合成木犀草素-7-0-葡萄糖苷共5步,总产率为5.88%[12]。尽管木犀草素及其葡萄糖苷具有较好的药理活性,但它们和大部分黄酮类化合物一样难溶于水,口服吸收困难,生物利用度较低,临床应用受到限制[13]。
橙皮苷半合成木犀草素或木犀草苷所需步骤多,产率低,而且所得产物水溶性较小,而木犀草素-7-0-芸香糖苷可溶于水,易溶于热水,优于木犀草素和木犀草素-7-0-葡萄糖苷。本实验利用三氯化铝和橙皮苷络合,经密闭保温碘脱氢生成地奥明,不经分离而直接经密闭蒸馏脱甲基,生成木犀草素-7-0-芸香糖苷[14]。其半合成路线见图1,密闭保温反应见图2,密闭蒸馏见图3。
1 材料
JNM-ECA-400超导NMR仪,TMS为内标(400 M,日本电子株式会社);Waters ACQUITYTM UPLC色谱系统,包括ACQUITY UPLCBEH C18色谱柱(1.7μm,2.1 mm× 50 mm)、蒸发光散射(ELS)检测器、Waters SYNAPT MS质谱系统(美国Waters公司);LC-UV100 HPLC色谱仪,包括紫外检测器 (上海伍丰科学仪器有限公司);202-2电热恒温干燥箱(天津市泰斯特仪器有限公司);Startoruis BS224S电子天平 (德国Startoruis公司);温度计;碘量瓶。木犀草素、木犀草苷对照品 (中国食品药品检定研究院,批号分别为111520-200504、111720-200602);地奥明对照品、橙皮苷 (纯度分别为90%、92%,陕西慧科植物开发有限公司)。D101大孔吸附树脂 (沧州宝恩吸附材料科技有限公司)。乙腈为色谱纯;无水三氯化铝、碘、甲醇、吡啶、磷酸、保险粉、氢氧化钠、冰醋酸均为分析纯。
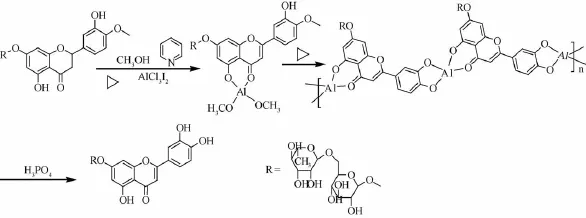
图1 木犀草素-7-O-芸香糖苷的半合成路线
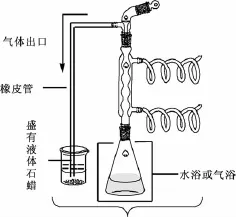
图2 密闭保温/回流
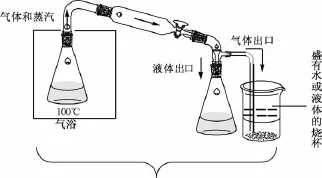
图3 密闭蒸馏
2 化学合成
迅速称取无水三氯化铝7.0 g,置于250 mL碘量瓶中,迅速加入吡啶80 mL,摇匀,放冷,加入甲醇30 mL和橙皮苷33.0 g,搅拌2 min,加入碘13.5 g,再搅拌2 min,碘量瓶上端接冷凝管,80℃下密闭反应 (防止吸收空气中水分),每隔1 h搅拌1次,2 h后形成均匀溶液,继续密闭反应6 h(完成脱氢)。在气浴中升温至100℃,密闭蒸馏48 h或PC/TLC/HPLC跟踪至无地奥司明发现(优先聚酰胺薄层层析监控,样品液的制备方法为用磷酸破除铝离子,与黄酮络合,盐酸水溶液中和吡啶,静置,滤过,滤液通过大孔吸附树脂微柱,水洗除杂,乙醇洗脱,取洗脱液作为供试品。然后点样,50%乙醇展开,晾干,1%FeCl3乙醇喷雾显色),加入保险粉3.0 g,水液100 mL,搅拌5 m in,放凉,倒入磷酸20 mL、盐酸80 mL、水液100 mL,搅拌,50℃下密闭放置2 h,滤过 (不溶物为少量地奥明和木犀草素)得酸水液,大孔吸附树脂柱 (350 g)层析,水洗涤除去吡啶、HI、磷酸、AlCl3,60%乙醇洗脱,回收乙醇,得木犀草素-7-0-芸香糖苷,共21.7 g。
1H-NMR(DMSO-d6,400 MHz)δ:7.47(1H,dd,J= 8.4,2.2 Hz,H-6′),7.46(1H,d,J=2.2 Hz,H-2′),6.98(1H,d,J=8.4 Hz,H-5′),6.78(1H,d,J=1.8 Hz,H-8),6.77(1H,d,J=1.8 Hz,H-3),6.48(1H,d,J=1.8 Hz,H-6),5.11(1H,d,J=7.3 Hz,H-1″),4.57(1H,d,J=1.5 Hz,H-1‴),4.06(1H,d,J=9.5 Hz,H-6″),3.88(1H,dd,J=3.5,1.6 Hz,H-2‴),3.69(1H,dd,J=9.5,3.3 Hz,H-3‴),3.18~3.68(7H,m,H-2″,3″,4″,5″,6″a,4‴,5‴),1.10(3H,d,J=6.2 Hz,H-6‴)。13C-NMR(DMSO-d6,100 MHz)δ:182.1(C-4),164.7(C-2),163.0(C-7),161.4(C-5),157.1(C-9),150.1(C-4′),145.9(C-3′),121.5(C-1′),119.4(C-6′),116.3(C-5′),113.7(C-2′),105.5(C-10),103.3(C-3),100.7(Gly-1),100.0(C-6),95.0(C-8),76.4(Gly-5),75.7(Gly-3),73.3(Gly-2),69.7(Gly-4),66.2(Gly-6). 99.7(Rha-1),70.3(Rha-2),70.9(Rha-3),72.2(Rha-4),68.5(Rha-5)18.0(Rha-6)。TOF MS ESI(+)m/z:617.146 4[M+Na]+,449.106 6[M-146+
H]+,287.055 0[M-146-162+H]+;TOFMS ESI(-)m/z:593.152 7[M-H]-,285.041 4[M-146-162-H]-,(calc for C27H30O15),与文献 [7,15]一致。
3 含有量测定
3.1 色谱条件 流动相为0.5%醋酸-乙腈水溶液(50∶50);体积流量 1.0 m L/m in;柱温 30℃;检测波长350 nm[1]。
3.2 混合对照品溶液的制备 精密称取木犀草素0.020 2 g、木犀草苷0.021 5 g、地奥司明0.019 8 g,置于50 mL量瓶中,加DMSO 5 mL溶解,甲醇稀释至刻度,摇匀,即得对照品贮备液。再精密吸取10 mL,置于100 mL量瓶中,甲醇稀释至刻度,摇匀,即得每1 mL含木犀草素40.4μg、木犀草苷43.0μg、地奥司明对照品39.6μg的混合对照品溶液。
3.3 样品溶液的制备 取木犀草素-7-0-芸香糖样品0.043 4 g,置于50 m L量瓶中,加DMSO 5 mL溶解,甲醇稀释至刻度,摇匀,即得对照品贮备液。再精密吸取10 mL,置于100 mL量瓶中,甲醇稀释至刻度,摇匀,即得每1 mL含木犀草素-7-0-芸香糖86.8μg的样品溶液。
3.4 样品测定 分别取混合对照品和供试品溶液10μL,进样分析,木犀草素-7-0-芸香糖样品HPLC图见图4,地奥司明、木犀草苷、木犀草素对照品HPLC图见图5。
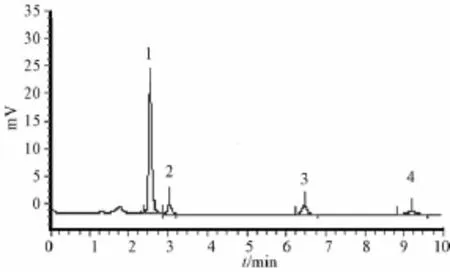
图4 木犀草素-7-O-芸香糖样品HPLC图
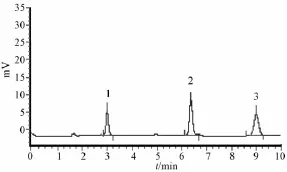
图5 地奥司明、木犀草苷、木犀草素对照品HPLC图
3.5 含有量计算 样品收率=21.7 g/33.0 g×100%= 65.7%;样品含有量=测得样品量/取样量×100%=(C样×V样)/W样×100%,其中C样=A样×C对/A对,C对= W对/V对,且V对=V样,故样品含有量(g/kg)=(W对× A样/A对)/W样×100%×1 000;木犀草素含有量=(0.020 2 g×8.4/102.4)/0.043 4 g×100%×1 000=38.2 g/kg;木犀草苷含有量=(0.021 5 g×11.7/77.3)/0.043 4 g× 100%×1 000=75.0 g/kg;地奥司明含有量=(0.019 8 g× 90%×13.6/68.4)/0.043 4 g×100%×1 000=80.4 g/kg;木犀草素-7-0-芸香糖苷含有量=1 000-木犀草素含有量-木犀草苷含有量-地奥司明含有量=1 000-38.2-75.0-80.4=806.4 g/kg。
4 讨论
目前在糖苷类脱甲基文献中,仅葛根素的全合成使用了较昂贵的乙腈和三甲基碘硅烷[16]分别作为溶剂和脱甲基试剂,而碳苷稳定性远高于氧苷,故氧苷脱甲基文献尚未见报道。究其原因在于,氧苷的稳定性远低于酚甲醚,遇酸易水解,遇热易脱水,用现有方法对氧苷甲醚脱甲基,得到的产物是先脱糖,再脱甲基,最后得到苷元。在高温下时,糖环甚至可能脱水,与黄酮母核进行反应,其产物较为复杂,难以得到先脱甲基而保留糖环的酚苷。本实验成功实现了氧苷脱甲基,也为其它相关研究提供了一种思路。
之前,曾用地奥明直接脱甲基,但其在醇和吡啶中与AlCl3络合溶解的速度很慢,形成均匀溶液的难度较高,脱甲基效果不理想。同样,橙皮苷在醇和吡啶中与AlCl3络合后脱甲基的产率很低,经密闭长时间蒸馏,主要为脱糖产物,甲醇被逐渐蒸出,与黄酮络合的铝失去甲醇,进而与B环上4′-OCH3和3′-OH形成络合物,增强了4′-OCH3的碳离子正电性。反应过程中产生的碘离子可极化性大,优先进攻4′-OCH3,使其脱甲基条件较为温和,具体反应机理见图6。
另外还发现,在密闭蒸馏时,蒸馏温度过高会导致糖苷脱水,而蒸馏时间过长并且分子中含有糖时,会导致脱糖产物增加。三氯化铝用量和橙皮苷的摩尔比为1∶1较好,三氯化铝用量太少,则不能形成均一溶液;用量过多,脱糖产物增多,脱甲基产物并不能明显增加。在脱铝剂硫酸、盐酸、枸橼酸、酒石酸、磷酸、磷酸氢钠、磷酸二氢钠中,磷酸效果最好,并且磷酸氢钠、磷酸二氢钠效果也好于盐酸、硫酸等。
吡啶与甲醇、酚羟基、糖环上羟基形成氢键,与氢碘酸、铝离子形成盐,增大了相应溶剂的沸点。如甲醇与甲醇之间形成氢键,沸点在65℃,但与吡啶形成氢键时,在80~90℃下甲醇仍不能沸腾,蒸发速度极慢。另外,吡啶与糖环、铝盐、氢离子形成的作用力也增加了吡啶的沸点,在120℃下蒸发的速度也非常缓慢,可用空气冷凝,以减少冷凝水用量。吡啶和甲醇、糖环上羟基、酚羟基形成氢键的过程见图7。
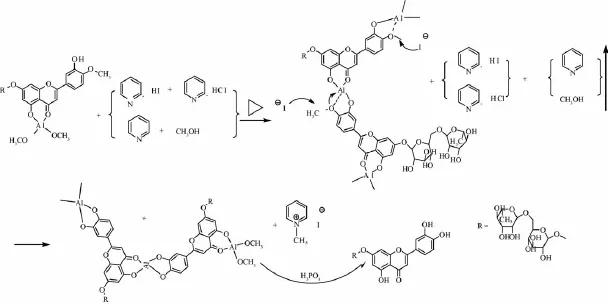
图6 反应机理
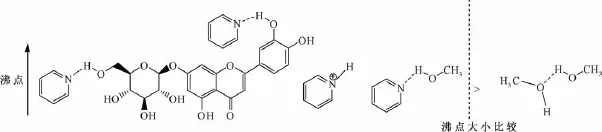
图7 氢键形成过程
由于木犀草素-7-0-芸香糖苷的对照品尚未上市,故无法对其进行准确的含有量测定,只能测定其中地奥司明、木犀草素、木犀草苷的含有量,再扣除杂质成分的含有量,进而估算木犀草素的-7-0-芸香糖苷的含有量。由于木犀草素、木犀草苷、木犀草素-7-0-芸香糖苷的极性相差较大,并且在350 nm处都有最大吸收,而地奥司明在345 nm处也有最大吸收,接近350 nm,故采用药典 “金银花”项下木犀草苷含有量条件,将原来的梯度洗脱改为等度洗脱,并加大乙腈浓度,缩短测定时间。由于木犀草素-7-0-芸香糖苷的准确测定需要相关对照品,故本课题组将进一步分离木犀草素-7-0-芸香糖苷纯品,为制备该对照品奠定基础。
橙皮苷半合成木犀草素-7-0-芸香糖苷仅需一步法即可完成,与利用橙皮苷半合成木犀草素-7-0-葡萄糖苷相比,步骤少,收率高,而且其水溶性高于后者,故可应用于食品、药品抗氧剂、抗菌剂,为其工业化生产奠定基础。
[1] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:176,182,205,292.
[2] 姜瑞芝,高其品,睢大员,等.木犀草素-7-0-β-D葡萄糖1→2葡萄糖苷在制备治疗痴呆疾病药物中的用途:中国,CN101292989A[P].2008-10-29
[3] 姜瑞芝,高其品,睢大员,等.木犀草素-7-0-β-D-葡萄糖醛酸苷在制备治疗痴呆疾病药物中的用途:中国,CN101301302A[P].2008-11-12
[4] Tomic A,Petrovic S,Pavlovic M,etal.Antimicrobial and antioxidant properties of methanol extracts of two Athamanta turbith subspecies[J].Pharm Biol,2009,47(4):314-319.
[5] Salawu S O,Ogundare A O,Ola-Salawu B B,et al.Antimicrobial activities of phenolic containing extracts of some tropical vegetables[J].Afr J Pharm Pharmacol,2011,5(4):486-492.
[6] Chiruvella K K,Mohammed A,DampuriG,etal.Phytochemicaland antimicrobial studies ofmethyl angolensate and luteolin-7-0-glucoside isolated from callus cultures of Soymida febrifuga[J].JBiomed Sci,2007,3(4):269-278.
[7] Orhan F,BarişÖ,Yanmis D,et al.Isolation of some luteolin derivatives from Mentha longifolia(L.)Hudson subsp.longifolia and determination of their genotoxic potencies[J].Food Chem,2012,135(2):764-769.
[8] 马占芝,王学东,王松林,等.木犀草素-7-0-β-D-葡萄糖醛酸苷治疗脑梗塞的用途:中国,CN102523862B[P]. 2013-05-08
[9] 华玉强.木犀草素-7-0-β-D-葡萄糖醛酸苷及其提取方法和用途:中国,CN1332971C[P].2007-08-22
[10] 任冬梅,娄红祥,季 梅,等.HPLC法测定不同采收期岩青兰中两种二氢黄酮苷的含量[J].山东大学学报:医学版,2004,42(6):741-742.
[11] 任冬梅,娄红祥,马 斌,等.HPLC法测定岩青兰地上全草与不同部位中柚皮素-7-0-葡萄糖苷及北美圣草素-7-0-葡萄糖苷的含量[J].天然产物研究与开发,2003,15(3):229-230.
[12] 刑有权,孙志忠.木犀草素及其葡萄糖苷的半合成[J].中国医药工业杂志,1994,25(11):484-487.
[13] 李明静,张 丽,赵东保,等.木犀草素-7-0-β-D-葡萄糖苷在几种分子聚集体系中的增溶行为研究[J].化学学报,2009,67(17):1950-1956.
[14] 闻永举,申秀丽,张 洁.木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法:中国,CN103833714A[P]. 2014-06-04.
[15] Na M K,Jong K,Hae Y C,etal.Isolation of luteolin 7-0-rutinoside and esculetin with potential antioxidant activity from the aerial parts of Artemisia montana[J].Arch Pharm Res,2000,23(3):237-239.
[16] 张培成.黄酮化学[M].北京:化学工业出版社,2009:357.
R284.3
B
1001-1528(2015)12-2790-05
10.3969/j.issn.1001-1528.2015.12.051
2014-09-03
闻永举 (1979—),男,讲师,研究方向为活性成分的提取、分离、结构修饰及全合成。Tel:13766434211,E-mail:ycxywyj@163.com
