白芍多糖脱色工艺研究
2015-12-08秦亚东汪荣斌周娟娟
秦亚东, 汪荣斌,2, 周娟娟
(1.安徽中医药高等专科学校,安徽芜湖241002;2.安徽中药资源研究所,安徽芜湖241317;3.安徽芜湖市中医医院,安徽芜湖241000)
白芍多糖脱色工艺研究
秦亚东1, 汪荣斌1,2, 周娟娟3
(1.安徽中医药高等专科学校,安徽芜湖241002;2.安徽中药资源研究所,安徽芜湖241317;3.安徽芜湖市中医医院,安徽芜湖241000)
目的 优化白芍多糖脱色的最佳工艺。方法 分级醇沉技术得到不同组分的白芍多糖,研究粉末活性炭、颗粒活性炭、过氧化氢、次氯酸钠对其脱色效果的影响,单因素和正交试验优化脱色工艺,并对脱色前后多糖进行UV、IR分析。结果 白芍多糖色素主要集中在PRPS90组分。该组分白芍多糖最优脱色工艺为温度为65℃,过氧化氢体积分数为20%,调节pH值为9,脱色3.5 h。经UV、IR分析,脱色前后结构未发生明显改变。结论 该工艺稳定可行,易于操作,适合工业化生产。
白芍;多糖;脱色工艺;单因素试验;正交试验;UV;IR
白芍为毛茛科植物芍药Paeonia lactiflora Pall.的干燥根,气微寒,味微苦、酸,具有养血调经、敛阴止汗、柔肝止痛、平抑肝阳的功效[1],药用已有2 000余年的历史。该植物主产于安徽、浙江、四川等地,其中亳州产者又称亳白芍,因其量大质优而成为安徽的道地药材之一,已形成大规模规范GAP种植基地[2]。
多糖的生物活性被不断发现,如抗氧化、抗肿瘤、抗病毒、抗补体[3-7]等,其重要性日益显著。然而,许多中药多糖提取液都有很深的颜色,严重影响了深层次的研究与开发,故多糖脱色是一个重要环节。目前,常用的脱色方法有离子交换树脂法、活性炭法、双氧水法、次氯酸钠法[8-10]等,各具特点,但鲜有对白芍多糖进行脱色研究的文献报道。本实验在前期研究的基础上[11-12]继续探索白芍多糖脱色工艺,在热水浸提、乙醇分级沉淀后,得到不同分子量组分的多糖,发现其溶液颜色差异较大,故以脱色率、多糖保留率为指标,对不同组分白芍多糖进行脱色工艺研究,以期为其深入开发提供一些理论依据。
1 材料与仪器
Cary60紫外分光光度计、Nicolet6700红外光谱仪(美国Agilent公司);FD8-10冷冻干燥机(美国西盟国际公司);201203酒精计 (河北武强县亿达仪表厂);3-18K离心机 (德国Sigma公司);MS104S电子天平 (瑞士梅特勒-托利多公司)。药材 (批号2103-06)采自安徽亳州白芍种植基地,由安徽中药资源研究所刘晓龙研究员鉴定为白芍。葡萄糖 (中国食品药品检定研究院,批号110833-201205)。苯酚等试验用试剂均为分析纯。
2 方法和结果
2.1 白芍多糖分级提取 称取白芍300 g,粉碎,过60目筛,加10倍量无水乙醇浸泡24 h,双层纱布滤过,滤渣再加8倍量无水乙醇浸泡24 h,双层纱布滤过,以除去脂类、色素等杂质。
药渣自然干燥,分别用8、6倍量蒸馏水回流提取2次,每次2 h,合并滤液,水浴浓缩。待滤液温度冷却至室温后,缓慢搅拌加入无水乙醇,酒精计调节乙醇体积分数为35%,冰水浴中静置过夜,离心得到多糖沉淀,无水乙醇、丙酮、无水乙醚各冲洗2次,复溶于水后冷冻干燥,得到该组分多糖粉末,命名为PRPS35;向上述滤液中继续加无水乙醇,调节乙醇体积分数为70%,其他处理方式相同,得到PRPS70;同法调节乙醇体积分数为90%,得到PRPS90。由于继续加无水乙醇使乙醇体积分数升高后,所得多糖很少,故未做研究。
2.2 不同组分白芍多糖溶液颜色比较 分别称取 “2.1”项下制得的PRPS35、PRPS70、PRPS90粉末约20 mg,置于10 mL量瓶中(2 mg/mL),蒸馏水定容,5 000 r/min离心,取上清液备用。经观察发现,PRPL35溶液澄清无色,PRPS70溶液白色浑浊,PRPS90溶液澄清橙黄色。
上述溶液在可见光区 (400~700 nm)进行扫描,未发现有最大吸收峰。PRPS90溶液在可见光区呈现普遍吸收现象,从溶液互补色的角度考虑,选择450 nm为色素吸收检测波长。上述不同组分多糖溶液的颜色及在450 nm下的吸光度见表1,由于只有PRPS90溶液呈明显橙黄色,并且吸光度较大,而其他两个组分多糖溶液在该波长下的吸光度
较小,故本实验对PRPS90组分多糖进行脱色工艺研究。

表1 不同组分白芍多糖溶液颜色及吸光度
2.3 多糖脱色率、保留率的测定 取脱色前后的多糖溶液各2 mL,在450 nm下测定吸光度,脱色率=(溶液脱色前吸光度值-溶液脱色后吸光度值)/溶液脱色前吸光度值×100%。精密量取PYPS多糖溶液1 mL,测定吸光度,代入葡萄糖回归方程中求得溶液中葡萄糖浓度,F=W/C× D。再取脱色前后的多糖溶液各2 mL,在490 nm下测定吸光度,根据葡萄糖标准工作曲线计算多糖含有量及保留率。多糖含有量=C×D×F/W×100%(W为白芍多糖质量,mg;C为多糖溶液中葡萄糖的质量浓度,mg/m L;F为换算因子;D为稀释因子),保留率=脱色后多糖含有量/脱色前多糖含有量×100%。
2.4 标准工作曲线制备 精密吸取不同浓度葡萄糖标准溶液2.0 mL,置于具塞棕色试管中,加入6.0%苯酚溶液1.0 mL,振摇均匀,再加入浓硫酸5.0 mL,立即振摇均匀,水浴 (100℃)加热20 min,取出放至室温,490 nm波长下测定吸光度值,蒸馏水同法操作,作为空白对照。以葡萄糖质量浓度 (μg/mL)为横坐标 (C),吸光度为纵坐标(A),得到回归方程A=8.364 3C+0.028 5,线性系数r=0.999 3,表明葡萄糖标准溶液质量浓度在2.4~14.4 μg/m L之间时,与吸光度呈良好的线性关系。
2.5 白芍多糖脱色方法考察
2.5.1 粉末活性炭脱色 取“2.2”项下PRPS90多糖溶液10 m L,加入粉末活性碳0.2 g,5%NaOH调节pH=7,50℃水浴下不断搅拌30 min,离心除去粉末活性炭。放至室温后分别取脱色处理前后的多糖溶液,测定吸光度,计算脱色率及多糖保留率。
2.5.2 颗粒活性炭脱色 取“2.2”项下PRPS90多糖溶液10 m L,加入颗粒活性碳0.2 g,5%NaOH调节pH=7,50℃水浴下不断搅拌30 min,双层滤纸除去颗粒活性炭。放至室温后分别取脱色处理前后的多糖溶液,测定吸光度,计算脱色率及多糖保留率。
2.5.3 过氧化氢脱色 取 “2.2”项下PRPS90多糖溶液10 mL,加入36%过氧化氢0.3 mL,5%NaOH调节pH=7,50℃水浴下不断搅拌30 min,加热除去双氧水。放至室温后分别取脱色处理前后的多糖溶液,测定吸光度,计算脱色率及多糖保留率。
2.5.4 次氯酸钠脱色 取 “2.2”项下PRPS90多糖溶液10 mL,加入10%次氯酸钠0.3 m L,5%NaOH调节pH=7,50℃水浴下不断搅拌30 min,加热除去次氯酸钠。放至室温后分别取脱色处理前后的多糖溶液,测定吸光度,计算脱色率及多糖保留率。
2.6 不同脱色方法试验考察结果 由表2可知,粉末活性炭脱色时,多糖保留率较高,但其脱色率最低,而且脱色后活性炭的滤除也较为困难;颗粒活性炭、次氯酸钠脱色时,多糖保留率较高,但脱色率均不满意;过氧化氢脱色时,脱色率和多糖保留率均最高。因此,选用过氧化氢脱色进行研究。
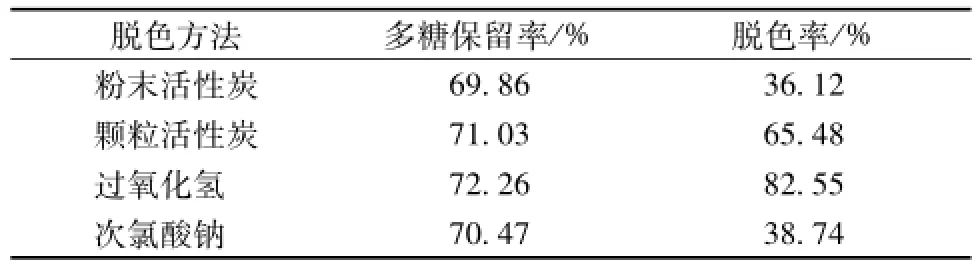
表2 不同脱色方法试验结果
2.7 过氧化氢脱色单因素试验 取 “2.2”项下PRPS90(2 mg/mL)组分白芍多糖溶液,每组20 m L,进行过氧化氢脱色单因素试验,分别考察过氧化氢加入量、脱色时间、pH、温度对脱色率及多糖保留率的影响。
2.7.1 过氧化氢加入量对多糖脱色率及保留率的影响 由图1可知,当过氧化氢体积分数增大到20%时,多糖的脱色率增加幅度较大,但保留率缓慢降低;当体积分数超过20%时,多糖脱色率增加非常缓慢,但保留率急剧下降。综合考虑,过氧化氢体积分数不宜超过20%。
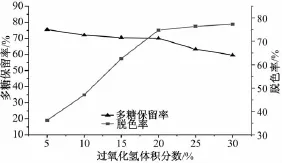
图1 过氧化氢体积分数对脱色率及多糖保留率的影响
2.7.2 脱色时间对多糖脱色率及保留率的影响 由图2可知,在1~4 h内,随着脱色时间的增加,脱色率迅速增加,多糖保留率缓慢降低;当脱色时间超过4 h时,脱色率缓慢增加,但多糖保留率急剧降低。因此,脱色时间不宜超过4 h。
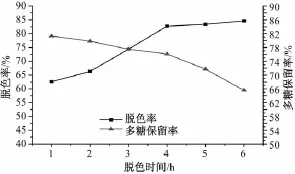
图2 脱色时间对脱色率及多糖保留率的影响
2.7.3 pH对多糖脱色率及保留率的影响 由图3可知,pH为5~9时,脱色率急剧增加,然后趋于平缓,但多糖保留率随pH值的变化不明显。因此,脱色pH选择在9左右较好。
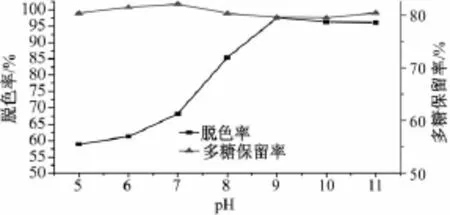
图3 pH对脱色率及多糖保留率的影响
2.7.4 温度对多糖脱色率及保留率的影响 由图4可以看出,在50~70℃时,随着温度升高,脱色率增加幅度较大;在70~90℃时,变化不明显。但在50~70℃时,多糖保留率逐渐下降。综合考虑,脱色温度以70℃为宜。
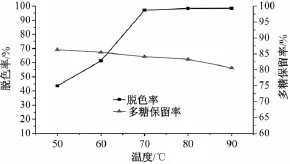
图4 温度对脱色率及多糖保留率的影响
2.8 正交试验 由单因素试验结果,选取过氧化氢加入量、脱色时间、pH、温度作为因素,设计4因素3水平进行正交试验,见表3。脱色作用指标为脱色率及多糖保留率,对综合得分进行数据处理,两者各赋予50%权重,综合得分按脱色率×0.5+多糖保留率×0.5进行加权求和,试验结果及方差分析见表4、表5。由表可知,影响脱色率的因素均依次为C>A>B>D,影响过氧化氢对多糖保留率的因素均依次为C>A>D>B,即A和C为主要影响因素,而B和D为次要影响因素。从减少耗能角度考虑,宜选用B1和D1,另外A、C因素各水平间有显著性差异,故选A3、C2;B、D因素从考虑节能角度出发,宜选用B1、D1。综上所述,最佳脱色条件为A3B1C2D1,即脱色温度65℃,脱色时间3.5 h,pH=9,过氧化氢体积分数20%。

表3 因素水平
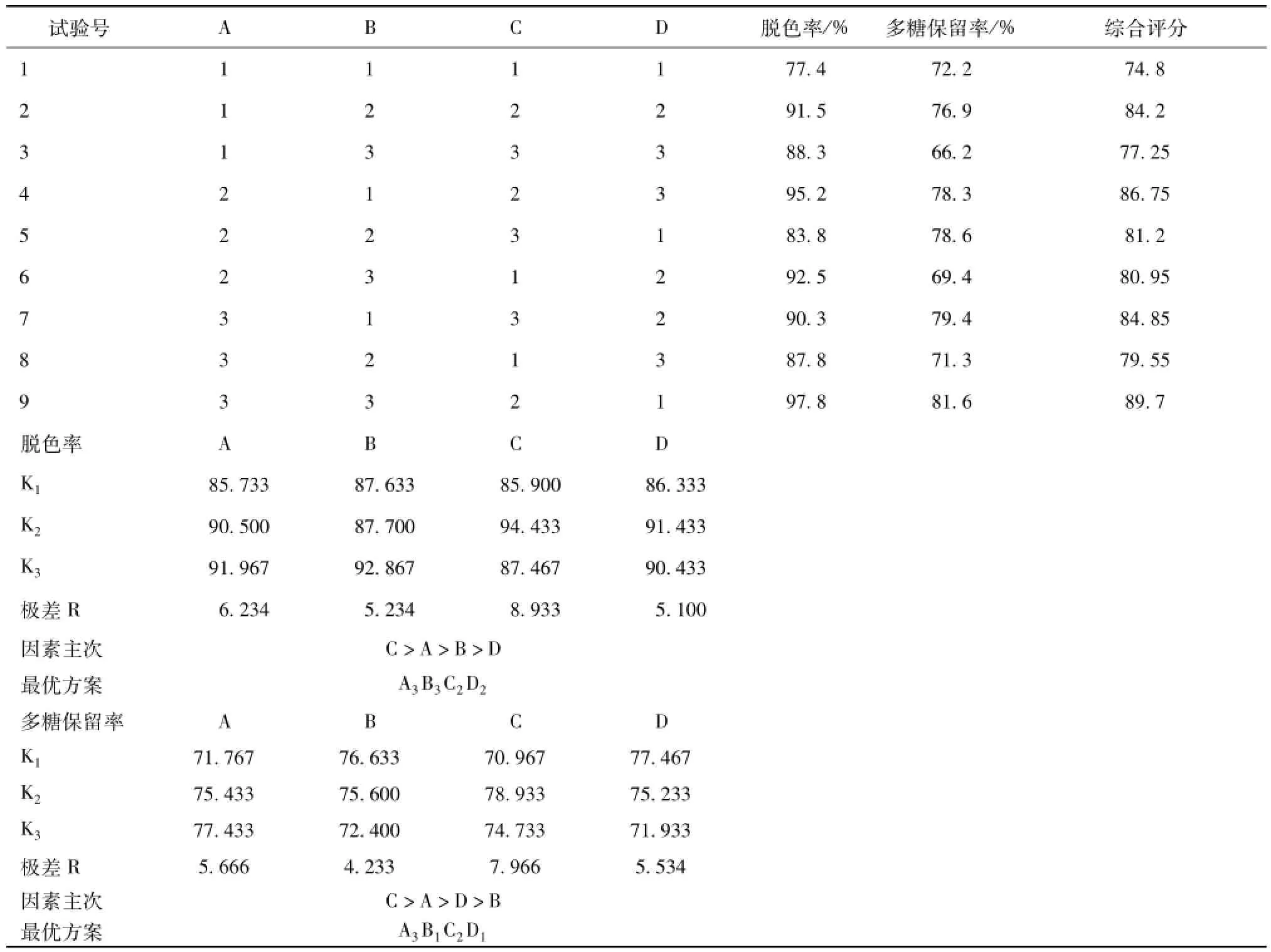
表4 正交试验设计表及结果
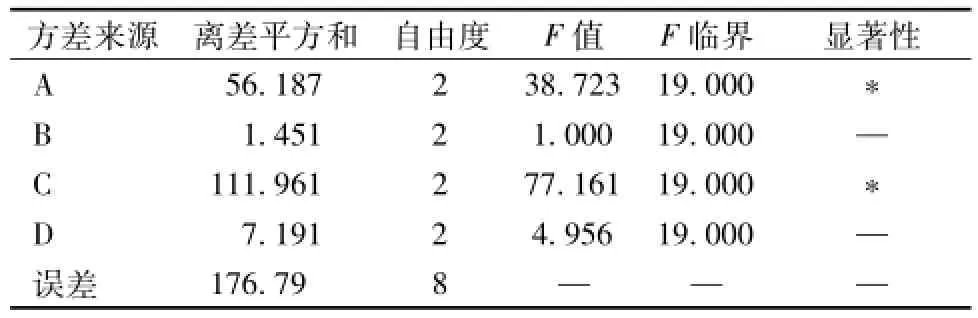
表5 方差分析
2.9 验证试验 取白芍多糖溶液 (2 mg/mL)5份,每份20 mL,按照上述最优方案进行脱色试验,测得平均脱色率及多糖保留率分别为95.82%、85.26%,RSD分别为0.308 7%、0.429 3% (n=5),提示该方案重复性良好。
2.10 脱色前后结构初步比较
2.10.1 脱色前后UV图谱对比 取“2.2”项下PRPS90(2 mg/mL)组分白芍多糖溶液稀释后,按 “2.8”项下最佳工艺进行脱色,然后分别对脱色前后的溶液进行UV扫描 (190~400 nm),结果见图5。由图可知,脱色前后白芍PRPS90溶液紫外光谱图都呈多糖特征吸收,其中190 nm波长处附近呈强吸收,脱色前后无明显不同。
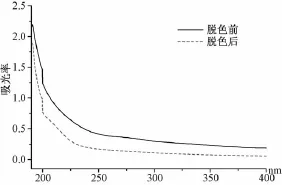
图5 PRPS90多糖脱色前后UV(190~400 nm)图谱比较
2.1 0.2 脱色前后FT-IR图谱对比 取“2.2”项下PRPS90(2 mg/mL)组分白芍多糖溶液,按 “2.8”项下最佳工艺进行脱色,然后将脱色前后的溶液进行冷冻干燥,分别取脱色前后的多糖粉末2、100 mg,玛瑙研钵中充分研磨均匀,红外灯下干燥,压片,4 000~400 cm-1处扫描,结果见图6。由图可知,脱色前后多糖IR无明显差异,其特征吸收峰位和强度基本相似。
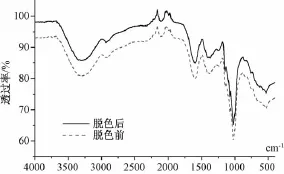
图6 PRPS90多糖脱色前后IR图谱(4 000~400 cm-1)比较
对脱色前后的PRPS90溶液进行UV(190~400 nm)及IR(4 000~400 cm-1)图谱分析,未发现其多糖结构存在光谱学差异,表明双氧水脱色未对PRPS90部分多糖结构造成明显影响。
3 讨论
3.1 醇沉条件 水提醇沉是分离中药多糖的常用手段之一,热水提取后加入乙醇,沉淀多糖。通常水提液浓缩后溶液体积大为减少,可为后面的醇沉提供便利,但应注意水提液浓缩后加入乙醇沉淀时可能会导致共沉[10]现象发生,得到不同分子量多糖时会产生很大的误差。
3.2 本实验首次对分级醇沉技术所得不同分子量的白芍多糖组分进行脱色工艺探索,发现白芍色素主要在分子量最小的PRPS90部分。目前,大部分关于中药多糖脱色的文献报道集中在总多糖,随着对多糖研究的深入[13],分级醇沉技术可以将不同分子量的多糖进行初步分离,为其单糖组成、空间结构等方面的探索提供便利。同时,亦可以通过比较不同分子量多糖的药理活性来筛选活性多糖所在的部位,更加有利于进一步相关研究。
3.3 优良的脱色剂应具有较理想的脱色效果、较高的多糖保留率,同时又易于从多糖中清除,但前提是要保证脱色前后多糖的结构不发生改变。化学脱色法 (如过氧化氢等)的优点在于脱色效率高、使用方便、易于从多糖中清除等,缺点是具有一定的氧化性,对多糖的结构存在潜在的影响;各种树脂、Al2O3等具有脱色条件温和、脱色效率较高、不影响多糖结构等优点,但缺点是成本高、操作困难、不易再生等。实验显示,过氧化氢对白芍多糖的脱色效果十分显著,但其氧化性较强,鉴于实验室条件,只对脱色前后PRPS90组分多糖做了UV、IR初步对比分析,从紫外、红外图谱主要吸收波数及强度中未发现明显变化,可认为PRPS90组分多糖在过氧化氢脱色过程中未发生结构变化,具体还需要作更深入的研究来证实。
[1] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:96-97.
[2] 张丽萍,杨春清,赵永华,等.安徽白芍规范化种植加工技术研究及SOP的制定[J].世界科学技术:中医药现代化,2004,6(3):63-88.
[3] 王书华,饶 娜,安 芳.金莲花多糖的分离纯化及其抗氧化作用研究[J].中成药,2013,35(11):2384-2389.
[4] Wong C K,Leung K N,Fang K P,et al.Immunomodulatory and anti-tumor polysaccharides from medicinal plants[J].J Int Med Res,1994,22(6):299-312.
[5] 罗仕华,郑传胜,黎维勇,等.白及多糖体外抗肿瘤试验研究[J].中成药,2014,36(1):165-168.
[6] 汪 芸,陶移文,田庚元.白芍多糖的制备、理化性质及抗肿瘤活性研究[J].中国现代中药,2013,15(8):645-648.
[7] Wasser S P.Current findings,future trends,and unsolved problems in studies ofmedicinalmushrooms[J].Appl Microbiol
Biotechnol,2011,89(5):1323-1332.
[8] 华 芳,王举涛,桂双英.桔梗边角料中桔梗多糖的分离纯化研究[J].中成药,2012,34(7):1380-1382.
[9] 付学鹏,杨晓杰.植物多糖脱色技术的研究[J].食品研究与开发,2007,28(11):166-169.
[10] 方积年,丁 侃.天然药物-多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-347.
[11] 秦亚东,李 飞,周 宙.不同提取方式对白芍化学成分含量的影响[J].现代中药研究与实践,2014,28(4):50-53.
[12] 秦亚东,周娟娟,李 飞,等.白芍生品及其炮制品中多糖及总糖的含量测定[J].长春中医药大学学报,2014,30(5):804-807.
[13] 董 群,方积年.多糖在医药领域中的应用[J].中国药学杂志,2001,36(10):649-652.
R284
B
1001-1528(2015)12-2783-05
10.3969/j.issn.1001-1528.2015.12.049
2015-04-17
安徽省高校省级科研项目 (KJ2013B114);安徽省高职高专院校专业带头人 (皖教秘人 [2011]2号)
秦亚东 (1979—),男,硕士,讲师,研究方向为中药及复方药效物质基础研究。Tel:13655593690,(0553)4836123,E-mail:qydgy2007@163.com
