高迁移率蛋白B1对肝细胞癌血管生成的影响*
2015-12-07杨倩邓菊庆冯晓洁庄利萍于璐孙洁
杨倩,邓菊庆,冯晓洁,庄利萍,于璐,孙洁
(昆明医科大学附属甘美医院病理科,云南 昆明 650011)
·论著·
高迁移率蛋白B1对肝细胞癌血管生成的影响*
杨倩,邓菊庆,冯晓洁,庄利萍,于璐,孙洁
(昆明医科大学附属甘美医院病理科,云南 昆明 650011)
目的探讨高迁移率蛋白B1(HMGB1)在人肝细胞癌组织中的表达及其与血管生成的关系。方法选择30例肝细胞癌,运用免疫组织化学方法检测HMGB1和血管内皮生长因子(VEGF)的表达,并测定微血管密度,进行统计学相关性分析。结果HMGB1和VEGF在肝细胞癌中呈强弱不等的表达,总阳性率分别为20/30(66.7%)和23/30(76.7%),高于癌旁组织及正常对照组织(P<0.05),并且HMGB1与VEGF的表达具有相关性(r=0.408,P<0.05)。HMGB1与肝细胞癌微血管密度正相关(r=0.529,P=0.008);当HMGB1阳性细胞数<25%时,微血管密度无明显增加;当阳性细胞数>25%时,癌组织微血管密度增加。结论在肝细胞癌中,HMGB1与VEGF表达上调有关,与肝细胞癌血管生成相关,HMGB1可能参与了肿瘤血管生成。
高迁移率蛋白B1;血管内皮生长因子;肝细胞癌;肿瘤血管生成;微血管密度
高迁移族蛋白1(high mobility group protein box-1,HMGB1)在多种人类恶性肿瘤中存在高表达,与肿瘤的侵袭、转移密切相关。而血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前已知作用最强的血管生长因子之一。本研究应用免疫组织化学染色方法对肝细胞癌组织中HMGB1、VEGF表达进行检测,并检测肝癌组织微血管密度(microvessel density,MVD),研究HMGB1与VEGF表达及其与微血管生成的关系,从而探讨HMGB1在肝细胞癌血管生成中的作用。
1 资料与方法
1.1一般资料
标本来自2008年1月-2011年3月昆明医科大学附属甘美医院肝胆外科的原发性肝癌患者30例。以距癌灶边缘5 cm为分界分别留取肝癌癌灶组织和非癌组织。其中,男24例,女6例;年龄36~75岁,平均(59.6±10.5)岁;瘤体<5cm 16例,瘤体≥5cm 14例。所有标本均经病理组织学证实为原发性肝细胞肝癌,术前患者未行任何治疗。另取5例正常肝组织为对照组。标本常规脱水、4%甲醛固定、石蜡包埋,连续切片(片厚4μm)。
1.2方法
1.2.1免疫组织化学法免疫组织化学采用SP法,兔抗人HMGB1多克隆抗体购自美国PTG公司,VEGF及CD34抗体购自美国Gene公司,SP免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。DAB显色,以PBS液代替一抗作为阴性对照,以已证实HMGB1、VEGF、CD34染色阳性的肝癌标本作阳性对照。
1.2.2微血管计量采用免疫组织化学法(同上),以CD34为指标,参考WEIDNER等[1]报道的微血管计量方法,即每一个染成棕黄色,可与周围血管、肿瘤细胞及其他结缔组织区分开的内皮细胞或内皮细胞簇,不论管腔和红细胞出现与否,均作为一个单一的、可计数的血管。取实验组织中HMGB1表达计为阴性、弱阳性、中等阳性、强阳性(0,1,2,3分)的切片,于400倍视野内计数微血管,各取5个高倍视野的均值,四舍五入后作为MVD值(微血管个数/0.42 mm2)。由2名病理科医师采用双盲原则评定。1.2.3结果判断①HMGB1定位于细胞质和胞核,呈棕黄色至棕褐色颗粒状。每张切片在高倍镜下(×200)随机观察5个视野,计数200个细胞/视野,阳性细胞数<10%为表达阴性(-),阳性细胞数10%~25%为表达弱阳性(+),阳性细胞数26%~50%为表达中等强度阳性(++),阳性细胞数>50%为表达强阳性(+++),分别计为0,1,2,3分。②VEGF定位于细胞浆和胞膜,呈棕黄色至棕褐色颗粒状。以胞浆及胞膜着色强度打分:强阳性计为3分,阳性计为2分,弱阳性计为1分,阴性计为0分。1.3统计学方法
采用SPSS 18.0统计软件进行Spearman相关分析及非参数检验(Kruskal-Wallis法),P<0.05为差异有统计学意义。
2 结果
2.1HMGB1的表达
在30例肝细胞癌标本中,HMGB1总阳性率为66.7%(20/30),其中强阳性3例,阳性13例,弱阳性4例,阴性10例。癌旁组织中HMGB1总阳性率为40%(12/30),均为弱阳性。正常对照组织5例,无HMGB1表达。见图1。
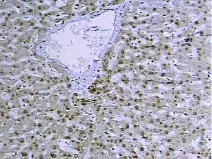
图1 免疫组织化学显示HMGB1在肝癌组织中呈阳性表达,定位于细胞核(×100)
2.2VEGF的表达
在30例肝细胞癌标本中,VEGF总阳性率为76.7%(23/30),其中强阳性7例,中度阳性13例,弱阳性3例,阴性7例。癌旁组织中VEGF总阳性率为46.7%(14/30),均为弱阳性。正常对照组织5例,2例出现小灶状VEGF弱表达。在血管和胆管中有时可见VEGF弱表达。见图2。

图2 免疫组织化学显示VEGF在肝癌组织中呈阳性表达,定位于胞浆(×100)
2.3HMGBI与VEGF表达的关系
在同一个病例中,HMGB1和VEGF的表达是不均一的,可以表现为部分肝细胞阳性而部分为阴性;然而,在这些病例里发现,HMGB1和VEGF在同一部位有着相似的表达,同为阴性或同为阳性。见图3~6。
对于多个区域的HMGB1和VEGF的强度表达进行采样及分析,采用SPSS 18.0统计软件进行
Spearman相关分析,HMGB1与VEGF表达存在相关性,相关系数r=0.408,P=0.025。

图3 HMGB1在肝癌组织中呈阳性表达(×40)
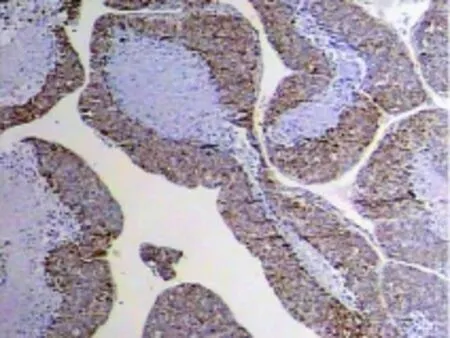
图4 在肝细胞癌中,VEGF与HMGB1的阳性表达一致(×40)

图5 HMGB1在部分胆管上皮内可呈阳性表达(×100)

图6 VEGF在同一胆管上皮内呈阳性表达(×100)
2.4HMGBI与微血管密度的关系
在20例有HMGB1表达的病例中,选取癌组织表达HMGB1为阴性、弱阳性、中等阳性、强阳性(0,1,2,3分)的视野,进行微血管密度测定及分析。结果:HMGB1与微血管密度正相关(相关系数r= 0.529,P=0.008);HMGB1阴性与HMGB1弱阳性组微血管密度差异无统计学意义(秩均值5.67、6.78,P=0.643>0.05);中度阳性与强阳性组微血管密度差异无统计学意义(秩均值6.94、5.17;P=0.459>0.05);弱阳性与中度阳性组微血管密度具有统计学差异(秩均值5.83、13.17;P=0.004<0.05),弱阳性与强阳性组微血管密度差异有统计学意义(秩均值5.06、10.83;P=0.016<0.05)。在肝细胞癌中,当HMGB1阳性细胞数<25%时,微血管密度无明显增加;当阳性细胞数>25%时,癌组织微血管密度增加。见图7。
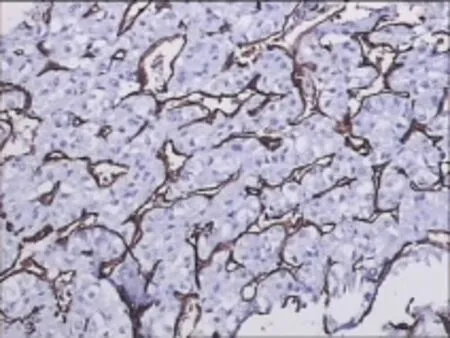
图7 肝细胞癌微血管密度增加(×200)
3 讨论
HMGB1最初发现时是一种广泛存在的DNA结合蛋白,一般情况下,HMGB1在多数细胞中呈基础水平表达,它参与DNA的转录、复制、修复以及细胞运动等。随着研究的深入,发现HMGB1可作为一种细胞因子,在巨噬细胞、单核细胞受内毒素、IL-1、TNF刺激后均能释放。HMGB1还可由受损或坏死细胞释放。在肿瘤的发生、发展研究方面,已发现HMGB1与多种肿瘤的侵袭和转移有关[2]。
一些报道提示,HMGB1与肿瘤血管生成有关:HMGB1及其受体RAGE的结合会导致NF-κB的激活,进而使白细胞黏附分子和前炎症反应分子及血管生成因子表达上调[3];HMGB1与肝磷脂形成的复合物也能促进血管生成[4];在体内外实验中,人们利用抗体封闭HMGB1后,发现血管生成受到抑制[5]。MITOLA等[6]报道在体外实验中,HMGB1可以激活内皮细胞的MAPK细胞外信号调解激酶(EPK)1/2信号活化,促进内皮细胞增殖、修复机械性受损的内皮细胞。HMGB1也可以通过直接活化内皮祖细胞和造血干细胞,动员其迁移至缺血区域,来促进血管新生[7]。
VEGF是目前比较明确的血管生长因子,癌细胞的生长、转移依赖新生血管的形成,VEGF在肝癌中高表达,对肝癌新生血管形成及肿瘤生长和转移起
重要作用。在鳞状细胞癌、肺癌、肾母细胞瘤等多种肿瘤中,HMGB1与VEGF的关系已有文献报道[8-9]。在肝细胞癌中,也发现HMGB1与微血管生成相关[10]。研究发现,HMGB1与VEGF-A的生成相关,阻断HMGB1通路使得视网膜细胞株(RGC-5)中VEGFA减少[11]。SASAHIRA等运用重组人HMGB1蛋白作用于口腔鳞状细胞癌细胞后,能促进肿瘤细胞VEGF的表达,亦从体外细胞水平为HMGB1参与到肿瘤血管生成过程中提供了实验证据[12]。
本研究发现HMGB1与VEGF蛋白在肝细胞癌组织中的表达呈正相关,提示在肝细胞癌血管生成过程中,异常表达增高的HMGB1与VEGF存在相关性。可能存在HMGB1为促血管生成因子VEGF的上调提供了协同作用。另外,当HMGB1表达达到一定程度(>25%)时,癌组织微血管密度增加,提示HMGB1对肿瘤新生血管的作用可能在一定范围内呈量效关系。HMGB1可作为评估肝细胞癌肿瘤血管生成的一个观测指标,可能成为阻断肝癌血管生成的有效靶点。
[1]WEI DNER N.Chapter 14.Measuring intratumoral microvessel density[J].Methods Enzymol,2008,444:305-323.
[2]陈艳美,贺福初,林成招.HMGB1在肿瘤转移中的作用及其机制的研究进展[J].中国癌症杂志,2012,22(10):784-789.
[3]VAN BEIJNUM JR,BUURMAN WA,GRIFFIOEN AW.Convergence and amplification of toll-like receptor(TLR)and receptor for advanced glycation end products(RAGE)signaling pathways via high mobility group B1(HMGB1)[J].Angiogenesis,2008,11(1): 91-99.
[4]WAKE H,MORI S,LIU K,et al.Histidine-rich glycoprotein inhibited high mobility group box 1 in complex with heparin-induced angiogenesis in matrigel plug assay[J].Eur J Pharmacol, 2009,623(1-3):89-95.
[5]VAN BEIJNUM JR,DINGS RP,VAN DER LINDEN E,et al. Gene expression of tumor angiogenesis dissected:specific targeting of colon cancer angiogenic vasculature[J].Blood,2006,108(7): 2339-2348.
[6]MITOLA S,BELLERI M,URBINATI C,et al.Cutting edge:extracellular high mobility group box-1 protein is a proangiogenic cytokine[J].J.Immunol,2006,176(1):12-15.
[7]CHAVAKIS E,HAIN A,VINCI M,et al.High-mobility group box 1 activates integrin-dependent homing of endothelial progenitor cells[J].Circ Res,2007,100(2):204-212.
[8]李焱,蒋勇,史立群,等.HMGB1和VEGF-C/D在结肠癌组织中的表达及与淋巴结转移之间的关系[J].第三军医大学学报,2006,28(11): 1237-1239.
[9]张大,张国锋,王家祥,等.儿童肾母细胞瘤HMGB1、RAGE及VEGF的表达及意义[J].中华小儿外科杂志,2011,32(7):534-538.
[10]周宝勇.HMGB1在肝癌中的表达及其与VEGF,MVD的关系[J].重庆医科大学学报,2012,37(5):409-412.
[11]LEE JJ,HSIAO CC,YANG IH,et al.High-mobility group box 1 protein is implicated in advanced glycation end products-induced vascular endothelial growth factor A production in the rat retinal ganglion cell line RGC-5[J].Mol Vis,2012,18:838-850.
[12]SASAHIRA T,KIRITA T,BHAWAL UK,et al.The expression of receptor for advanced glycation end products is associated with angiogenesis in human oral squamous cell carcinoma[J]. Virchows Arch,2007,450(3):287-295.
(张蕾 编辑)
Effect of high moboility group box 1 protein on angiogenesis in hepatocellular carcinoma*
Qian YANG,Ju-qing DENG,Xiao-jie FENG,Li-ping ZHUANG,Lu YU,Jie SUN
(The Affiliated Galmette Hostpital,Kunming Medical University, Kunming,Yunnan 650011,P.R.China)
【Objective】To investigate the expression of high mobility group box 1 protein(HMGB1)in hepatocellular carcinoma and its relationship to tumor angiogenesis.【Methods】The immunohistochemical SP method was used to detect the expressions of HMGB1 and vascular endothelial growth factor(VEGF)in the hepatocellular carcinoma tissue and paracancerous tissue of 30 patients.Microvessel density(MVD)was also measured.【Results】With high or low intensity,HMGB1 was expressed in the cancenoma tissue of 20 cases(66.7%)and VEGF in the cancenoma tissue of 23 cases(76.7%)among the 30 hepatocellular carcinoma patients,the positive rates were significantly higher than those of the pericarcinous tissue(40%,46.7%)and non-cancerous tissue(P<0.05).The expression of HMGB1 was related with VEGF(r=0.408,P<0.05). HMGB1 also related to MVD(r=0.529,P=0.008),MVD increased when the positive rate of HMGB1 was greater than 25%.【Conclusions】HMGBl and VEGF are closely correlated in hepatocellular carcinoma. HMGB1 may be involved in angiogenesis of hepatocellular carcinoma.
high moboility group box 1 protein(HMGB1);vascular endothelial growth factor;hepatocellular carcinoma;angiogenesis;microvessel density
R735.7
A
1005-8982(2015)24-0005-04
2015-04-10
云南省教育厅科学研究基金(No:2011C088)
