肾血管性高血压大鼠肾组织睾酮受体蛋白及丝裂素活化蛋白激酶磷酸酶1的表达*
2015-12-04杨晓村燕树勋杨国杰张彦周于超男孙丽娜
杨晓村,王 颖#,燕树勋,杨国杰,张彦周,于超男,李 渊,孙丽娜
1)郑州大学第一附属医院老年医学科 郑州450052 2)河南省高等学校临床医学重点学科开放实验室 郑州450052 3)河南中医学院第一附属医院内分泌科 郑州450008 4)郑州大学第一附属医院心内科 郑州450052
高血压性肾脏损害是终末期肾病(end-stage renal disease,ESRD)最主要的原因之一[1],其具体机制尚未明确。有研究[2]证实,肾素-血管紧张素系统的过度激活及其偶联的丝裂素活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号转导通路的失衡等在高血压性肾脏损害的发生发展中起重要作用。近年来,睾酮及其受体表达水平的变化在心血管系统中的作用受到越来越多的关注,但其具有保护或抑制作用尚存在异议[3-4]。作者所在的课题组前期研究[5]发现,睾酮能抑制AngⅡ诱导的心肌成纤维细胞增殖及胶原合成,对心血管有保护作用,其信号转导通路与MAPKs 相偶联。睾酮通过睾酮受体(androgen receptor,AR)来发挥生物学作用,然而AR 在高血压性肾脏损害中的作用及机制尚不清楚。该研究以AR 为靶点,以肾血管性高血压大鼠为模型,检测大鼠肾组织中AR 和丝裂素活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase-1,MKP-1)蛋白的表达,探讨AR 在高血压性肾脏损害中的生物学意义及可能机制。
1 材料与方法
1.1 实验动物、主要试剂与仪器 30只清洁级健康雄性Wistar 大鼠(编号0008508),28日龄,体重(75 ±5)g,购自河南省实验动物中心。兔抗鼠多克隆AR 抗体(sc-815)、兔抗鼠多克隆MKP-1 抗体(sc-1102)(Santa Cruz 公司),抗兔IgG 免疫组化试剂盒(北京博奥森生物技术有限公司),DAB 底物显色试剂盒(北京中杉金桥生物技术服务有限公司),其他试剂为市售分析纯。电热恒温干燥箱(上海泸南科学仪器厂202-1 型),冰冻切片机(德国莱卡CM1900),摊片烤片机(德国莱卡HI 1220 型),Image-Pro Plus 6.0 图像分析系统(Media Cybernetics公司),大鼠尾套血压仪(日本Softron 公司,BP89A型),显微镜(日本Olympus 公司,dp71 型)。
1.2 实验动物分组与处理 实验大鼠分为3组:对照组(10只)、假手术组(10只)、模型组(10只)。模型组:采用“两肾一夹”法制造肾血管性高血压大鼠模型。用100 g/L 的水合氯醛(0.003 mL/g 体重)腹腔注射麻醉。沿腹正中线打开腹腔,钝性分离左肾动脉,用“Ω”形银夹套住肾动脉,制造左侧肾动脉狭窄,对侧肾脏和动脉不触及。青霉素腹腔注射预防感染,关腹。在造模前,造模后第1、2、3 及8周末,采用Tail-Cuff 法测量各组大鼠安静、清醒状态下尾动脉收缩压,每只测3次,取平均值。以造模后血压高于120 mmHg(1 mmHg =0.133 kPa)且比处理前高20 mmHg 以上为高血压模型形成。假手术组:只分离左肾动脉不放置银夹,余手术同前。对照组:不予手术。
1.3 大鼠肾脏质量/体重检测 造模8 周后,经腹腔注射100 g/L 的水合氯醛麻醉,称取体重后开腹取出右肾称量,并计算右肾质量/体重比值。
1.4 肾组织形态学观察 分别取大鼠左、右肾组织,置于40 g/L 多聚甲醛中固定,HE 染色,光镜下观察。
1.5 大鼠肾组织中AR、MKP-1 蛋白表达的检测取各组大鼠右肾组织,蜡块包埋、切片、脱蜡、水化,过氧化氢孵育,抗原热修复,血清封闭,滴加兔抗鼠多克隆AR 抗体(按1∶50 稀释)或MKP-1 抗体(按1∶100 稀释),4℃孵育过夜,37℃复温30 min 后PBS 冲洗,滴加二抗(抗兔IgG)后冲洗、DAB 染色、常规梯度乙醇脱水,二甲苯透明,中性树胶封片。采用Image-Pro Plus 6.0 图像分析系统测定两种蛋白的光密度值。
1.6 统计学处理 采用SPSS 15.0 处理数据。采用重复测量数据的方差分析比较3组大鼠造模前后不同时期的血压,采用单因素方差分析比较3组大鼠肾组织AR、MKP-1 蛋白表达水平的差异,两两比较采用LSD-t 检验;采用Pearson 相关分析观察对照组和模型组大鼠肾组织中AR 及MKP-1 蛋白表达水平的关系。检验水准α=0.05。
2 结果
2.1 造模前后各组大鼠不同时期的血压比较 造模1、2、3、8 周后,与对照组相比,假手术组血压值无变化,模型组血压升高。见表1。

表1 3组大鼠造模前后不同时期血压 mmHg
2.2 造模8 周后3组大鼠右肾质量/体重比值比较造模8 周后对照组、假手术组和模型组大鼠右肾质量/体重比值分 别为(0.64 ± 0.09)%、(0.62 ±0.11)%和(1.23 ± 0.12)% (F = 107.185,P<0.001);与对照组相比,模型组大鼠右肾质量/体重比值升高(P<0.05)。
2.3 3组大鼠肾脏形态学观察 结果见图1。与对照组相比,假手术组在肾脏形态学上无明显变化。模型组左肾(左肾动脉狭窄8 周后)肾小球萎缩、毛细血管丛塌陷;右肾大部分肾小球水肿、肥大,入球小动脉和小叶内动脉管壁增厚、水肿,部分肾小球毛细血管丛萎缩、塌陷。

图1 3组大鼠肾脏形态学观察(HE,×400)
2.4 3组大鼠右肾组织中AR 蛋白的表达 见图2、表2。由图2 可见,3组大鼠右肾组织中均存在一定量的AR 蛋白。由表2 可知,模型组大鼠AR 蛋白的表达水平较对照组降低。
2.5 3组大鼠右肾组织中MKP-1 蛋白的表达 见图2、表2。由表2 可知,模型组大鼠右肾组织中MKP-1 蛋白的表达水平较对照组降低。

图2 3组大鼠右肾组织中AR 和MKP-1 蛋白的表达(SP,×400)
2.6 3组大鼠右肾组织中AR 及MKP-1 蛋白表达水平的关系 对照组中,MKP-1 蛋白与AR 蛋白表达呈正相关,r =0.457,P =0.184;模型组中,r =0.744,P=0.014。
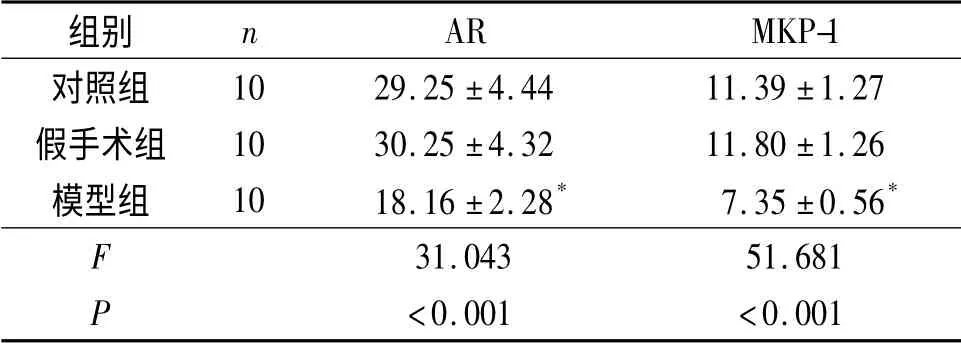
表2 3组大鼠右肾组织中AR 及MKP-1 蛋白的表达水平
3 讨论
AR 是一种核蛋白,主要分布于内分泌生殖系统[6]。已证实[6-7]血管内皮细胞、平滑肌细胞、心肌细胞及肾脏、血、神经系统中均有AR 存在,其既可以通过与睾酮结合,通过反应元件来抑制或者激活靶基因的表达,又可以通过EGFR、IGFR、G 蛋白偶联受体途径发挥不依赖激素的作用,还可以通过与c-Fos、c-Jun B、Sp1 等相互作用发挥不依赖ERE 元件的调控功能。有研究[8-10]表明,AR 表达水平的变化与多种疾病的发生发展有关,如冠状动脉粥样硬化、前列腺增生、炎症反应等,但关于其在高血压性肾脏损害中发挥保护或抑制作用及其信号转导机制尚不清楚。Pausova 等[11]研究表明,在青少年男性中,AR 蛋白表达水平的下调与内脏脂肪的代谢以及血压升高相关。楚新梅等[12]的研究表明,老年男性高血压患者中睾酮水平明显降低,且睾酮水平与AR 呈负相关,AR 与舒张压呈正相关。该研究以肾血管性高血压大鼠为模型,采用免疫组化法检测肾组织中AR 表达水平的改变。结果发现,与对照组相比,模型组中AR 蛋白的表达下调,提示AR 参与了高血压肾脏损害的过程。
MAPKs 是多种细胞内外信号转导通路的汇聚点,与细胞的生长、增殖、分化关系密切。研究[2,13]证实,高血压的发生发展与肾素-血管紧张素系统的过度激活及其偶联的MAPKs 信号转导通路的失衡等关系密切。MKP-1 是MAPKs 的特异性调节磷酸酶,与MAPKs 失活关系密切。以往的研究[14]证实,在高血压心肌重构过程中,不仅仅是单纯MAPKs 的过度激活,同时还合并有MAPKs 的灭活障碍,表现为MKP-1 蛋白低表达状态。已有研究[2]证实,在高血压性肾脏损害中存在MAPKs 的过度激活,但是否同样存在MAPKs 的灭活失衡,未见相关报道。该研究发现,正常肾脏中存在有一定量的MKP-1 蛋白的表达;且与对照组相比,模型组MKP-1 蛋白表达下调。提示在高血压肾脏损害过程中也存在有MKP-1可诱导性减低的状态,造成MAPKs 失活障碍。进一步的相关分析结果显示,在模型组中,AR 蛋白与MKP-1 蛋白表达水平呈正相关。由此推测,在高血压性肾脏损害过程中,AR 与MAPK 信号转导偶联、相互作用,共同作用于该过程的发生发展。其具体机制可能是,在体外AR 可被MAPKs、AKT 及PKC等磷酸化而发挥生物学作用[15]。
综上所述,在高血压性肾脏损害过程中存在AR 及MKP-1 蛋白表达水平的下降,且二者呈正相关。提示AR 蛋白表达下调参与了高血压性肾脏损害过程,并与MAPKs 信号转导通路偶联;这可能为临床高血压性肾脏损害防治提供新线索或者新的药物靶点。
[1]黄裕立,任昊,许顶立.高血压前期是发生终末期肾病的独立危险因素[J].中华内科杂志,2014,53(3):222
[2]姚丽,西山成,安部阳一,等.MAPKs 激活在慢性醛固酮灌注所致高血压肾损伤中的作用[J].中国现代医学杂志,2004,14(21):15
[3]Corona G,Maggi M.Testosterone supplementation and cardiovascular risk[J].Trends Cardiovasc Med,2015,25(3):258
[4]Morgentaler A.Testosterone deficiency and cardiovascular mortality[J].Asian J Androl,2015,17(1):26
[5]孙丽娜,王颖,燕树勋,等.睾酮对血管紧张素Ⅱ诱导的乳鼠心肌成纤维细胞增殖和胶原合成的影响[J].郑州大学学报:医学版,2014,49(4):461
[6]刘长青,吴赛珠,王子东,等.睾酮对人单核细胞雄激素受体蛋白表达的影响[J].第一军医大学学报,2004,24(4):389
[7]Sajjad Y,Quenby S,Nickson P,et al.Androgen receptors are expressed in a variety of human fetal extragenital tissues:an immunohistochemical study[J].Asian J Androl,2007,9(6):751
[8]Huang CK,Pang H,Wang L,et al.New therapy via targeting androgen receptor in monocytes/macrophages to battle atherosclerosis[J].Hypertension,2014,63(6):1345
[9]郝卫军,曹剑,王浩,等.性激素和雄激素受体与老年男性糖尿病的相关性研究[J].中华老年医学杂志,2009,2(12):986
[10]Li S,Li X,Li Y.Regulation of atherosclerotic plaque growth and stability by testosterone and its receptor via influence of inflammatory reaction[J].Vascul Pharmacol,2008,49(1):14
[11]Pausova Z,Abrahamowicz M,Mahboubi A,et al.Functional variation in the androgen-receptor gene is associated with visceral adiposity and blood pressure in male adolescents[J].Hypertension,2010,55(3):706
[12]楚新梅,李小鹰,梁春红,等.雄激素及其受体和雌激素变化在老年男性高血压患者中的初步研究[J].中华老年心脑血管病杂志,2007,9(2):98
[13]吕颖,孙超峰,张军波,等.自发性高血压大鼠大、中动脉壁AT1 和AT2 受体表达的增龄性变化[J].西安交通大学学报:医学版,2012,33(5):598
[14]Wang JM,Wang Y,Zhu ZS,et al.Diverse effects of longterm treatment with imidapril and irbesartan on cell growth signal,apoptosis and collagen type Ⅰexpression in the left ventricle of spontaneously hypertensive rats[J].Life Sci,2004,75(4):407
[15]Edwards J,Bartlett JM.The androgen receptor and signaltransduction pathways in hormone-refractory prostate cancer.Part 1:modifications to the androgen receptor[J].BJU Int,2005,95(9):1320
