利福平与高温对Cardinium 的灭活效果及其对烟粉虱寄主发育与繁殖的影响
2015-12-03任素丽尹祥杰任顺祥邱宝利
任素丽,尹祥杰,郭 秋,任顺祥,邱宝利
(华南农业大学昆虫学系,生物防治教育部工程研究中心,广州 510640)
自然界中,昆虫与细菌共生是一种普遍存在的现象,已知目前大约有40%以上的昆虫体内含有内共生菌(Zug and Hammerstein,2012)。在昆虫体内,共生菌可以向其寄主提供食物中缺乏的营养物质,调控昆虫寄主的生殖方式,对寄主的种群进化等起着重要作用(Camargo and Freymuller,1977;Stouthamer et al.,1999;Russell and Moran,2006)。
烟粉虱Bemisia tabaci 是属于半翅目Hemiptera粉虱科Aleyrodidae 的一类以刺吸式口器取食植物汁液的小型昆虫。其若虫和成虫均能为害植物,通过其针状的刺吸式口器刺入植物组织,吸食植物汁液,影响植物生长。同时,烟粉虱在植物叶片上分泌大量蜜露,很易滋生黑色煤污病菌导致煤污病发生。该病不但影响植物的光合作用(De Barro,1995;Oliveira et al.,2001)而影响植物生长或果实产量,还会污染植物和果实、降低其外观和品质。更为重要的是,烟粉虱还是许多植物病毒的重要传播媒介,传毒种类多达110 余种(Jones,2003)。烟粉虱在世界各地广泛传播与蔓延,每年造成的经济损失达到数十亿美元,其危害早已成为全球性的严重问题(White,1998;Qiu et al.,2007)。
烟粉虱之所以能够在世界各地暴发成灾,与其寄主范围广,繁殖能力、适应能力及抗药、抗逆能力强等有着密切的关系,而归根结底是与其体内存在的共生菌的多样性密切相关(Morin et al.,1999;Ghanim and Kontsedalov 2009;Gottlieb et al.,2010)。迄今为止,烟粉虱体内已经报到的共生菌种类主要有 7种,即原生共生菌 Portiera aleyrodidarum 和次生共生菌 Wolbachia、Arsenophonus、Hamiltonella、Rickettsia、Cardinium 等(Chiel et al.,2007;Gueguen et al.,2010;Skaljac et al.,2010;Xue et al.,2012)。目前,对烟粉虱内共生菌的研究主要集中在Wolbachia、Rickettsia和Hamiltonella 等(Morin et al.,1999;Mahadav et al.,2008;Ghanim and Kontsedalov 2009;Gottlieb et al.,2010;Xue et al.,2012),而对于共生菌烟粉虱体内另一种重要共生菌Cardinium 却少有研究。目前已有研究证明Cardinium 可以改变寄生蜂寄主的生殖方式及生殖力(Zchori-Fein et al.,2004)。然而,目前国内外对Cardinium 在烟粉虱生长发育、生殖调控、寄主植物适应性等方面的研究尚未有报道。
本文以烟粉虱为实验材料,在检测不同生物型烟粉虱体内Cardinium 侵染情况的基础上,研究了抗生素(利福平)及高温处理对Cardinium 活性的影响,以及Cardinium 灭活前后烟粉虱在生长、发育及繁殖方面的变化,以期更好地了解烟粉虱与Cardinium 之间的共生关系,为如何利用共生菌开展烟粉虱害虫的有效防控等提供新的思路。
1 材料与方法
1.1 试验材料
1.1.1 供试植物与虫源
供试植物棉花Gossypium hirsutum 为本实验室繁育的健康植株,品种为鲁棉研32 号,购自山东省潍坊市种子管理站;供试昆虫为烟粉虱的三种生物型,即B、Q 及Cv 生物型种群(近年来三种生物型分别被提升为MEAM1、Mediterranean 和AsiaII7 隐种,但相关结论尚存在一定争议,为描述方便,本文仍然使用生物型的概念),其中B 型烟粉虱2011年采集于华南农业大学教学实习农场,寄主为茄子 Solanum melongena;Q 型烟粉虱2013年采集于江苏省扬州市,寄主为辣椒Capsicum annuum;Cv 型烟粉虱2013年采集于广州市长湴公园,寄主为变叶木Codiaeum variegatum;三种生物型烟粉虱均继代保存于生物防治教育部工程研究中心(广州,华南农业大学)的棉花寄主上,环境条件为26℃±1℃,RH 65%-75%,光周期16L∶8D。
1.1.2 主要试剂
PCR 检测试剂,包括蛋白酶K、Ex-Taq 聚合酶、25 mmol/L MgCl2、10×PCR buffer、dNTPs(10 mmol/L)、100 bp 分子量标记和PCR 产物纯化试剂盒QIAquick Gel Extraction Kit 等购自大连宝生物工程公司;利福平等化学试剂购自广州威佳科技有限公司。
1.2 总DNA 的提取
挑取单头B 型、Q 型和Cv 型烟粉虱成虫,经双蒸水充分洗涤后置于0.5 mL 离心管中,每管加入3 μL 提取裂解液(1% SDS,1% Triton X-100,1 mM MgCl2;10 mM Tris-Cl pH7.4),充分研磨匀浆,并补足裂解液至30 μL,然后放入56℃恒温水浴锅中裂解2-3 h,最后95℃恒温水浴锅中10 min灭活蛋白酶K,置于-20℃冰箱中保存备用。
1.3 次生共生菌Cardinium 与原生共生菌Portiera的PCR 检测
PCR 反应体系为25 μL,包括0.15 μmol/L 的引物,200 μmol/L dNTPs,1×PCR buffer,50-100 ng 的DNA 模板,1.5U Taq 酶。PCR 反应在Eppendorf-PCR 热循环仪中进行。Cardinium 16S rDNA 扩增引物为:F-primer 5'-GCGGTGTA AAATGAGCGTG-3',R-primer5'-ACCTMTTC TTAACTCAA GCCT-3'。原生共生菌16S rDNA 扩增引物为:F-primer 5'-TGCAAGTCGAGCGGC ATCAT-3',R-primer 5'-AAAGTTCCCGCC TTATGCGT-3'。PCR 反应程序为:94℃预变性3 min,然后94℃1 min,58℃45 s,72℃1 min,执行35个循环,最后72℃10 min。
PCR 完成后,取5 μL PCR 扩增产物在1.0%(g/mL)琼脂糖凝胶上电泳检测(电压120 V,电泳缓冲液为0.5×TBE),PCR 电泳检测阴性对照为蒸馏水,阳性对照为原生共生菌Portiera 的PCR产物。电泳结果在凝胶成像系统下观察并拍照记录结果。在确定目标DNA 条带存在后,利用PCR产物纯化试剂盒QIAquick Gel Extraction Kit 回收PCR 产物,并送至深圳华大基因科技服务有限公司测序,以确定所获得的PCR 产物为Cardinium共生菌的16S rDNA。每次PCR 检测10 头B、Q 和Cv 型烟粉虱成虫,实验重复3 次。
1.4 利福平处理对Cardinium 的灭活效果
参考Xue et al.(2012)的方法,将利福平配成了0.5,1.0,2.0 mg/mL 三种浓度的20%蔗糖溶液。选取羽化后2-4 d 的Q 型烟粉虱成虫约100 头,对其饲喂三种不同浓度的利福平蔗糖溶液,对照组饲喂不加抗生素的20%的蔗糖溶液。随后每天随机选取10 头烟粉虱成虫,通过PCR 方法逐头检测处理组与对照组烟粉虱成虫体内Cardinium 的灭活情况。每次试验连续检测7 d,不同抗生素处理重复4 次。试验条件为26℃±1℃,RH 75%-85%,光照16L∶8D。
1.5 高温处理对Cardinium 的灭活效果
在健康的棉花植株上,用叶片笼(高1.5 cm直径3 cm)接种Q 型烟粉虱成虫20 对并让其产卵24 h,待F1 代羽化2-3 d 后,随机挑选20 头雌烟粉虱成虫分别置于(36、38、40)±1℃,RH 75%-85%,光照16L∶8D 的人工气候箱内,处理时间分别为3 d、6 d 和9 d,对照组中烟粉虱一直处于26℃±1℃的条件下,其饲喂条件与处理组相同。处理完毕后,每个温度梯度中随机挑选10 头烟粉虱成虫,利用PCR 方法逐头检测处理组与对照组烟粉虱成虫体内Cardinium 的灭活情况,试验重复3 次。
1.6 Cardinium 共生菌对烟粉虱发育与繁殖的影响
1.6.1 Cardinium 阳性与阴性烟粉虱种群的建立
随机挑取羽化后2-3 d 的Q 型烟粉虱成虫10 对,利用叶片笼分别接种于健康干净的棉花植株上(1 对/叶片),编号,待其产卵24 h 后将烟粉虱成虫移除,选留20 粒卵继续发育(F1 代)。待F1 代发育成3-4 龄若虫时,随机选取6-8 头若虫并利用PCR 技术逐头检测其体内Cardinium共生菌的感染情况,当被检测的若虫全部为Cardinium 阳性时,该叶片上其它剩余的烟粉虱若虫也被视为Cardinium 阳性个体。为了尽量减少遗传特性的差异程度,待所有Cardinium 阳性个体发育到成虫时,将其混合并重新挑选10 对成虫,接种到健康干净的棉花植株上,让其繁殖F2 代,并检测F2 代个体Cardinium 的感染率,依次直至繁殖到F5 代,所获得种群被视为具有稳定感染率的Cardinium 阳性种群,
烟粉虱Cardinium 阴性种群的建立与阳性种群相似,不同之处是随机挑选的Q 型烟粉虱成虫是来自于1.0 mg/mL 利福平处理5 d 后的种群。逐代检测F1-F5 烟粉虱若虫体内Cardinium 的感染率,并选取全部为阴性种群的个体混合繁殖下一代,直至F5 代,所获得种群被视为稳定的Cardinium阴性种群。
1.6.2 烟粉虱Cardinium 阳性与阴性种群的生物学特性比较
待棉花长至6-8 片真叶时,选取20 株健康干净的棉花苗(Cardinium 阳性与阴性种群试验各10株),每株选取一片大而伸展的叶片并分别进行标记。利用叶片笼分别接种Cardinium 阳性与阴性粉虱成虫,25 对/叶,待烟粉虱产卵24 h 后,将成虫赶走,每个叶片随机选留100 粒卵让其继续繁育。此后,逐日调查不同处理中烟粉虱卵及若虫的发育、存活,成虫性比等数据;Cardinium 阳性与阴性粉虱成虫后,各随机选取10 对成虫,接种到健康干净的棉花苗上,24 h 更换一次叶片,逐日调查烟粉虱成虫的产卵量与寿命。实验重复3 次。
1.7 数据处理
利用SAS(9.0,SAS Institute)软件的PROC MEANS 程序计算三种生物型烟粉虱体内Cardinium的感染率、高温与抗生素对Q 型烟粉虱体内Cardinium 的灭活效果;利用T 检验、显著差数法比较分析烟粉虱Cardinium 阴性种群和阳性种群的发育历期、存活率、产卵量、成虫雌雄性比等生物学特性差异。
2 结果与分析
2.1 三种烟粉虱生物型体内Cardinium 与Portiera的感染率
对B、Q 和Cv 生物型烟粉虱体内Cardinium与Portiera 的16S rDNA PCR 检测结果表明,三种生物型中原生共生菌Portiera 的感染率均为100%,而对于次生共生菌Cardinium 的感染率则因生物型不同而有较大差异,B 型烟粉虱感染率最低,为26.7%±6.64%,Q 型烟粉虱的感染率最高,达到91.6%±5.38%,Cv 型烟粉虱的感染率与Q 型接近,为82.9%±4.78%(图1,F2,8=11.46,P<0.05)。
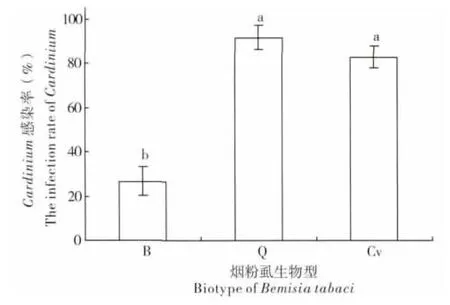
图1 三种不同生物型烟粉虱体内Cardinium 的感染率Fig.1 The infection rate of Cardinium in three biotypes of Bemisia tabaci
2.2 高温处理Q 型烟粉虱体内Cardinium 的去除效果
PCR 检测结果表明,在36、38 和40℃三个温度梯度分别处理3 d、6 d 和9 d 后,Q 烟粉虱体内的Cardinium 共生菌的检出率均在90%以上,且与26℃±1℃的对照组Cardinium 的检出率无显著差异(图2,3 d 处理组F3,11=1.52,P=0.676;6 d处理组F3,11=1.33,P=0.619;9 d 处理组F3,11=1.87,P=0.563),表明36℃-40℃的高温对烟粉虱体内Cardinium 共生菌无有明显的灭活作用。
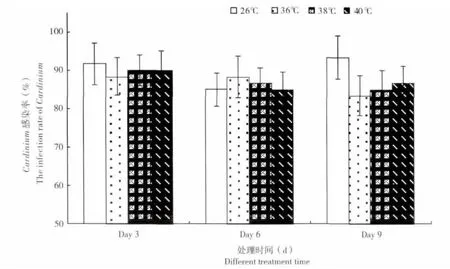
图2 不同高温和处理时间去除Q 型烟粉虱体内Cardinium 的情况Fig.2 Inactive efficiencies of the different high temperature and different treatment time to Cardinium in Bemisia tabaci biotype Q
2.3 利福平处理Q 型烟粉虱体内Cardinium 的去除效果
利用0.5,1.0,2.0 mg/mL 三种浓度的利福平-蔗糖溶液,饲喂Q 型烟粉虱雌成虫,此后连续7 d对烟粉虱体内Cardinium 共生菌的检测结果见图3。与饲喂20%蔗糖溶液的对照组相比,取食了含有0.5,1.0,2.0 mg/mL 利福平的蔗糖溶液后,烟粉虱体内Cardinium 的检出率随着饲喂时间的延长而逐渐降低,并且利福平溶液浓度越大,其处理组Cardinium 的检出率下降越明显,说明对Cardinium 的灭活效果越好。在0.5 mg/mL 利福平处理组,Cardinium 的感染率从第1 天的95%降到了第7 天的50%,而在1.0 mg/mL 利福平处理组,Cardinium 的感染率从第1 天的92.5% 降到了第7 天的2.5%;然而,实验结果表明,当利福平浓度增加至2.0 mg/mL 时,在饲喂5 d 后烟粉虱体内的Cardinium 已呈阴性。另一方面,随着利福平饲喂浓度的增加,烟粉虱成虫的存活率下降明显,在2.0 mg/mL 处理组,第4 天时烟粉虱的存活率仅为11.5%,第 5 天几乎全部死亡,而在1.0 mg/mL处理组,烟粉虱第4-7 天的存活率在31.3%-68.7%之间(数据未全部列出),因此,综合Cardinium 灭活效果及对烟粉虱存活率影响两方面的考虑,使用1.0 mg/mL 的利福平浓度对烟粉虱体内的Cardinium 进行灭活比较适宜。
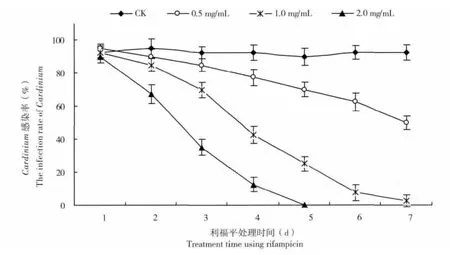
图3 不同浓度利福平溶液饲喂灭活Q 型烟粉虱内共生菌Cardinium 的效果Fig.3 Inactive efficiencies of the different rifampicin concentration to Cardinium in Bemisia tabaci biotype Q
2.4 烟粉虱Cardinium 阴性种群和阳性种群的生物学特性比较
研究结果发现,Cardinium 阳性与阴性烟粉虱种群在发育、存活及繁殖等方面存在一定的差异。在26℃±1℃的条件下,与Cardinium 阳性的Q 型烟粉虱种群相比,阴性的Q 型烟粉虱卵期、若虫期及伪蛹期的发育历期均有所延长,整个世代的发育历期与Cardinium 阳性烟粉虱种群延迟了3.1 d,差异达到显著水平(图4,T=10.42,P=0.032)。同时,与Cardinium 阳性的Q 型烟粉虱相比,Cardinium 阴性的Q 型烟粉虱不同阶段的存活率均有所下降,且卵期的存活率、卵-成虫的存活率与Cardinium 阳性烟粉虱种群差异达到显著水平(图5,T=8.72,P=0.018)。此外,调查结果表明,阳性种群后代中的雌雄性比(♀∶♂)约为1.12∶1,而阴性种群后代的雌雄性比(♀∶♂)约为0.94∶1,说明Cardinium 共生菌对Q 型烟粉虱种群后代的性比也有一定的影响,感染Cardinium 在一定程度上增加了后代的雌性比例。
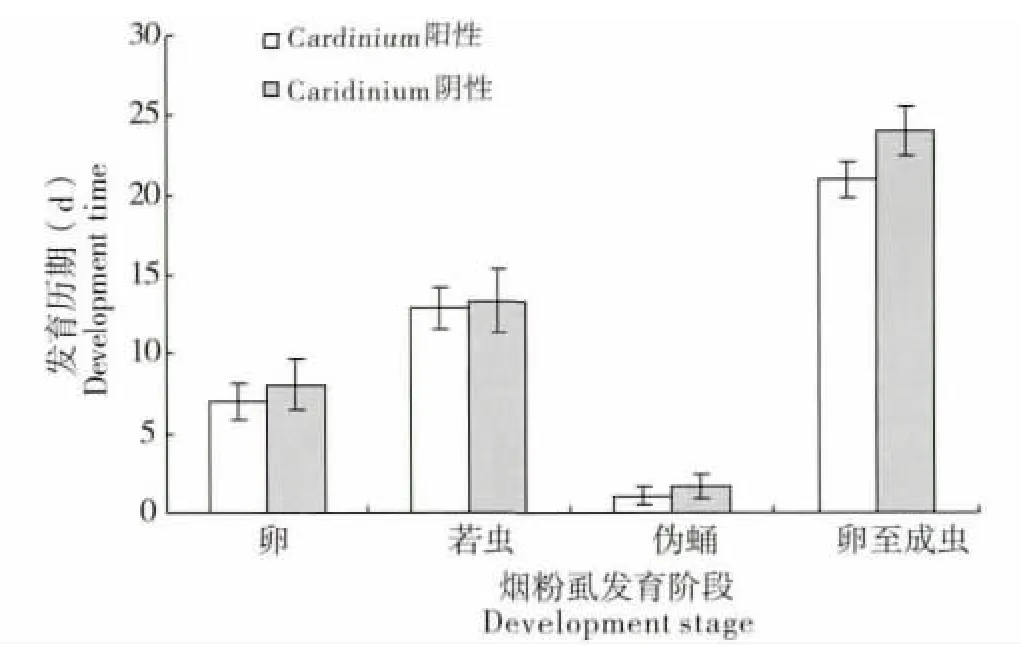
图4 Cardinium 阳性与阴性Q 型烟粉虱的发育历期比较Fig.4 The development time of Cardinium positive and negative Bemisia tabaci biotype Q
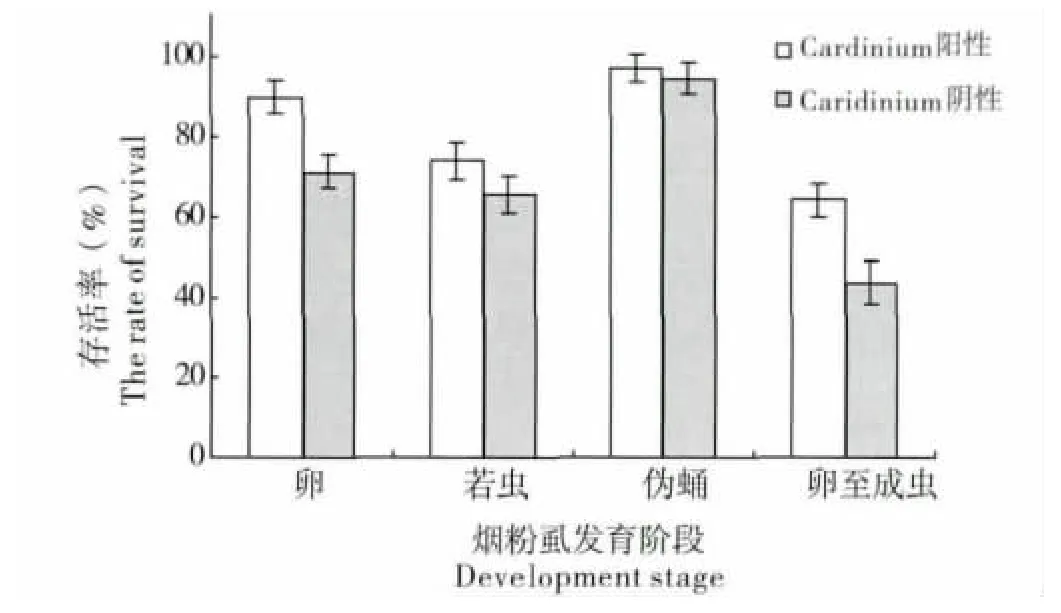
图5 Cardinium 阳性与阴性Q 型烟粉虱的世代存活率比较Fig.5 The rate of survival of Cardinium positive and negative Bemisia tabaci biotype Q
调查发现,羽化后第3-8 天是Cardinium 阳性与阴性Q 型烟粉虱种群的产卵高峰期,此后产卵量逐日下降。羽化后前15 d 的产卵量统计结果显示,阳性与阴性种群的单雌产卵量分别为128.3 粒/头和107.0 粒/头,逐日产卵量虽有差异但差异并不显著(图6)。
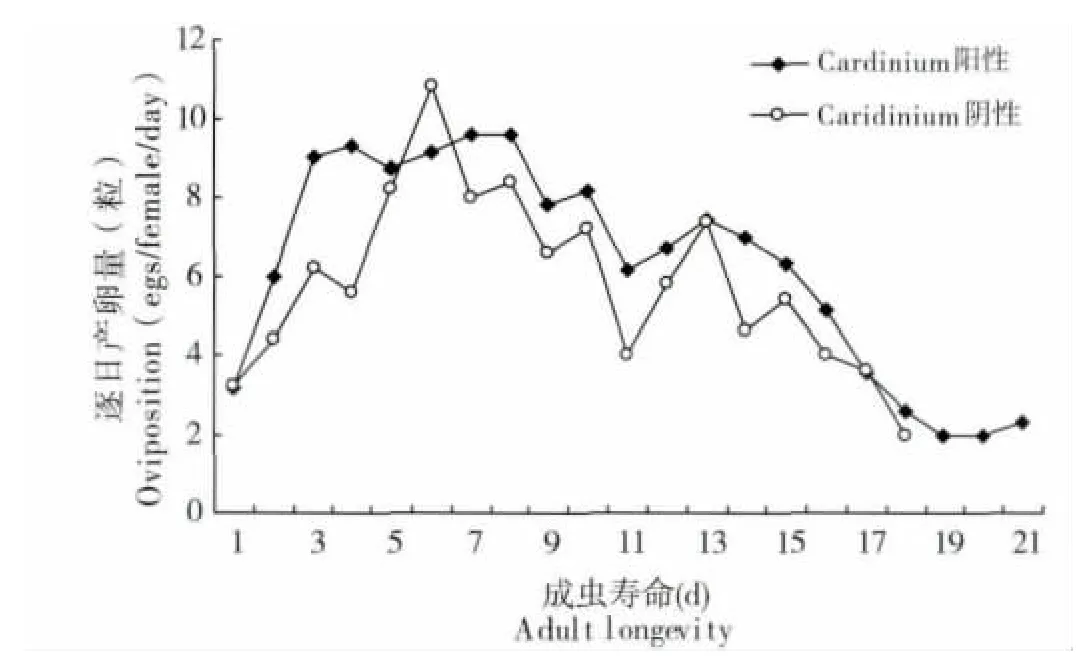
图6 Q 型烟粉虱Cardinium 的阴性种群和阳性种群在棉花上逐日产卵量Fig.6 The age-specific oviposition of Cardinium positive and negative Bemisia tabaci biotype Q on cotton
3 结论与讨论
众所周知,烟粉虱是世界性分布的重大农业害虫,目前烟粉虱体内的多种原生和次生共生菌种类已被发现报道,其生物学与生态学功能及作用机制也成为人们研究的热点问题。就国内广泛分布的B 与Q 烟粉虱而言,Chu et al.(2011)发现山东省内的B 型与Q 型烟粉虱体内,Cardinium的感染率分别为4.8%和12.2%;潘慧鹏(2012)对全国17个B 型和44个Q 型烟粉虱种群体内的进行了检测,发现其中2个B 型种群(北京与天津)、21个Q 型种群中都感染有Cardinium 共生菌,其中采集自北京海淀地区的B 型雌性烟粉虱体内Cardinium 共生菌的感染率为100%,雄性个体的感染率为66.7%,Q 型烟粉虱中也以北京种群最高,约为83.3%;而在浙江,Bing et al.(2013)对国内6个烟粉虱隐种的340个烟粉虱个体进行共生菌检测,其结果发现入侵型的B、Q 烟粉虱中未有Cardinium 的感染;在本研究中B 型与Q 型烟粉虱Cardinium 的分别为26.7%与91.6%。以上研究表明,不同烟粉虱生物型、同一生物型不同地理种群甚至是相同生物型和地理种群在不同时间段,烟粉虱体内的共生菌类型都可能存在较大的差异(Chiel et al.,2007;Ahmed et al.,2010;Chu et al.,2011;潘慧鹏,2011;Bing et al.,2013)。
昆虫内共生菌对温度很敏感,所以高温处理是一种灭活昆虫体内共生菌的方法(O,Neill and Karr,1990)。已有研究表明,30℃以上的高温就可以消除寄主体内的内共生菌Wolbachia,但效率不如利福平等抗生素,同时也不排除有一些内生菌是耐高温的(Werren,1997;van Opijnen and Breeuwer,1999;Kyei-Poku et al.,2003;Yusuf and Turner,2004)。在本研究中,利用36-40℃的高温处理3-9 d 时间,仍未能将Q 型烟粉虱体内的Cardinium 的灭活,说明本实验中设计的高温及处理时间对Cardinium 活性的影响很小,推测烟粉虱体内Cardinium 可能具有耐高温的特性。Gotoh et al.(2007)利用35℃和40℃高温,对红蜘蛛Tetranychus cinnbarinus 处理3 d 和7 d,也未能将红蜘蛛体内中的Cardinium 去除,但却灭活了红蜘蛛体内的次生共生菌 Wolbachia,间接证明了Cardinium 比Wolbachia 耐高温。至于高温是否能够灭活或去除烟粉虱体内的Cardinium,其要求的温度与处理时间如何,有待于进一步展开相关研究。
在昆虫共生菌领域的研究中,往往通过两种方式获得某种共生菌为阴性的昆虫种群,一种是阴性个体筛选与继代繁殖法(本研究即采用此种方法),第二种是共生菌灭活法。本研究对利用利福平灭活烟粉虱体内Cardinium 的条件进行了比较,结果发现不同浓度的利福平处理Q 烟粉虱,不仅对Cardinium 的灭活效果不同,而且对烟粉虱本身也存在不同的影响。利用0.5 mg/mL 的利福平溶液饲喂Q 型烟粉虱,虽然对烟粉虱生命力的影响较小,但7 d 内无法将Cardinium 完全灭活或去除;利用2.0 mg/mL 的利福平浓度处理Q 型烟粉虱,虽然对Cardinium 的灭活效果较好,但烟粉虱存活率很低,死亡率高,说明此浓度的利福平溶液对烟粉虱生命力的负面影响较大,不利于后期的科学研究。因此,本文的研究结果认为,利用1.0 mg/mL 的利福平溶液饲喂Q 型烟粉虱,在7-8 d 可以将Q 型烟粉虱体内的Cardinium 灭活,进而有机会获得Cardinium 的阴性种群。Xue et al.(2012)也推荐利用1.0 mg/mL 的利福平溶液灭活双斑蚜小蜂体内的Wolbachia,推测两种内共生菌或者烟粉虱-Cardinium 与蚜小蜂-Wolbachia 两个研究体系对在对利福平的耐受性方面差别不大。
细胞质遗传的内共生菌,如Wolbachia 等,可以通过提高寄主昆虫(节肢动物)的适合度和种群数量增加自己种群传播的机会(Douglas,1994;Xue et al.,2012)。共生菌Cardinium 与Wolbachia有很多相似之处,二者都是通过细胞质遗传,且都能通过诱导胞质不亲和、孤雌生殖和雌性化调控宿主的生殖方式。在本研究中,Cardinium 阴性的Q 型烟粉虱与阳性种群相比,发育延迟,存活率降低,雄性比例增加,这与Xue et al.(2012)灭活双斑蚜小蜂体内的Wolbachia 共生菌后,蚜小蜂表现出的生物学变化相似,表明Cardinium 的感染是有利于Q 型烟粉虱的生长发育与存活的,也同样说明细胞质遗传的内生菌Cardinium 能提高其昆虫寄主的适合度。
概括而言,烟粉虱之所以具有分布与寄主范围广、抗药性与适应能力强,繁殖力大等特点,与其体内含有多种内共生菌密不可分。研究Cardinium 感染与否及其生物学特性的变化,有助于更全面地了解烟粉虱暴发危害的生态学机制。此外,Cardinium 共生菌的寄主广泛,研究其对烟粉虱寄主的生物学影响,对今后开展蚜虫、害螨、飞虱等其它刺吸式害虫的暴发危害也有重要的参考价值。
References)
Ahmed MZ,Ren SX,Xue X,et al.Prevalence of endosymbionts in Bemisia tabaci populations and their in vivo sensitivity to antibiotics[J].Current Microbiology,2010,61:322-328.
Bing XL,Ruan YM,Rao Q,et al.Diversity of secondary endosymbionts among different putative species of the whitefly Bemisia tabaci[J].Insect Science,2013,20(2):194-206.
Camargo EP,Freymuller E.Endosymbiont as supplier of ornithine carbamoyl transferase in a trypanosomatid[J].Nature,1977,270(5632):52-53.
Chiel E,Gottlieb Y,Zchori-Fein E,et al.Biotype-dependent secondary symbiont communities in sympatric populations of Bemisia tabaci[J].Bulletin of Entomological Research,2007,97:407-413.
Chu D,Gao CS,De Barro P,et al.Further insights into the strange role of bacterial endosymbionts in whitefly,Bemisia tabaci:comparison of secondary symbionts from biotypes B and Q in China[J].Bulletin of Entomological Research,2011,101(04):477-486.
De Barro PJ.Bemisia tabaci biotype B:a review of its biology,distribution and control[J].CSIRO Australia Division of Entomology Technical Paper,1995,33:57.
Douglas AE.Symbiotic Interactions[M].New York:Oxford University Press,1994.
Ghanim M,Kontsedalov S.Susceptibility to insecticides in the Q biotype of Bemisia tabaci is correlated with bacterial symbiont densities[J].Pest Management Science,2009,65(9):939-942.
Gotoh T,Noda H,Ito S.Cardinium symbionts cause cytoplasmic incompatibility in spider mites[J].Heredity,2007,98:13-20.
Gottlieb Y,Zchori-Fein E,Mozes-Daube N,et al.The transmission efficiency of tomato yellow leaf curl virus is correlated with the presence of a specific symbiotic bacterium species[J].Journal of Virology,2010,84:9310-9317.
Gueguen G,Vavre F,Gnankine O,et al.Endosymbiont metacommunities,mtDNA diversity,and the evolution of the Bemisia tabaci(Hemiptera:Aleyrodidae)complex[J].Molecular Ecology,2010,19:4365-4378.
Jones DR.Plant viruses transmitted by whiteflies[J].European Journal of Plant Pathology,2003,109,195-219.
Kyei-Poku GK,Floate KD,Benkel B,et al.Elimination of Wolbachia from Urolepis rufipes(Hymenoptera:Pteromalidae)with heat and antibiotic treatments:implications for host reproduction[J].Biocontrol Science and Technology,2003,13(3):341-354.
Mahadav A,Gerling D,Gottlieb Y,et al.Parasitization by the wasp Eretmocerus mundus induces transcription of genes related to immune response and symbiotic bacteria proliferation in the whitefly Bemisia tabaci[J].BMC Genomics,2008,9:342.
Morin S,Ghanim M,Zeidan M,et al.A GroEL homologue from endosymbiotic bacteria of the whitefly Bemisia tabaci is implicated in the circulative transmission of tomato yellow leaf curl virus[J].Virology,1999,30:75-84.
O'Neill SL,Karr TL.Bidirectional incompatibility between conspecific populations of Drosophila simulans[J].Nature,1990,348:178-180.
Oliveira MRV,Henneberry TJ,Anderson P.History,current status,and collaborative research projects for Bemisia tabaci[J].Crop Protection,2001,20(9):709-723.
Pan HP.Studies on the Ecological Mechanism of Displacement of Bemisia tabaci B biotype by Q biotype[D].Beijing:China Agricultural Science Press,2012.[潘慧鹏.烟粉虱Q 型替代B型的生态学机制研究[D].北京:中国农业科学院出版,2012]
Qiu BL,Coats SA,Ren SX,et al.Phylogenetic relationships of native and introduced Bemisia tabaci(Homoptera:Aleyrodidae)from China and India based on mtCOI DNA sequencing and host plant comparisons[J].Progress in Natural Science,2007,17(6):645-654.
Russell JA,Moran NA.Costs and benefits of symbiont infection in aphids:variation among symbionts and across temperatures[J].Proceedings of the Royal Society of London(Series B):Biological Sciences,2006,273:603-610.
Skaljac M,Zanic K,Ban SG,et al.Co-infection and localization of secondary symbionts in two whitefly species[J].BMC Microbiology,2010,10:142.
Stouthamer R,Breeuwer JAJ,Hurst GDD.Wolbachia pipientis:microbial manipulator of arthropod reproduction[J].Annual Review of Microbiology,1999,53:71-102.
van Opijnen T,Breeuwer JAJ.High temperatures eliminate Wolbachia,a cytoplasmic incompatibility inducing endosymbiont,from the two-spotted spider mite[J].Experimental and Applied Acarology,1999,23:871-881.
Werren JH.Biology of Wolbachia[J].Annual Review of Entomology,1997,42:587-609.
White J.Silverleaf whitefly extends range[J].California Agriculture,1998,52:6-7.
Xue X,Li SJ,Ahmed MZ,et al.Inactivation of Wolbachia reveals its biological roles in whitefly host[J].PLoS One,2012,7(10):e48148.
Zchori-Fein E,Perlman SJ.Characterization of a‘Bacteroidetes’symbiont in Encarsia wasps(Hymenoptera:Aphelinidae):proposal of‘Candidatus Cardinium hertigii’[J].International Journal of Systematic and Evolutionary Microbiology,2004,54:961-968.
Zug R,Hammerstein P.Still ahost of hosts for Wolbachia:analysis of recent data suggests that 40% of terrestrial arthropod species are infected[J].PLoS One,2012,7(6):e38544.
