胰腺癌术后发生肝转移的危险因素分析
2015-12-02李绥邦支永发
李绥邦,支永发
(青海红十字医院,西宁810000)
胰腺癌是临床常见的恶性肿瘤,外科手术是其主要治疗手段[1,2],但术后易复发和转移,已成为患者术后死亡的主要原因[3]。现对106例行胰腺癌根治术患者的临床资料进行分析,探讨术后发生肝转移的危险因素。
1 临床资料
1.1 基本资料 研究对象为106例于2010年6月~2014年6月在青海红十字医院行胰腺癌根治术患者。纳入标准:①组织病理学检查明确诊断;②具有胰腺癌根治术指征,且均为R0切除;③术前不合并肝转移,且无其他重大器官损伤;④临床资料齐全。排除:①围术期死亡者、自动放弃治疗者,以及行姑息治疗者;②术前发生肝转移者;③合并其他重要器官损伤及精神疾病者;④临床资料不全者。106例患者中,男71例、女35例,年龄29~79(59.23±8.21)岁,BMI 21~30(23.5 ±1.8)kg/m2;血型:A型30例,B型29例,AB型6例,O型41例;首发症状伴随腹痛者69例。术前血红蛋白>120 g/L 85例,≤120 g/L 21例;术前总胆红素>150 μmol/L 30例,≤150 μmol/L 76例;术前白蛋白 >35 g/L 69例,≤35 g/L 37例;术前CA19-9>500 U/mL 15例,≤500 U/mL 91例;术前肝功能分级:A级62例,B级44例;术前合并症:糖尿病28例,高血压24例,乙肝15例,脂肪肝19例;肿瘤直径>4 cm者36例,≤4 cm者70例;肿瘤部位:胰头65例,胰尾36例,全胰癌5例;病理类型:导管腺癌90例,非导管腺癌16例;有脉管癌栓13例,无脉管癌栓93例;TNM分期:Ⅰ期13例,Ⅱ期86例,Ⅲ期7例;组织分化程度:高分化9例,中分化51例,低分化46例;术式:胰十二指肠切除术61例,胰体切除术34例,全胰切除术11例;手术时间>300 min 68例,≤300 min 38例;术中出血量>500 mL 51例,≤500 mL 55例;术后行化疗70例,未行化疗36例。术后随访至2015年6 月,随访时间12~60(21.78 ±9.27)个月,术后发生肝转移41例。
1.2 术后肝转移危险因素分析 根据患者术后随访期间是否发生肝转移分为肝转移组41例、无肝转移组65例。收集两组临床资料,并进行单因素及多因素Logistic回归分析,确定胰腺癌术后发生肝转移的危险因素。
单因素分析显示,年龄、BMI、术前肝功能分级、合并脂肪肝、脉管癌栓、癌组织分化程度、术后化疗与胰腺癌术后发生肝转移有关(P均<0.05)。见表1。
将单因素分析中有统计学意义的指标纳入多因素Logistic回归分析,结果显示,年龄<60岁(OR=1.142,95%CI:1.123~1.798)、BMI≥23 kg/m2(OR=3.012,95%CI:1.301~6.973)、术前肝功能分级 B 级(OR=3.150,95%CI:1.702~5.829)、有脉管癌栓(OR=4.212,95%CI:1.531~11.588)、组织分化程度为低分化(OR=3.012,95%CI:1.301~6.973)、未合并脂肪肝(OR=0.539,95%CI:0.354~0.821)、术后未化疗(OR=1.957,95%CI:1.331~2.877)为胰腺癌术后发生肝转移的危险因素(P 均 <0.05)。
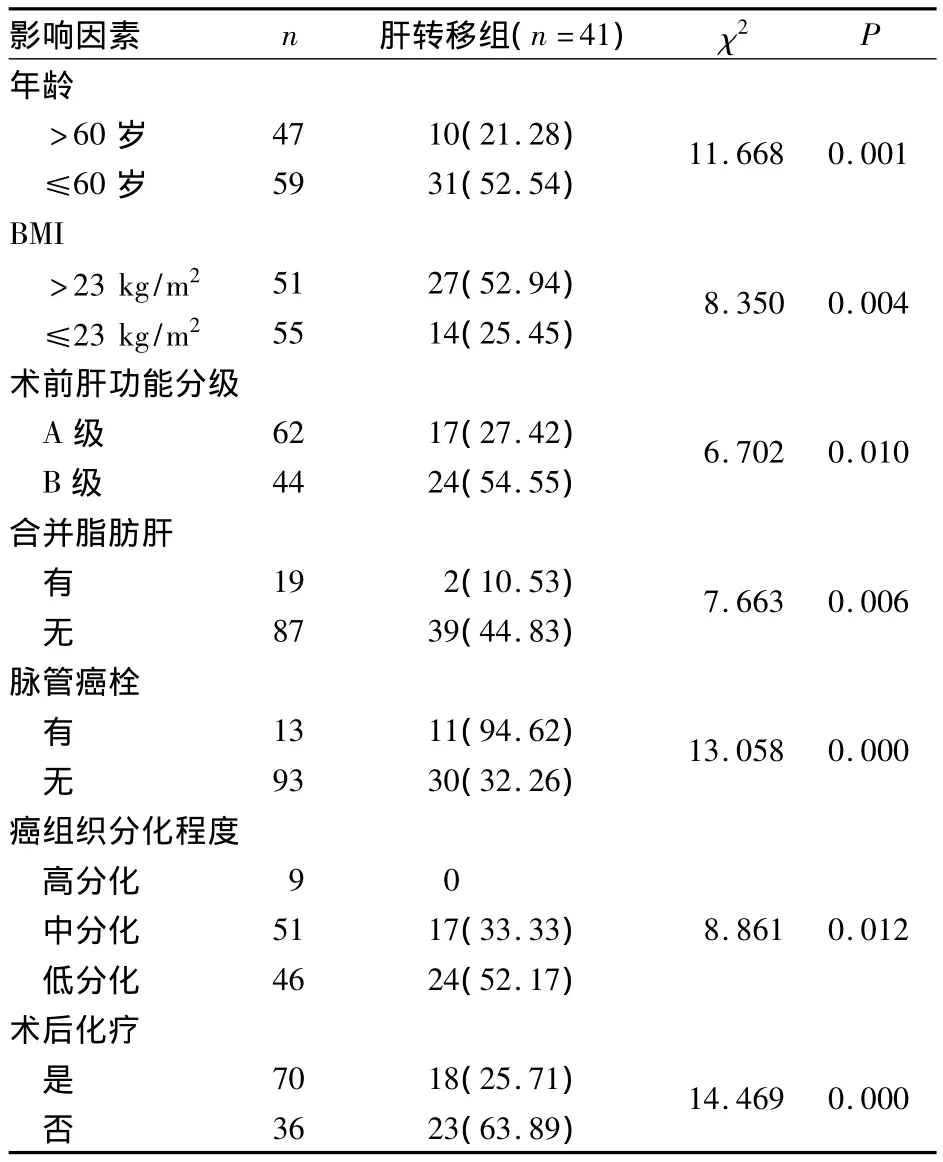
表1 胰腺癌术后发生肝转移的单因素分析[例(%)]
2 讨论
肝脏是机体维持代谢平衡的重要器官,在体内具有去氧化解毒、储存肝糖元、合成分泌性蛋白质等重要作用。据统计,胰腺癌术后发生肝转移的比例达35%以上(本组为38.68%),术后发生肝转移者预后差[4,5]。因此,早期筛选胰腺癌术后发生肝转移的危险因素具有重要意义。
有研究报道,合并乙肝是胰腺癌发生肝转移的危险因素[3];BMI、组织学分级、合并脉管癌栓亦为发生肝转移的危险因素[1]。本研究单因素及多因素Logistic回归分析显示,年龄、BMI、术前肝功能分级、未合并脂肪肝、脉管癌栓、组织分化程度、术后化疗是胰腺癌术后发生肝转移的危险因素。年龄<60岁者肝转移发生率高的原因可能与本研究观察例数较少有关;BMI>23 kg/m2、术前肝功能分级B级者术后肝转移发生率高的原因尚不明确,与国内一些研究[6~10]结果并不一致,可能与患者自身免疫能力低有关。未合并脂肪肝者肝转移发生率高的原因为脂肪肝对血管形成有抑制作用,可抑制转移灶的形成,且其肝组织内有大量脂肪酸沉积,而ω-3脂肪酸对肿瘤的生长具有抑制作用[11,12]。肿瘤组织分化程度为低分化者术后肝转移发生率高的原因为低分化肿瘤的细胞运动能力及浸润能力均较强,更容易侵入淋巴管与血管。
综上所述,年龄 <60岁、BMI≥23 kg/m2、术前肝功能分级B级、有脉管癌栓、组织分化程度低、未合并脂肪肝、术后未化疗为胰腺癌术后发生肝转移的危险因素。临床上应针对其危险因素进行积极干预,预防术后肝转移的发生。
[1]孟泽武,陈燕凌,韩圣华,等.胰腺癌术后肝转移的危险因素分析[J].中华肿瘤杂志,2015,37(4):312-316.
[2]金洲祥,徐晓武,吴丹,等.3TSR对裸鼠胰腺癌肝转移抑制作用的实验研究[J].中华肝胆外科杂志,2011,17(6):513-514.
[3]孟泽武,陈燕凌,朱金海,等.胰腺癌术后肝转移的治疗策略及预后分析[J].中华胰腺病杂志,2015,15(1):34-38.
[4]刘凤永,王茂强,段峰,等.胰腺癌肝转移的介入治疗[J].中国肿瘤临床,2012,39(6):331-335.
[5]马峰,王学林,吴雄志.血清肿瘤标志物和肝功能指标联合检测在胰腺癌肝转移诊断中的价值[J].山东医药,2011,51(15):36-38.
[6]李泽朝,周勇,罗诗樵.胰腺癌肝转移患者多学科综合治疗临床分析[J].肿瘤防治研究,2015,42(2):154-158.
[7] Conroy T,Desseigne F,Ychou M,et al.FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer[J].N Engl J Med,2011,364(19):1817-1825.
[8]欧阳华强,潘战宇,谢广茹.胰腺癌肝转移治疗进展[J].中国肿瘤临床,2014,41(2):138-141.
[9]王治国,石庆学,郭佳,等.CA19-9、增强MRI和PET/CT在胰腺癌诊断及分期中的价值[J].标记免疫分析与临床,2014,21(5):507-510,519.
[10]吴会国.胰腺癌肝转移局部化疗相关研究[J].山东医药,2012,52(32):72-74.
[11]Kindler HL,Richards DA,Garbo LE,et al.A randomized,placebo-controlled phase 2 study of ganitumab(AMG 479)or conatumumab(AMG 655)in combination with gemcitabine in patients with metastatic pancreatic cancer[J].Ann Oncol,2012,23(11):2834-2842.
[12]胡方方,周家华.胰腺癌肝转移相关分泌蛋白质的筛选[J].东南大学学报(医学版),2010,29(4):367-372.
