肌纤生成调节因子-1促肌节F-actin组装引起新生乳大鼠心肌细胞肥大
2015-11-30王晓礽刘秀华
王晓礽,刘秀华,王 松,栾 康
肌纤生成调节因子-1促肌节F-actin组装引起新生乳大鼠心肌细胞肥大
王晓礽,刘秀华,王 松,栾 康
目的 探索肌纤生成调节因子-1(myofibrillogenesis regulator-1,MR-1)通过调节肌原纤维生成引起心肌肥大的机制。方法 干预MR-1在体外培养的新生乳大鼠心肌细胞中的表达,检测心肌细胞表面积、心房利钠因子和脑钠肽水平及蛋白合成速率3种心肌肥大指标的变化,以鬼笔环肽-异硫氰酸荧光素标志并观察肌节F-actin组装,以半定量反转录-聚合酶链反应、免疫印迹和细胞免疫荧光术检测重要肌节分子myomesin-1、肌球蛋白调节轻链-2(myosin light chain-2,MLC-2)含量及亚细胞定位。结果 MR-1过表达引起心肌细胞肥大、肌节F-actin组装明显促进、MLC-2与myomesin-1表达上调(P<0.05)以及myomesin-1的细胞核-细胞质转位;MR-1沉默后小泛素样调节因子-1过表达引起的转位和肌节F-actin组装明显抑制。结论 MR-1通过促进myomesin-1和MLC-2调节肌原纤维生成引起心肌细胞肥大。
肌纤生成调节因子-1;心肌细胞肥大;F-actin;Myomesin-1;肌球蛋白调节轻链-2
心肌肥大是缺血、机械牵张、激素和细胞因子等因素引起的心肌适应性反应,表现为心肌细胞体积增大、质量增加和间质细胞增生,涉及一系列复杂的信号转导机制[1]。其中占心肌组织90%以上的心肌细胞肥大是心肌肥大的关键因素。作为兴奋收缩偶联的重要环节,心肌肌原纤维直接决定着心肌细胞肥大过程中的结构和功能重塑,在调节肥大过程中代偿性心肌收缩功能发挥了重要作用。研究发现,肌节蛋白高度有序和准确的组装是肌肉细胞正常结构和功能维持的关键环节[2-3],肌节组装过程的准确性对心肌细胞功能有重要的影响[4],因而了解心肌细胞肥大过程中的肌节组装,特别是明确重要肌节分子的调节,对于阐明心肌肥大的机制有重要的理论推动意义。
人肌纤生成调节因子-1(myofibrillogenesis regulator-1,MR-1,收录号 AF417001)[5]定位于染色体2q35[6-7],mRNA全长755 bp,编码一段142个氨基酸组成的蛋白质,在横纹肌组织、肝脏和肾脏组织等高表达[2]。Liu等[6]研究发现MR-1在腹主动脉缩窄术诱导高血压致心肌肥大大鼠的心脏组织和血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导的心肌细胞肥大模型中表达显著升高,而RNA干扰(RNA interference,RNAi)致MR-1表达抑制可消除AngⅡ诱导的心肌细胞肥大,提示MR-1与心肌肥大关系密切;Li等[5]通过酵母双杂交和GST-pull down实验还发现定位于肌原纤维的MR-1与重要的肌节结构即肌节分子 myomesin-1、肌球蛋白调节轻链-2(myosin light chain-2,MLC-2)与MR-1分子均有直接的相互作用。Myomesin-1是重要的肌节M线调控分子,对于肌原纤维的形态和功能维持都具有关键的作用。MLC-2作为肌肉收缩装置的调节蛋白,参与了正常生理状态下肌节结构的维持以及特定信号如心肌肥大信号刺激下的心肌重塑。因此,MR-1可能通过影响myomesin-1、MLC-2调节的肌原纤维生成过程,促进心肌肌原纤维生成而引起心肌肥大。为此本研究在体外培养的Sprauge-Dawly新生乳大鼠心肌细胞模型中通过外源性过表达和内源性抑制MR-1水平,研究MR-1干预对心肌细胞肥大指标、肌原纤维生成以及重要肌节分子myomesin-1、MLC-2变化的影响。
1 材料与方法
1.1 新生乳大鼠心肌细胞培养 用于实验的新生乳大鼠心肌细胞从24 h内新生的清洁级Sprague-Dawley大鼠[由北京大学医学部实验动物中心(SCXK-2011-0039)提供]心室肌组织分离得到,培养方法参照Simpson和Savion[8]的步骤加以改进[9]:新生乳大鼠消毒后无菌操作取心尖部组织,剪碎成1 mm× 1 mm×1 mm大小,加入适量0.08%胰蛋白酶于37℃水浴下机械振荡、反复消化,制备心肌细胞悬液,差速贴壁法去除非心肌细胞,用含10%胎牛血清(奥地利,PAA)的达尔伯克改良伊格尔培养液(Dulbecco′s modified Eagle′s medium)调整细胞为3×106/mL后,每瓶7.5 mL悬液接种于75 cm2培养瓶,于5%CO2、37℃的孵箱内过夜培养;之后每日全量更换培养液,连续培养3 d后可进行继代培养用于后续实验。用于后续实验的细胞以不同的处理方法分为5组。①正常对照组,心肌细胞常规培养至实验结束。②MR-1过表达组,Lipofectamin 2000(美国,Invitrogen公司)转染构建的MR-1真核表达质粒pcDB-MR-1[10],转染方法参照Invitrogen公司的操作手册。③MR-1抑制组,RNAi技术沉默内源性MR-1。在以Lipofectamin 2000转染稳定型小时序 RNA(small temporal RNA,stRNA)[11]之前,先进行沉默效率检测从而选择优势stRNA序列。以BLOCK-iTTMRNAi Designer软件针对MR-1基因(NM_001134753.1)设计3个双链RNA(double-stranded RNA,dsRNA)靶点,通过预实验筛选一个优势序列为5′-CGACAGCU AACAAGGCUUCCCAGAA-3′。④空载对照组,pcDB空载质粒转染组。⑤随机RNA对照组,25 bp的随机dsRNA转染。
1.2 反转录-聚合酶链反应 原代培养的新生乳大鼠心肌细胞消化后以1.5×104/cm2接种60 mm规格的培养皿,次日进行处理,48 h后收获细胞提取总RNA,反转录-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)步骤参照Easy-Script First-Strand cDNA Synthesis SuperMix试剂盒(北京全式金生物技术有限公司)操作手册。根据目的基因互补DNA(complementary DNA,cDNA)设计新生乳大鼠源性磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)、MR-1、心房利钠因子(atrial natriuretic facto,ANF)、脑钠肽(brain natriuretie peptide,BNF)、myomesin-1、MLC-2和MR-1引物,序列如表1所示。PCR扩增条件为50℃保温30 min、94℃变性2 min、94℃变性15 s、退火30 s (退火温度根据不同引物设为不同的Tm-5℃)、72℃1 min,35个循环后72℃延伸10 min。1.5%琼脂糖凝胶电泳,紫外分光光度计观察并采集图像。
1.3 免疫印迹检测 以1.5×104/cm2将细胞接种至100 mm培养皿,次日贴壁后进行各种处理,培养48 h后以放射免疫沉淀试验全细胞裂解液(500 mmol/L三羟甲基氨基甲烷-盐酸缓冲液、150 mmol/L NaCl、0.1%十二烷基磺酸钠、1%乙基苯基聚乙二醇、0.5%脱氧胆酸钠、0.5 mmol/L二硫苏糖醇、100 μmol/L苯甲基磺酰氟,pH 8.0)裂解细胞并提取蛋白,以Bradford法[12]蛋白定量后取含有50~100 μg蛋白的上清液与5×上样缓冲液(250 mmol/L三羟甲基氨基甲烷-盐酸缓冲液、20%十二烷基磺酸钠、0.5%溴酚蓝、50%甘油、5%β-巯基乙醇,pH 6.8)混合煮沸10 min,离心取上清进行聚丙酰胺凝胶电泳。根据目的蛋白相对分子质量分别选择分离胶浓度: MR-1、MLC-2小相对分子质量蛋白分离用12%的凝胶,myomesin-1则用8%的凝胶。电泳后以半干式法电转至硝酸纤维素膜上,0.01 mol/L TBST(10 mmol/L三羟甲基氨基甲烷-盐酸缓冲液、150 mmol/L NaCl、8 mmol/L叠氮钠、0.01%吐温-20,pH 7.5)配制的50 g/L脱脂奶粉室温封闭2 h,加入一抗于4℃过夜杂交。不同抗体分别为MR-1(自制多抗,1∶200)[13]、MLC-2(美国,Santa Cruz公司,1∶200)、myomesin-1(美国,Santa Cruz公司,1∶100)、GAPDH (美国,Santa Cruz公司,1∶500);TBST洗涤3次后,加入辣根过氧化物酶标志的二抗(TBST配制,1∶1 000),室温作用1 h;充分洗涤后进行发光显影。
1.4 [3H]-亮氨酸掺入法 原代培养的新生乳大鼠心肌细胞按1×104/cm2接种于6孔板,常规培养后换无血清培养基培养24 h后随机分为5组(每组平行孔n=3),于相应时点加入[3H]-亮氨酸(10 μCi/mL),继续培养24 h,结束实验时以4℃预冷的0.01 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS,154 mmol/L NaCl、1.9 mmol/L NaH2PO4、8.1 mmol/L Na2HPO4)冲洗2次,吸干废液,加入2 mL闪烁液,反应15 min后在液闪仪(美国,PerkinElmerTMWallac 1450)上测定[3H]-亮氨酸放射性强度,单位为校正的每分钟细胞计数(calibrated counts·min-1,ccpm),反映心肌细胞蛋白质合成速率。
1.5 细胞表面积测量实验 原代培养的心肌细胞按1×104/cm2接种于24孔板,常规培养后换无血清培养基,培养24 h和48 h后各随机分为正常对照组、MR-1过表达组和空载对照组3组,每组3个平行孔在倒置显微镜(日本,Olympus公司,BH-2)视野下(×200)观察细胞形态并进行录像,每孔随机采5个视野,每视野测定10~15个细胞表面积,取平均值。
1.6 细胞荧光实验 细胞处理48 h后以PBS洗涤3次,-20℃预冷的冰甲醇预固定5 min,2.5%戊二醛固定30 min。以含有0.2%聚乙二醇辛基苯基醚的10%正常驴血清(美国,Santa Cruz公司)封闭30 min后,以1%牛血清白蛋白稀释的一抗MR-1(自制,1∶100)[13]、MLC-2(1∶100,美国,Santa Cruz公司)、myomesin-1(1∶100,美国,Santa Cruz公司)孵育2 h或鬼笔环肽-异硫氰酸荧光素(美国,Sigma公司,1∶100)染料工作液避光孵育1 h;一抗孵育后以PBS充分洗涤,与相应的荧光二抗工作液杂交反应。荧光二抗以PBS配制,稀释度分别为罗丹明标志的驴抗兔荧光二抗(1∶400)、异硫氰酸荧光素标志的驴抗山羊荧光二抗(1∶200)免疫印迹。二抗在室温下避光孵育 2 h,杂交结束前 10 min以 Hoechst 33258(美国,Merck-Calbiochem公司)衬染细胞核,反应充分洗涤后用50%的甘油-PBS封片,激光扫描共聚焦显微镜(德国,Zeiss公司,LSM-510 Meta)观察并采集图像。
1.7 半定量分析和统计学处理 用Image-Pro Plus (IPP)专业图像分析软件[14](4.1版,美国,Media Cybernetics公司)分析RT-PCR、免疫印迹条带的积分光密度(integral optical density,IOD),并与内参照GAPDH的IOD进行比率计算,不同引物或抗体反应后若在同一表中显示(表1)其IOD,则以它们的正常对照组为原点,将其IOD校正为1.000,得到的各组相对值作柱状图;新生乳大鼠心肌细胞表面积测量及分析同样用IPP图像分析软进行,单位为平方微米(μm2)。应用SPSS 11.0分析,各组实验数据以均数±标准差(x¯±s)表示,多组间两两比较用Bonferroni′s test,P<0.05为差异有统计学意义。
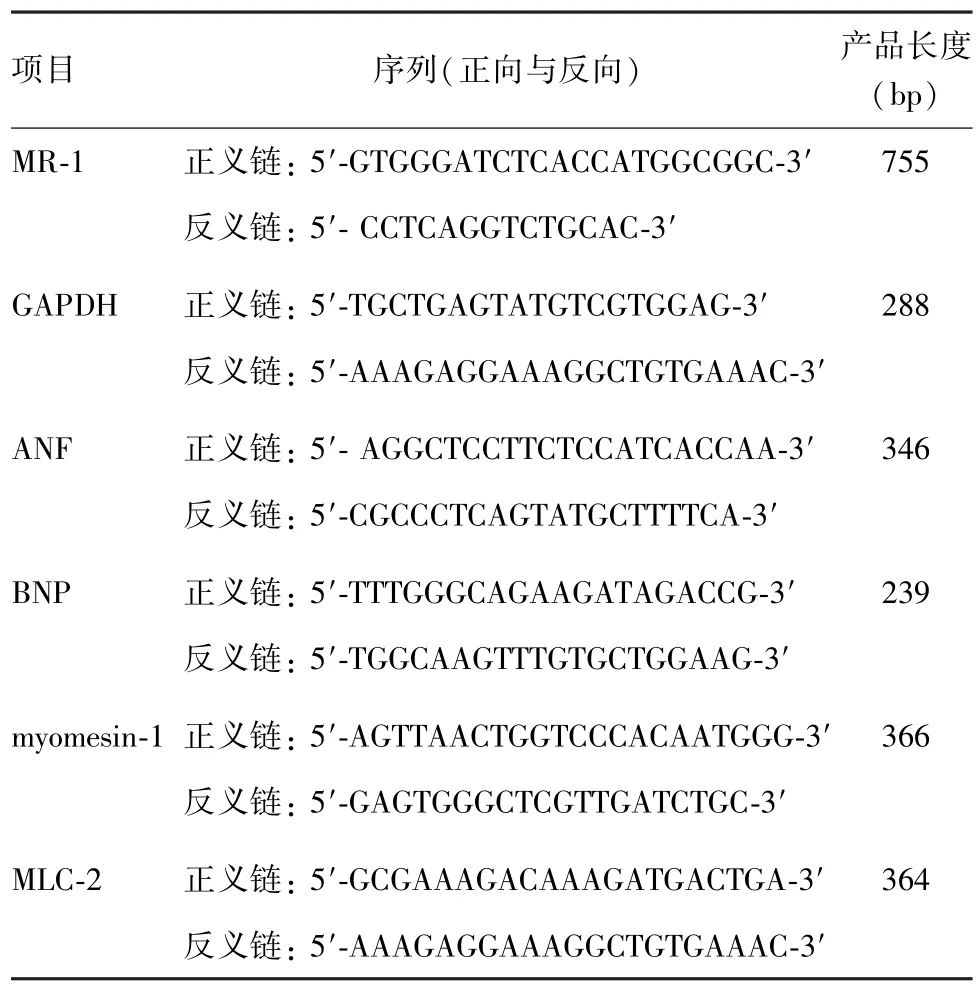
表1 RT-PCR引物
2 结果
2.1 pcDNA3.1-MR-1及细胞表面积 检测MR-1过表达的心肌细胞模型,在pcDNA3.1-MR-1转染8、16、24、48 h时MR-1的水平比空载对照组分别高1.6、2.8、3.4、3.4倍(P<0.05,图1A)。通过[3H]-亮氨酸掺入法、细胞表面积测定以及ANF和BNP转录水平评估心肌细胞肥大,与空载对照组比较,pcDNA3.1-MR-1转染24 h后,ANF和BNP mRNA水平分别高1.1、0.9倍(P<0.05,图1B);转染48 h后,[3H]-亮氨酸掺入法代表的蛋白合成速率比空载对照组高0.9倍[(3 333.5±106.1)ccpm与(1 789.3± 83.0)ccpm,P<0.05,图1C],而细胞平均表面积则高1.0倍[(18 487.9±3 804.9)μm2与(8 998.2± 1 427.7)μm2,P<0.05,图1D]。
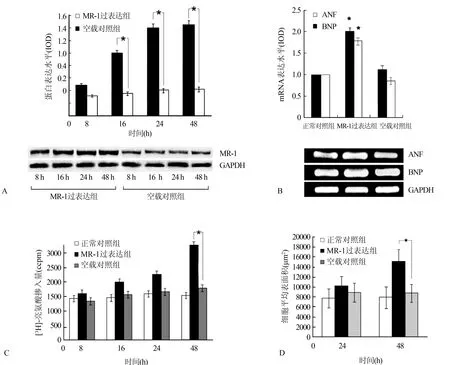
图1 MR-1的相对表达水平及MR-1转染后心肌细胞肥大指标测量(∗P<0.05)
2.2 MR-1的定位与排布 在正常培养48 h后心肌细胞以细胞免疫荧光术对MR-1分别与肌节Z带的标志分子α-actinin和A带标志分子MLC-2进行双标染色,MR-1主要定位于α-actinin染色阴性(图2A)、MLC-2阳性(图2B)的横纹肌样区域,MR-1与MLC-2共定位明显。在MR-1条带正中有明显的暗带(图2B),清晰地显示了肌节中的H带。
在正常培养1~3 d的心肌细胞中,大多数细胞中的MR-1保持了点状、纤细、整齐且完整的肌原纤维结构(图2C,正常对照组)。随着培养时间的延长,MR-1的细胞排布发生了规律的变化,多数心肌细胞中的MR-1从前期的未成熟型变为成束状的、明暗相间呈典型横纹肌样(striated like)的成熟型排布方式。这种变化很快即可在pcDNA3.1-MR-1转染的心肌细胞中观察到。正常培养1 d后转染pcDNA3.1-MR-1 16 h后,在大多数心肌细胞中即可观察到高度有序的、组织良好的横纹肌样MR-1排布(图2C,MR-1过表达组)。2种MR-1的排布模式(未成熟的纤维丝样和成熟的横纹肌样)可在同一个心肌细胞中被观察到,如pcDNA3.1-MR-1转染16 h的心肌细胞中显示2种MR-1排布结构(图2C,空载对照组)。
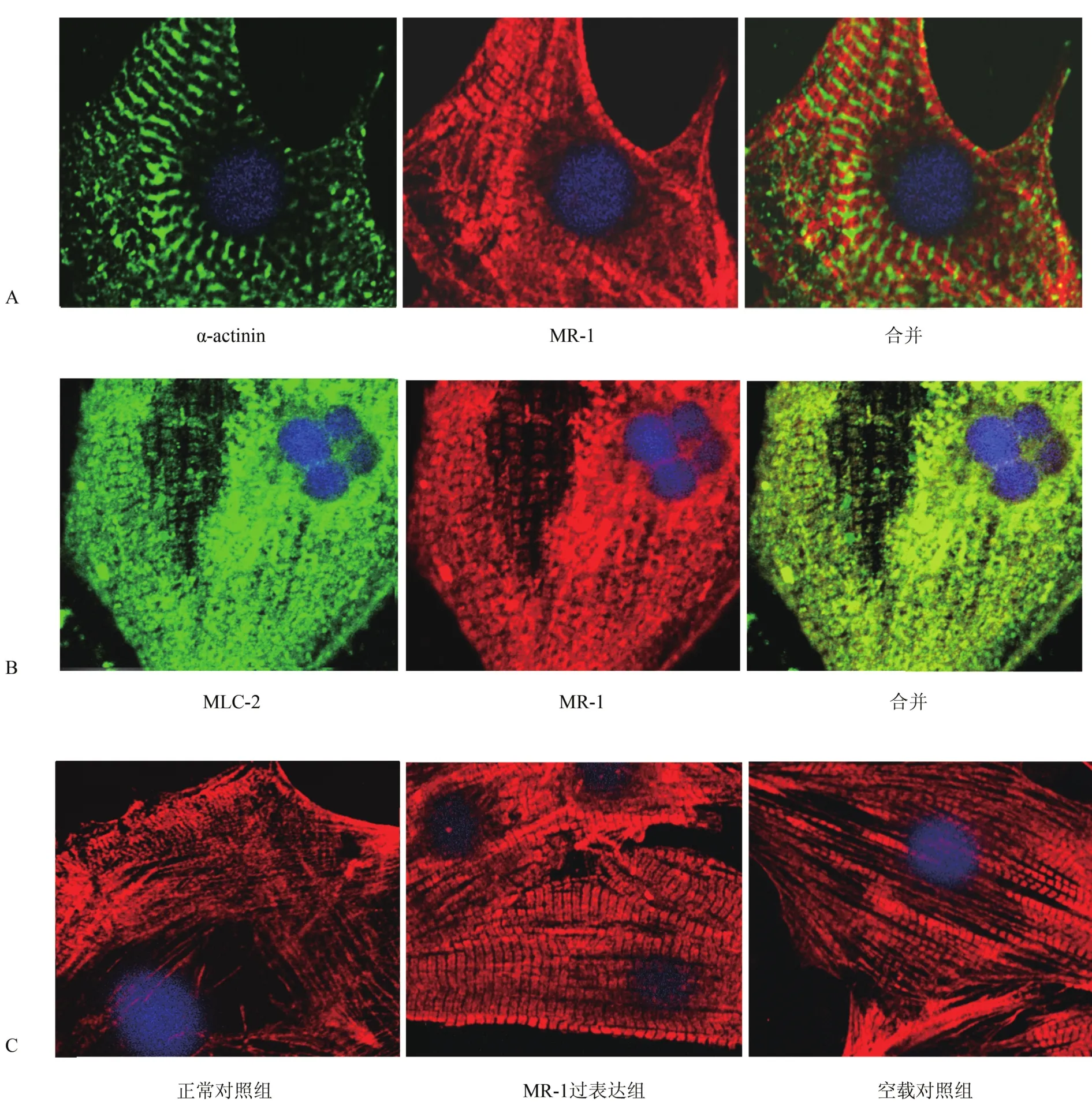
图2 MR-1亚细胞定位及其在心肌肌原纤维的排布
2.3 肌节组装
2.3.1 肌节F-actin聚合和组装 以鬼笔环肽-异硫氰酸荧光素染料对培养1 d而后转染pcDNA3.1-MR-1 8~24 h的心肌细胞进行F-actin细胞骨架的标志,通过计数表现为肌节F-actin(横纹肌样结构)的心肌细胞占细胞总数的比率对心肌细胞的肌节组装程度进行评估,正常对照组的心肌细胞多呈应力纤维样(stress fiber-like)结构,空载对照组与之类似(图3A)。MR-1转染的心肌细胞在转染8 h后即显示快速的肌节组装。超过2/3的心肌细胞呈现肌节组装良好的模式。与转染空载对照组相比,转染pcDNA 3.1-MR-1 8 h后肌节组装良好的心肌细胞比率高0.6倍[(34.5±5.5)%与(21.6±7.6)%,P>0.05],转染16 h后高1.0倍[(58.1±4.3)%与(29.1±5.3)%,P<0.01],转染24 h后则高1.3倍[(62.1±5.4)%与(26.4±4.8)%,P<0.01]。进一步以F-/G-actin组分分离结合免疫印迹检测方法半定量分析纤维样型的肌动蛋白 F-actin与单体型的 G-actin的比值,pcDNA3.1-MR-1转染16 h后心肌细胞中F-/G-actin比率比空载对照组高3.3倍(P<0.05,图3B,n=3)。
2.3.2 心肌细胞肌节分子myomesin-1和MLC-2的表达 MR-1转染24 h后,与空载对照组比较,myomesin-1和MLC-2的mRNA水平分别高6.7倍和3.2倍(P<0.01,图3C-a,)。与之类似,MR-1转染24 h后myomesin-1和MLC-2的蛋白水平比空载对照组明显高24.4倍和3.0倍(P<0.01,图3C-b、c)。
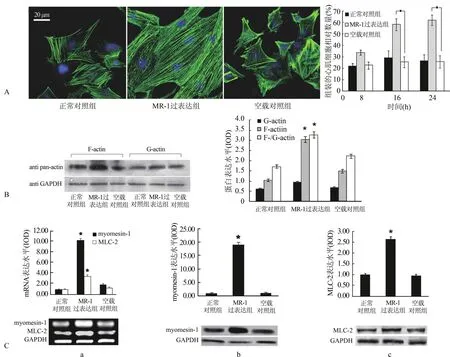
图3 MR-1质粒转染新生大鼠心肌细胞引起快速的肌节组装(∗P<0.05)
2.3.3 心肌细胞肌节Z线的发育 测量2条相邻Z线间的距离作为评估肌节组装成熟度的指标之一,MR-1转染明显促进了Z线距离的增加,在MR-1转染不同的时间段分别与空载对照组比较,转染8 h后2条Z线间距分别为(1.62±0.06)μm、(1.47± 0.04)μm,转染16 h后为(1.79±0.07)μm、(1.53± 0.06)μm,转染24 h则为(1.93±0.08)μm、(1.72± 0.04)μm(P<0.05)。
2.4 肌节组装的分子结构
2.4.1 Myomesin-1的细胞核-细胞质转位 在新生乳大鼠心肌细胞模型中以细胞免疫荧光研究发现,myomesin-1主要定位于正常培养的心肌细胞核中(图4A,正常对照组),转染空载对照组不影响其定位分布(图4A,空载对照组),但MR-1转染24 h后,细胞核定位的myomesin-1转位至细胞质(图4A,MR-1过表达组)。
2.4.2 MR-1对myomesin-1小泛素样调节因子化修饰 将构建的pcDNA3.1-小泛素样调节因子-1 (small ubiquitin-like modifier-1,SUMO-1)质粒转染至心肌细胞24 h,myomesin-1细胞核-细胞质转位效果与MR-1转染效果一致(图4A,SUMO-1)。以MR-1-siRNA转染心肌细胞抑制内源性MR-1的表达后,多数myomesin-1仍定位在细胞核中(图4A,MR-1抑制组)。在心肌细胞中共转染MR-1-siRNA和SUMO-1质粒,与单独转染SUMO-1质粒不同的是myomesin-1仍然定位于细胞核中,少数则在细胞核周区域(图4A,SUMO-1+MR-1抑制组)。检测心肌细胞肌节F-actin组装程度,单纯转染SUMO-1后肌节组装良好的心肌细胞由(59.8±6.9)%降低为共转染MR-1-siRNA和 SUMO-1质粒后的(22.1±6.4)%(P<0.05,图4B)。
检测pcDNA3.1-MR-1转染24 h后细胞中的SUMO-1水平与空载对照组比较,MR-1过表达细胞中SUMO-1的mRNA和蛋白水平均无明显升高(P>0.05)。
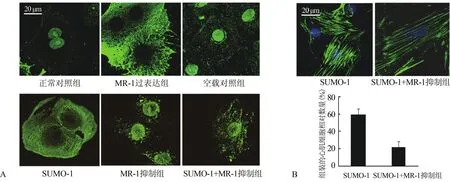
图4 Myomesin-1转位及SUMO-1诱导肌节组装
3 讨论
本研究基于心肌肥大相关的新基因MR-1,证实了MR-1过表达直接诱导体外培养的新生乳大鼠心肌细胞肥大,表现为ANF和BNP水平明显上调、蛋白合成速率明显促进以及细胞平均表面积明显增大,提示MR-1是引起心肌细胞肥大的充分条件。
在预实验中以特异性结合于早期凋亡细胞中磷脂酰丝氨酸的annexinⅤ-异硫氰酸荧光素结合流式细胞术检测了细胞凋亡情况,与正常对照组和空载对照组比较,并未发现MR-1转染48 h以内的心肌细胞表现出明显增加的凋亡率;在转染的48 h时段中,心肌细胞尽管肌原纤维生成增加,但未表现出肌原纤维排布紊乱等病理性肥大的现象,提示MR-1过表达48 h诱导的心肌细胞肥大为代偿性的生理性肥大。MR-1在AngⅡ诱导的肥大心肌细胞中明显上调[6],但其他肥大刺激因子是否也有同样诱导MR-1上调的效果目前尚未阐明。
前期的免疫组化结果证实,MR-1定位于心肌肌原纤维,与几种关键的肌肉收缩蛋白有相互作用[5],提示MR-1可能与调节肌原纤维生成有关。本研究首次检测到MR-1定位于肌节的A带,与MLC-2分子有明显的共定位,提示MR-1可能本身即作为心肌细胞肌节的结构分子发挥作用。为进一步明确其功能,检测了肌原纤维的组成分子F-actin,特别关注了F-/G-actin比率及含有组装良好的肌节F-actin的心肌细胞比率。此外,还观察了另外2种重要肌节分子myomesin-1和MLC-2的表达与转位。在肌节组装中,相邻M线的距离始终保持在2.0 μm左右,但相邻2条Z线的距离从肌节组装早期的1.1 μm增加到成熟阶段的2.0 μm[15]。以细胞免疫荧光术标志了Z线标志物α-actinin并以激光扫描共聚焦显微镜(LSM-510 Meta)自带图像分析软件测量了Z线间平均距离,与空载对照组比较,pcDNA3.1-MR-1转染诱导快速的F-actin聚合、肌节F-actin的快速组装/相邻Z线间距的明显增加,以及肌节蛋白MLC-2和myomesin-1的表达水平明显上调。有趣的是,这些变化都出现在pcDNA3.1-MR-1转染24 h后,发生在心肌细胞表面积和蛋白合成速率增加肥大表型出现之前(pcDNA3.1-MR-1转染48 h后),提示MR-1调节的肌节组装的促进可能是引起心肌细胞肥大的重要原因。
本研究探究了MR-1调节肌节组装的分子机制,185×104相对分子质量的M线标志蛋白myomesin-1与肌联蛋白和肌球蛋白有相互作用[16-19],在调节肌节组装、维持肌节结构的稳定性和调节肌肉分化方面具有关键的意义[20-22],因而被认为是最重要的肌节M线蛋白。本研究发现过表达的MR-1明显促进myomesin-1的转位及上调,提示MR-1可能通过调节myomesin-1这一关键靶点促进肌节组装。
SUMO是一种转录后修饰蛋白,含有101个氨基酸残基,具有通过SUMO化信号途径调节其他蛋白的亚细胞定位、转录活性功能。在这一过程中,SUMO小肽必须通过目标蛋白上的WKXE序列对其进行识别,而后与该蛋白上的赖氨酸残基发生共价结合[23-24]。Reddy等[20]提出了myomesin-1是肌肉分化中某种未知蛋白表达所必须的假说。这种未知蛋白一旦表达后,SUMO化的myomesin-1将从细胞核中转出,开始有序地整合进入位于细胞质的肌节中。然而,在新生动物心肌细胞核中SUMO-1和(或)SUMO共价机制并未发育完全,因而大部分myomesin-1仍旧滞留于细胞核中[15]。作者发现过表达SUMO-1促进了myomesin-1的转位和心肌细胞的肌节组装,这一现象与过表达MR-1的结果十分类似。然而,SUMO-1诱导的myomesin-1转位和上调在SUMO-1与MR-1 siRNA共转染时被明显抑制,提示MR-1在SUMO介导的myomesin-1转位中是必要条件,myomesin-1可能受到MR-1相关的SUMO化机制调节。进一步检测MR-1转染后SUMO-1的转录和翻译水平,发现过表达 MR-1并未上调SUMO-1的表达水平,因而提示MR-1可能通过加强myomesin-1与SUMO分子的结合而非促进其合成的方式调节myomesin-1的功能,证实myomesin-1的SUMO化对其功能的发挥十分重要[17]。综上表明,过表达MR-1通过促进SUMO化myomesin-1介导的肌节组装诱导新生乳大鼠心肌细胞肥大。
[1]刘秀华.内质网应激与心肌肥大[J].生理学报,2009,61(1):9-14.
[2]Sadoshima J,Izumo S.The cellular and molecular response of cardiac myocytes to mechanical stress[J].Annu Rev Physiol,1997,59:551-571.
[3]Epstein HF,Fischman DA.Molecular analysis of protein assembly in muscle development[J].Science,1991,251 (4997):1039-1044.
[4]Bonow RO,Mann DL,Zipes DP,et al.Braunwald′s heart sisease:a textbook of cardiovascular medicine[M].6th ed. Philadelphia:Saunders,2001:1324-1329.
[5]Li TB,Liu XH,Feng S,et al.Characterization of MR-1,a novel myofibrillogenesis regulator in human muscle[J]. Acta Biochim Biophys Sin(Shanghai),2004,36(6):412-418.
[6]Liu X,Li T,Sun S,et al.Role of myofibrillogenesis regulator-1 in myocardial hypertrophy[J].Am J Physiol Heart Circ Physiol,2006,290(1):H279-H285.
[7]Li HL,She ZG,Li TB,et al.Overexpression of myofibrillogenesis regulator-1 aggravates cardiac hypertrophy induced by angiotensinⅡin mice[J].Hypertension,2007,49(6): 1399-1408.
[8]Simpson P,Savion S.Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells.Cross-striations,ultrastructure,and chronotropic response to isoproterenol[J].Circ Res,1982,50(1):101-116.
[9]Xiao H,Wu Z,Shen H,et al.In vivo reversal of P-glycoprotein-mediated multidrug resistance by efficient delivery of stealth RNAi[J].Basic Clin Pharmacol Toxicol,2008,103(4):342-348.
[10]Liu X,Wu X,Cai L,et al.Hypoxic preconditioning of cardiomyocytes and cardioprotection:phophorylation of HIF-1alpha induced by p42/p44 mitogen-activated protein kinases is involved[J].Pathophysiology,2003,9(4):201-205.
[11]王晓礽,刘秀华,李婷,等.人肌纤生成调节因子1真核表达载体的构建及其在乳鼠心肌细胞中的表达[J].中国动脉粥样硬化杂志,2010,18(2):91-94.
[12]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72: 248-254.
[13]王晓礽,刘秀华,宋泉声,等.人肌纤生成调节因子-1抗体的制备、鉴定及其在乳鼠心肌细胞中的应用[J].中国病理生理杂志,2010,26(1):42-47.
[14]Sharma A,Trivedi NR,Zimmerman MA,et al.Mutant V599EB-Raf regulates growth and vascular development of malignant melanoma tumors[J].Cancer Res,2005,65 (6):2412-2421.
[15]Kontrogianni-Konstantopoulos A,Catino DH,Strong JC,et al.De novo myofibrillogenesis in C2C12 cells:evidence for the independent assembly of M bands and Z disks[J].Am J Physiol Cell Physiol,2006,290(2):C626-C637.
[16]Grove BK,Kurer V,Lehner C,et al.A new 185,000-dalton skeletal muscle protein detected by monoclonal antibodies [J].J Cell Biol,1984,98(2):518-524.
[17]Pernigo S,Fukuzawa A,Bertz M,et al.Structural insight into M-band assembly and mechanics from the titin-obscurin-like-1 complex[J].Proc Natl Acad Sci USA,2010,107(7):2908-2913.
[18]Price MG,Gomer RH.Skelemin,a cytoskeletal M-disc periphery protein,contains motifs of adhesion/recognition and intermediate filament proteins[J].J Biol Chem,1993,268(29):21800-21810.
[19]Du A,Sanger JM,Linask KK,et al.Myofibrillogenesis in the first cardiomyocytes formed from isolated quail precardiac mesoderm[J].Dev Biol,2003,257(2):382-394.
[20]Reddy KB,Fox JE,Price MG,et al.Nuclear localization of Myomesin-1:possible functions[J].J Muscle Res Cell Motil,2008,29(1):1-8.
[21]Xiao S,Gräter F.Molecular basis of the mechanical hierarchy in myomesin dimers for sarcomere integrity[J].Biophys J,2014,107(4):965-993.
[22]Wilson VG,Rangasamy D.Intracellular targeting of proteins by sumoylation[J].Exp Cell Res,2001,271(1):57-65.
[23]Droescher M,Chaugule VK,Pichler A.SUMO rules:regulatory concepts and their implication in neurologic functions[J].Neuromolecular Med,2013,15(4):639-660.
[24]Lu H,Liu B,Zhang FJ,et al.The E3 ligase APC/C-Cdh1 regulates MEF2A-dependent transcription by targeting SUMO-specific protease 2 for ubiquitination and degradation[J].Cell Cycle,2014,13(24):3892-3902.
Myofibrillogenesis regulator-1 induces hypertrophy by promoting sarcomere organization in neonatal rat cardiomyocytes
WANG Xiaoreng,LIU Xiuhua,WANG Song,LUAN Kang
(Department of Pathophysiology,Chinese PLA General Hospital,Beijing 100853,China)
Objective Exploration of myofibrillogenesis reguiator-1(MR-1)by regulating the generation mechanism of causing myofibrillar hyperlrophy of the cardigmyocytes.Methods After intervention of MR-1 expressions in neonatal rat cardiomyocytes,we measured several hypertrophic index e.g.the mRNA levels of the atrial natriuretic factor(ANF)and brain natriuretic peptide(BNP),the cell size,and the velocity of protein synthesis.The sarcomeric F-actin organization were detacted by staining with phalloidin-fluorescein isothiocyanate(FITC);sublocation of myomesin-1 and myosin regulatory light chain(MLC-2)were assessed by semi-quantitative reverse transcription-polymerase chain reaction(RT-PCR),western blot,and immunocytofluorescent assays. Results MR-1 overexpression induced cardiomyocyte hypertrophy,promoted the sarcomeric F-actin organization,increased the expression of MLC-2 and myomesin-1(P<0.05),as well as the myomesin-1 translocation from nucleus to cytoplasm.Those results of myomesin-1 translocation and F-actin organization were similar to the small ubiquitin modifier-1(SUMO-1)overexpression,MR-1 inhibition by RNA interference did not induce the translocation of myomesin-1,even decrease the SUMO-1 overexpression induced myomesin-1 translocation,as well as the promoted F-actin organization. Conclusion MR-1 induces cardiomyocytes hypertrophy by promoting the MLC-2 and myomesin-1 induced myofibrillogenesis.
Myofibrillogenesis regulator-1(MR-1);Cardiomyocyte hypertrophy;F-actin;Myomesin-1;Myosin light chain-2(MLC-2)
R542.2-332
A
2095-3097(2015)01-0037-08
10.3969/j.issn.2095-3097.2015.01.011
2014-12-20 本文编辑:徐海琴)
国家自然科学基金项目(30770902);国家自然科学基金重大国际合作资助项目(30620130111)
100853北京,解放军总医院病理生理研究室(王晓礽,刘秀华,王 松,栾 康)
刘秀华,E-mail:xiuhualiu98@163.com.cn
