雌激素受体α磷酸化位点突变体T224A和S559A的构建及其转录激活活性检测
2015-11-29陈伟周鹏宇朱永杰马胜利曹叶张萍萍何湘魏从文钟辉吴飞翔
陈伟 ,周鹏宇,朱永杰,马胜利,曹叶,4,张萍萍,5,何湘,魏从文,钟辉,吴飞翔
1.广西医科大学附属肿瘤医院 肝胆外科,广西 南宁 530021;2.军事医学科学院 生物工程研究所,北京 100850;3.安徽大学 健康科学院,安徽 合肥 230039;4.吉林大学 分子酶学工程实验室,吉林 长春 130012;5.济南军区总医院 实验检验科,山东 济南 250031
乳腺癌是现代女性最常见的肿瘤之一,它的发生发展和许多因素相关,其中与雌激素受体(estrogen receptor,ER)的关系最为密切[1-2]。ER属于类固醇核受体,包括ERα和ERβ两个亚型,ERα促进乳腺癌的发生发展,而ERβ抑制乳腺癌的发生[3-4]。目前关于ERα的研究相对较多。ERα含595个氨基酸残基,相对分子质量约为66×103,包含5 个结构域,依次为不依赖配体激活的AF1、负责与靶基因启动子的雌激素反应元件(estrogen receptor elements,ERE)特异结合的DNA 结合域(DNA binding domain,DBD)、核定位信号的铰链区、配体结合功能区(ligand-binding domain,LBD)和配体依赖转录的AF2,以及功能不详的可变区[5-7]。ERα常发生翻译后修饰,如磷酸化、泛素化、甲基化、乙酰化、SUMO、棕榈化,其中以磷酸化最为常见。现已报道的ERα磷酸化位点有十几个,其中研究比较透彻的有7个,为S104、S106、S118、S167、S236、S305 及Y537[8-9]。不同区域磷酸化对ERα的作用也不同,如DBD区的S236 位点在蛋白激酶A 作用下发生磷酸化,从而抑制ERα二聚化形成,阻断其与DNA 的结合;而由Src酪氨酸激酶介导的Y537 磷酸化主要调节ERα与E2的结合能力[10-11]。这些翻译后修饰常常调节ERα与ERE的结合,从而激活或抑制下游基因的转录,包括c-myc、BCL-2、Bcl-XL、Cyclin D1、IL-8,这些下游基因与乳腺癌的发生、发展有着密切的关系[12-13]。因此,ERα翻译后修饰常为乳腺癌研究的重点和热点。
本课题组前期在乳腺癌相关研究中,通过质谱分析发现在ERα DBD 区224 位苏氨酸(T224)和可变区559 位丝氨酸(S559)发生磷酸化。虽然559 位丝氨酸发生磷酸化已有报道,但对其研究尚少[9],而224 位苏氨酸磷酸化尚无报道。为此,我们构建了ERα 224 位苏氨酸、559 位丝氨酸磷酸化突变点载体,通过萤光素酶报告基因方法检测这些突变位点对ERα活性是否产生影响。
1 材料与方法
1.1 材料
HEK293T 细胞、感受态大肠杆菌DH5α、pRL 质粒、ERE 启动子的萤光素酶报告基因质粒(EREluc)及pcDNA3-Flag 均为本实验室保存;真核表达质粒pcDNA3-Flag-ERα为本实验室构建保存;引物合成及测序由奥科鼎盛生物技术公司完成;限制性内切酶、T4DNA连接酶等购自TaKaRa公司;高保真PfuDNA聚合酶、胶回收试剂盒、质粒提取试剂盒购自Tiangen 公司;萤光素酶活性测定试剂盒购自Promega公司;DMEM培养基购自Gibco生物公司;胎牛血清购自杭州江滨公司;转染试剂LipofectAMINE 2000 购自Invitrogen 公司;鼠抗Flag 抗体购自Santa Cruz公司;雌激素、HRP标记的鼠抗微管蛋白抗体购自Sigma 公司;HRP 标记的羊抗鼠购自北京中杉金桥生物有限公司。
1.2 扩增突变片段
利用重组PCR扩增ERα(T224A)、ERα(S559A)突变片段,即ACC突变为GCC、TCC突变为GCC。根据ERα基因序列及点突变需要设计引物(表1),由奥科鼎盛生物技术有限公司合成。
以本实验室构建保存的野生型ERα质粒为模板,用相应的引物,通过PCR 扩增出含有点突变的上、下游目的基因片段(扩增条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,68℃延伸90 s,进行30 个循环;68℃延伸7 min),经琼脂糖凝胶电泳及上、下游片段回收,以等摩尔比例的上、下游配对片段为共同模板,利用搭桥法进行二次PCR(扩增条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,68℃延伸120 s,进行30 个循环;68℃延伸7 min),扩增出点突变的全长目的基因片段。
1.3 构建磷酸化位点突变载体
把全长点突变片段、pcDNA3-Flag 质粒分别用限制性内切酶BamHⅠ/EcoRⅠ于37℃双酶切过夜,利用琼脂糖凝胶电泳回收酶切片段和质粒,再以6∶1(片段∶质粒)的比例混合,室温连接10 min后把连接产物直接转化大肠杆菌DH5α,在氨苄西林培养板上于37℃培养过夜,筛选阳性克隆,以阳性克隆为模板再次行PCR,确定重组质粒上含有目的基因片段后,送奥科鼎盛生物科技有限公司测序。
1.4 细胞培养及转染
用含10%胎牛血清、200 U/mL 青霉素、200 U/mL链霉素的DMEM培养基,在5% CO2、37℃的培养箱中培养HEK293T细胞,当细胞长至10 mm培养皿的60%~80%时用于转染,转染前1 h 更换4 mL 新鲜培养基。先把4 μg 构建的质粒、4 μL 转染试剂LipofectAMINE 2000 分别加入200 μL 生理盐水中混合,静置5 min,把混有转染试剂的生理盐水加入混有质粒的生理盐水中,静置15 min,均匀地加入培养基中,4 h后补4~6 mL新鲜培养基。
1.5 免疫印迹分析
转染24 h 后收集细胞,加入SDS 上样缓冲液(50 mmol/L Tris-HCl pH6.8,0.1%溴酚蓝,2%SDS,10%甘油,2.5% β-巯基乙醇),沸水浴10 min,离心10 min 后取上清进行SDS-PAGE,电泳结束后转移至PVDF 膜上,用5%脱脂牛奶室温封闭1 h 或4℃过夜,然后加入稀释的Flag 抗体,室温孵育1 h或4℃孵育过夜;用1×TBST洗膜3次,每次5 min,再加入稀释的带有辣根过氧化物酶偶联的羊抗鼠IgG,室温孵育1 h,再次用1×TBST洗膜3次,每次5 min,然后将含有辣根过氧化物酶底物的ECL 滴加至膜上,随即在暗室中压片显影。
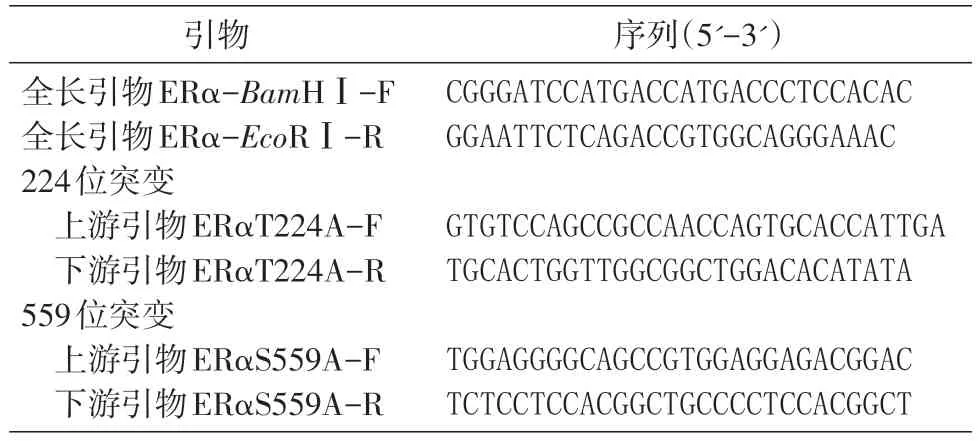
表1 引物及序列
1.6 萤光素酶报告基因检测
把HEK293T 细胞接种到6 孔板培养,用无指示剂的白色DMEM培养基培养24 h,等长至60%~80%时进行转染。实验组设立分别为:①pcDNA3-Flag(1 μg/孔);②pcDNA3-Flag-ERα质粒(1 μg/孔);③pcDNA3-Flag-ERα(T224A)突变质粒(1 μg/孔);④pcDNA3-Flag-ERα(S559A)突变质粒(1 μg/孔)。以上组均与ERE-luc 质粒(0.8 μg/孔)、pRL 质粒(0.008 μg/孔)共转,培养基中加入或不加入雌激素(10 nmol/L),共8组,每组设3个复孔。培养24 h后进行萤光素酶报告基因检测。先用1×PBS洗涤细胞2 次,再向各孔中加入100 μL 细胞裂解缓冲液,室温轻摇15 min,把细胞裂解物收集到1.5 mL离心管中,4℃、12 000 r/min 离心5 min,取30 μL 上清用于萤光素酶活性测定。
1.7 统计学分析
实验数据用SPSS13.0统计学软件处理,采用t检验进行统计学分析。显著性概率水平定为P<0.05。
2 结果
2.1 ERα T224A、S559A突变基因片段的扩增
以pcDNA3-Flag-ERα质粒为模板,通过重组PCR 扩增点突变的上、下游片段。经电泳鉴定(图1),T224A上、下游片段为600~1000 bp,S559A上游约1700 bp,下游约100 bp;再以配对上、下游片段为共同模板,二次PCR扩增出全长的突变基因片段,均约1800 bp。
2.2 ERα T224A、S559A突变质粒构建
将T224A、S559A 突变体扩增产物和pcDNA3-Flag质粒均用BamHⅠ/EcoRⅠ双酶切,回收,连接后转入大肠杆菌DH5α,用氨苄西林培养板培养。以阳性克隆菌液为模板,重复PCR 检测质粒中是否含有目的基因片段。电泳结果如图2,PCR 产物约1800 bp,证明质粒上含有目的基因片段。测序结果进一步证明插入片段为ERα突变体片段(序列略)。
2.3 Western印迹检测ERα突变体的表达
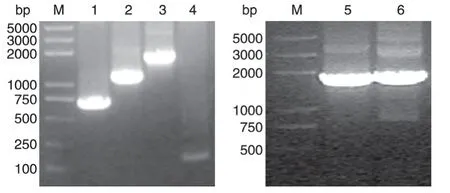
图1 琼脂糖凝胶检测PCR扩增ERα突变体产物
分别将pcDNA3-Flag-ERα、pcDNA3-Flag-ERα(T224A)、pcDNA3-Flag-ERα(S559A)及对空载体对照pcDNA3-Flag质粒转染HEK293T细胞,培养24 h后收集细胞,用抗Flag 抗体检测pcDNA3-Flag-ERα(T224A)、pcDNA3-Flag-ERα(S559A)的表达,Western 印迹结果如图3。与空载体对照组相比,转染pcDNA3-Flag-ERα、pcDNA3-Flag-ERα(T224A)和pcDNA3-Flag-ERα(S559A)的细胞,均显示有一条相对分子质量约66×103的特异性条带,与预期大小吻合,说明pcDNA3-Flag-ERα、pcDNA3-Flag-ERα(T224A)、pcDNA3-Flag-ERα(S559A)在HEK293T细胞中均获得良好表达。
2.4 萤光素酶报告基因检测突变体活性
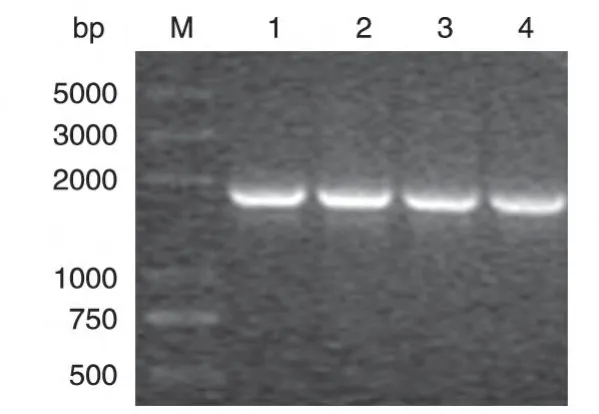
图2 突变体表达质粒的PCR鉴定
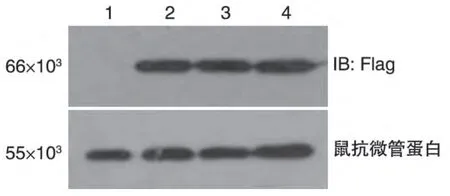
图3 ERα及突变体的Western印迹检测
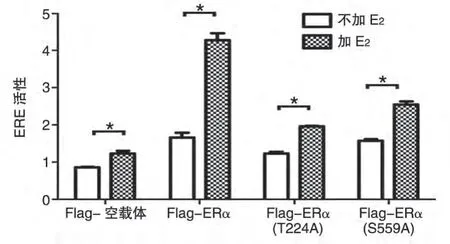
图4 ERα及其突变体在有或无E2时的转录激活活性检测
将pcDNA3-Flag、pcDNA3-Flag-ERα、pcDNA3-Flag-ERα(T224A)、pcDNA3-Flag-ERα(S559A)分别与ERE-luc 和pRL 共转入HEK293T 细胞,用无指示剂的DMEM培养基培养24 h后收集细胞,行萤光素酶活性检测,结果如图4。无雌激素时,pcDNA3-Flag-ERα、pcDNA3-Flag-ERα(T224A)和pcDNA3-Flag-ERα(S559A)的活性分别是pcDNA3-Flag 的1.94、1.49 和1.84 倍(P<0.05);与pcDNA3-Flag-ERα(T224A)相比,pcDNA3-Flag-ERα和pcDNA3-Flag-ERα(S559A)的活性明显减低(P<0.05),pcDNA3-Flag-ERα(S559A)与pcDNA3-Flag-ERα的活性差异不显著(P<0.05)。有雌激素时,pcDNA3-Flag 活性增加了0.54 倍,pcDNA3-Flag-ERα活性增强了1.57 倍,而pcDNA3-Flag-ERα(T224A)和pcDNA3-Flag-ERα(S559A)活性分别增强了0.54 和0.61 倍,说明在雌激素作用下,pcDNA3-Flag-ERα活性增强明显高于pcDNA3-Flag-ERα(T224A)和pcDNA3-Flag-ERα(S559A)(P<0.05)。因此,在HEK293T 细胞中,224 位苏氨酸的磷酸化修饰对ERα活性起着重要的作用,同时2 个磷酸化位点对雌激素调节ERα的活性也发挥重要作用。
3 讨论
ERα与乳腺癌的发生、发展、转移和治疗效果密切相关,因此乳腺癌的内分泌治疗主要以ERα介导的通路为靶点,如氟维司群(fulvestrant)抑制ERα的表达;他莫昔芬(tamoxifen)竞争性结合ERα,减少雌激素与ERα结合[14-15]。但在临床上内分泌治疗常常出现耐药性,这些耐药性常与翻译后修饰有关,其中以磷酸化最为常见[2],因此,研究ERα的磷酸化对探讨耐药机制及药物开发都有重要意义[16-17]。
有关ERα磷酸化的研究很多,已报道有十几个磷酸化位点分布在各个区域,其中研究较透彻的位点有7 个,包括AF1 区的S104、S106、S118、S167,DBD 区的S236,LBD 区的S305 及AF2 区的Y537。前期我们通过质谱分析发现,ERα在DBD 区的224位苏氨酸和可变区的559 位丝氨酸发生磷酸化,而目前关于559位丝氨磷酸化的研究甚少,而224位苏氨酸磷酸化的研究尚无报道。我们通过构建ERα 224 位苏氨酸、559 位丝氨磷酸化位点突变体,利用萤光素酶报告基因活性检测法检测其活性的改变,发现224位苏氨酸突变体活性减弱,而559位丝氨突变体对雌激素调控减弱。这可能与224位苏氨酸处于DBD 区有关,该区主要负责与靶基因启动子的ERE 结合,发生突变后可能与ERE 的结合能力减弱,从而使ERα活性减弱[18]。可变区功能研究尚未清楚,因结构上与AF2区相邻,可能与AF2区有相似的依赖配体调节ERα活性功能。因此,可变区的559 位丝氨突变后,ERα也发生受雌激素调控减弱,但需要进一步研究验证。总之,ERα磷酸化位点突变体的构建及其活性的检测,对ERα的研究有重要意义,对乳腺癌的研究也可提供一定的帮助。
[1]DeSantis C,Ma J,Bryan L,et al.Breast cancer statistics,2013[J].CA Cancer J Clin,2014,64(1):52-62.
[2]Chen M,Cui Y K,Huang W H,et al.Phosphorylation of estrogen receptor alpha at serine 118 is correlated with breast cancer resistance to tamoxifen[J].Oncol Lett,2013,6(1):118-124.
[3]Yuan B,Cheng L,Chiang H C,et al.A phosphotyrosine switch determines the antitumor activity of ERbeta[J].J Clin Invest,2014,124(8):3378-3390.
[4]Cheng L,Li J,Han Y,et al.PES1 promotes breast cancer by differentially regulating ERalpha and ERbeta[J].J Clin Invest,2012,122(8):2857-2870.
[5]Green K A,Carroll J S.Oestrogen-receptor-mediated transcription and the influence of co-factors and chromatin state[J].Nat Rev Cancer,2007,7(9):713-722.
[6]李丹妮,赵越.ERα的辅调节因子与乳腺癌关系的研究进展[J].生命科学,2011,(8):817-823.
[7]Riby J E,Chang G H,Firestone G L,et al.Ligand-independent activation of estrogen receptor function by 3,3'-diindolylmethane in human breast cancer cells[J].Biochem Pharmacol,2000,60(2):167-177.
[8]Le Romancer M,Poulard C,Cohen P,et al.Cracking the estrogen receptor's posttranslational code in breast tumors[J].Endocr Rev,2011,32(5):597-622.
[9]赵锋,韩琳,伍会健.雌激素受体α的翻译后修饰与乳腺癌[J].生理科学进展,2012,(3):226-230.
[10]Tsai H W,Katzenellenbogen J A,Katzenellenbogen B S,et al.Protein kinase A activation of estrogen receptor alpha transcription does not require proteasome activity and protects the receptor from ligand-mediated degradation[J].Endocrinology,2004,145(6):2730-2738.
[11]Auricchio F,Migliaccio A,Castoria G.Sex-steroid hormones and EGF signalling in breast and prostate cancer cells:targeting the association of Src with steroid receptors[J].Steroids,2008,73(9-10):880-884.
[12]Skliris G P,Nugent Z J,Rowan B G,et al.A phosphorylation code for oestrogen receptor-alpha predicts clinical outcome to endocrine therapy in breast cancer[J].Endocr Relat Cancer,2010,17(3):589-597.
[13]程龙,黄翠芬,叶棋浓.乳腺癌中雌激素受体α表达水平调节的分子机制[J].遗传,2010,(3):191-197.
[14]Girault I,Bieche I,Lidereau R.Role of estrogen receptor alpha transcriptional coregulators in tamoxifen resistance in breast cancer[J].Maturitas,2006,54(4):342-351.
[15]Wei C,Cao Y,Yang X,et al.Elevated expression of TANKbinding kinase 1 enhances tamoxifen resistance in breast cancer[J].Proc Natl Acad Sci USA,2014,111(5):E601-610.
[16]Shah N,Jin K,Cruz L A,et al.HOXB13 mediates tamoxifen resistance and invasiveness in human breast cancer by suppressing ERalpha and inducing IL-6 expression[J].Cancer Res,2013,73(17):5449-5458.
[17]Zhang X,Wang Z Y.Estrogen receptor-alpha variant,ER-alpha36,is involved in tamoxifen resistance and estrogen hypersensitivity[J].Endocrinology,2013,154(6):1990-1998.
[18]Wang L H,Yang X Y,Zhang X,et al.Disruption of estrogen receptor DNA-binding domain and related intramolecular communication restores tamoxifen sensitivity in resistant breast cancer[J].Cancer Cell,2006,10(6):487-499.
