林蛙皮胶原蛋白的提取及其生物学特征分析
2015-11-29南雪单紫筠张迦南贾茜媛龙冬莹岳文裴雪涛
南雪 ,单紫筠,张迦南,贾茜媛,龙冬莹,岳文,裴雪涛
1.军事医学科学院 野战输血研究所干细胞与再生医学研究室,北京 100850;2.军事医学科学院 华南干细胞与再生医学研究中心,广东 广州 510005
胶原蛋白是白色、不透明、无支链的三螺旋纤维蛋白质,是结缔组织极其重要的结构蛋白质,起着支撑器官、保护机体的作用[1]。胶原蛋白可作为表皮细胞的迁移、增殖支架,促进皮肤细胞的增生修复和愈合[2];可促进骨的形成,增强低钙水平下的骨胶原结构[3-4];还可吸附肠道中的毒素和重金属,降低血清甘油三酯(TG)和胆固醇(TC)[5-6]等。随着干细胞与组织工程领域的飞速发展,胶原蛋白因其良好的组织相容性、较高的孔隙率以及可生物降解等多项优势,越来越多地被应用于组织工程皮肤、骨、软骨、心脏瓣膜等的构建[7-11]。
目前,胶原蛋白制品主要是从陆生脊椎动物如牛、猪、鸡等的皮肤、软骨、肌腱中提取。然而,近年来,由于疯牛病、口蹄疫、禽流感等动物传染性疾病全球肆虐,再加上部分国家与民族的宗教和习俗限制,人们开始寻求从低等脊椎动物和无脊椎动物中提取胶原蛋白[12-14]。研究表明,蛙皮中含有丰富的胶原蛋白,可作为胶原蛋白的一种潜在来源[3,6,15]。中国林蛙(Rana chensinensis)是林蛙油的主要提取原料,从废弃的林蛙皮中提取胶原蛋白,可以在充分利用废弃生物资源的同时开发出高附加值的产品,用于生物医药领域,具有重要的社会效益和经济效益。我们采用低温酸酶法结合提取林蛙皮胶原蛋白,在提高胶原蛋白提取率的情况下尽可能地保持所提取胶原蛋白的生物活性,并对其生物学特性进行初步探讨。
1 材料与方法
1.1 材料
林蛙皮粉(安图东北亚生物制品有限公司);胃蛋白酶(≥250 U/mg,Sigma-Aldrich 公司);TRIS、丙烯酰胺、N,N′-亚甲双丙烯酰胺、十二烷基磺酸钠、过硫酸铵、TEMED、甘氨酸(AMRESCO公司);氯胺T(三水·N-氯-对甲苯磺酰胺钠)、羟脯氨酸(东京化成工业株式会社);对二甲氨基苯甲醛、考马斯亮蓝R-250(国药集团化学试剂有限公司);蛋白质marker(Bio-Rad 公司);β-巯基乙醇(MP Biomedicals 公司);MSC 无血清培养基(北京三有利和泽生物有限公司);TrypLE Express(GIBCO 公司);CCK-8 试剂(株式会社同仁化学研究所);透析袋(截留相对分子质量为1000,上海绿鸟科技发展有限公司);96孔板(艾本德股份公司);醋酸、正丁醇、氢氧化钠、过氧化氢、氯化钠、磷酸二氢钠、一水柠檬酸、异丙醇等均为国产分析纯产品;实验用水均为超纯水。
Avanti J-26S XP高速低温离心机(贝克曼库尔特有限公司);SQP电子天平[赛多利斯科学仪器(北京)有限公司];BioSpectrometer fluorescence 分光光度计(艾本德股份公司);Christ Alpha 1-4 LSC 型冷冻干燥机(博劢行仪器有限公司);HBR4 数显加热锅(IKA 集团);3111型CO2培养箱[赛默飞世尔科技(中国)有限公司];Enspire 多模式微孔板检测系统(PerkinElmer 股份有限公司);小型垂直电泳槽、Gel Doc XR+凝胶成像系统(Bio-Rad公司)。
1.2 林蛙皮胶原蛋白的提取
1.2.1 预处理 称取15 g 新鲜林蛙皮粉,加到300 mL 0.1 mol/L的NaOH溶液(含过氧化氢0.025%)中进行脱色处理,持续慢速搅拌,每8 h 换液,直至离心上清接近无色。用10倍体积的蒸馏水(4℃)洗涤样品至中性。
将水洗至中性的林蛙皮样品按50 g/L的浓度加至10%的正丁醇溶液中进行脱脂处理,持续慢速搅拌48 h,每8 h换液。用10倍体积的蒸馏水(4℃)洗涤样品3次[13,16-18]。
在提取过程中,发现过氧化氢的加入量对胶原蛋白的提取率影响较大。为了进一步提高林蛙皮胶原蛋白的提取率,分别选取0、0.025%、0.1%、0.25%、1%、2.5%为过氧化氢加入量,以胶原蛋白总提取率为指标,对其进行考察。
1.2.2 酸溶性胶原蛋白(acid-solubilized collagen,ASC)的提取 将预处理后的林蛙皮样品按50 g/L的浓度加到0.5 mol/L 醋酸溶液中,持续慢速搅拌48 h,20 000 r/min离心60 min,收集上清液,置4℃备用。
1.2.3 酶溶性胶原蛋白(pepsin-solubilized collagen,PSC)的提取 取醋酸提取后的残留物按50 g/L的浓度分散于0.5 mol/L 醋酸溶液(含胃蛋白酶6.7 g/L)中,持续慢速搅拌24 h,20 000 r/min 离心60 min,收集上清液,以20 倍体积的0.02 mol/L Na2HPO4(pH7.2)为透析介质透析3 d,每12 h 换液一次以去除酶的活性,将透析液25 000 r/min 离心60 min,取沉淀溶于10倍体积的0.5 mol/L醋酸溶液中。第一次离心的沉淀再依次用含0.67%、1.34%、2%胃蛋白酶的醋酸溶液进行提取,处理方法同上。合并所得溶液,置4℃备用。
1.2.4 纯化 向所得ASC 与PSC 中加入NaCl 进行盐析,使NaCl 终浓度为0.9 mol/L。之后进一步用2.6 mol/L NaCl(0.05 mol/L Tris-HCl 液,pH7.5)沉淀胶原蛋白,20 000 r/min离心45 min,得沉淀。将沉淀溶解于10倍体积的0.5 mol/L醋酸溶液中,先以20倍体积的0.1 mol/L醋酸溶液为介质透析24 h,再以20 倍体积的蒸馏水为介质透析至pH 值为中性,每12 h换液一次。将透析后的溶液置于-20℃过夜预冻后,放入冻干机中真空冷冻干燥,得林蛙皮胶原蛋白成品[13,16-18]。
1.3 紫外光谱检测
将纯化的ASC 与PSC 用0.5 mol/L 醋酸溶液溶解,适当稀释,在215~400 nm间进行紫外扫描,以验证胶原蛋白的特征吸收[19]。
1.4 林蛙皮胶原蛋白的含量测定
采用对二甲氨基苯甲醛比色法测定试样中羟脯氨酸含量[20],从而推算出林蛙皮胶原蛋白的含量。
称取适量林蛙皮粉或其胶原蛋白提取物,加入30 mL 3 mol/L 硫酸溶液,于105℃消解16 h;趁热过滤至250 mL 容量瓶中,用水定容;移取4.00 mL上述溶液于比色管中,加入2.00 mL 氯胺T 试剂,混匀,于室温下放置20 min;加入2.00 mL显色剂于比色管中,混匀,封口,迅速放入60℃水浴中,加热20 min;取出比色管,用流动水冷却比色管至少3 min,在室温下放置30 min;以水作为参比,用紫外分光光度计测定D558nm值。羟脯氨酸标准溶液采用4-羟基-a-吡咯甲酸(羟脯氨酸),临用前配制,其标准工作液浓度依次为0.5、1.0、1.5、2.0 μg/mL。
1.5 相对分子质量分布测定
采用SDS-PAGE对所得林蛙皮胶原蛋白的相对分子质量分布进行分析[21-22],分离胶为8%,浓缩胶为5%。电泳结束后,用2.5 g/L的考马斯亮蓝R-250染色,醋酸与甲醇混合液脱色,对凝胶条带进行分析。
1.6 胶原蛋白对脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSC)生长的影响
1.6.1 UCMSC 的培养 取UCMSC,于37℃、CO2含量为5%且湿度饱和的CO2培养箱中,用MSC无血清培养基进行培养,待细胞长到80%左右时进行传代。
1.6.2 CCK-8 法检测胶原蛋白对UCMSC 增殖的影响 取对数生长期细胞,经胰酶替代物消化后,用无血清培养基稀释成细胞密度为1×105/mL 的单细胞悬液,接种于96 孔板中,每孔100 μL,设4 个复孔,在CO2培养箱中于37℃培养24 h;将胶原蛋白产物加入无血清培养基中,使终浓度为20 000 μg/mL,4℃浸提48 h;将浸提液依次用无血清培养基稀释成50、100、500、1000、、5000、10 000、15 000、20 000 μg/mL的溶液,将接种并培养了24 h的96孔板中的培养基弃去,依次加入不同浓度的胶原蛋白浸提液,每孔110 μL,再放入CO2培养箱培养24 或48 h;每孔加入10 μL CCK-8试剂,在CO2培养箱中于37℃孵育1 h,用酶标仪测定各孔的D值[10,23]。
为了进一步验证胶原蛋白对细胞生长的影响,将细胞按1×104/孔种入96 孔板后,将胶原蛋白加入α-MEM 培养基中,使终浓度为20 000 μg/mL,4℃浸提48 h;将浸提液依次用α-MEM 培养基稀释成50、100、1000、10 000 μg/mL的溶液,将接种并培养了24 h的96孔板中的培养基弃去,PBS洗涤2次,依次加入以上浓度的胶原蛋白浸提液,每孔110 μL,在CO2培养箱中培养24 或48 h;每孔加入10 μL CCK-8 试剂,在CO2培养箱中于37℃孵育2 h,用酶标仪测定各孔的D值。
1.7 数据统计与分析
2 结果
2.1 林蛙皮胶原蛋白的提取
根据GB/T 9695.23-2008 测定羟脯氨酸含量,绘制出羟脯氨酸标准曲线(图1),其标准曲线方程为y=0.202x-0.006,R2=0.9990。经考察,该方法精密度、稳定性、重复性等均符合要求,RSD均在2%以内,该方法适用于林蛙皮胶原蛋白含量的测定。
随着过氧化氢含量的提高,胶原蛋白的提取率逐渐下降,但其脱色效果越好(图2)。综合考虑脱色效果与胶原蛋白提取率,最终选取0.025%为过氧化氢浓度。
冻干后的成品为浅黄白色纤维状物质,具有三维孔状结构。其纯度与提取率计算公式如下:
式中,纯度为成品中胶原蛋白所占质量分数,C为消解液中羟脯氨酸的质量浓度,换算系数为0.1[15,24]。
经测定,ASC的提取率为8.77%±0.44%,纯度为75.83%±3.78%;PSC 的提取率为30.69%±0.83%,纯度为66.39%±1.79%;林蛙皮胶原蛋白总提取率为39.46%±1.15%。
2.2 紫外光谱检测
胶原肽链结构中含有的C=O、COOH 和CONH2都是生色基团,可以产生吸收[25]。胶原蛋白的特征吸收峰在230 nm左右[25]。图3为ASC和PSC的紫外扫描图谱,可知所得ASC和PSC的吸收峰分别为230和224 nm,符合胶原特征吸收规律。

图1 羟脯氨酸含量测定标准曲线
2.3 相对分子质量分布测定
对所提取的胶原蛋白样品进行聚丙烯酰胺凝胶电泳,结果见图4。在相对分子质量116×103附近有2 条相邻的分离带,此为天然胶原α链的分离带,分别代表α1 和α2 亚基[26]。而图谱中α1 条带的强度明显高于α2 条带,约为α2 条带强度的2 倍,因此推测所得胶原蛋白为含有2 条α1 链、1 条α2 链的Ⅰ型胶原[12]。在200×103附近的分离带为天然胶原的β链(α链的二聚体)[12,26]。电泳图谱表明所提取的胶原蛋白为保持了三股螺旋结构特征的胶原蛋白。
2.4 胶原蛋白对UCMSC增殖的影响
将细胞与不同浓度的胶原蛋白提取物浸提液分别孵育24、48 h 后检测细胞的存活情况,结果见图5。在0.05~20 mg/mL浓度范围,无论ASC还是PSC,无论是以MSC 无血清培养基还是以α-MEM 培养基作为浸提介质,其对UCMSC 的增长均无抑制作用,细胞存活率>83.86%,且部分浓度(如0.1 mg/mL)时胶原蛋白显现出了促进细胞生长的趋势。
3 讨论
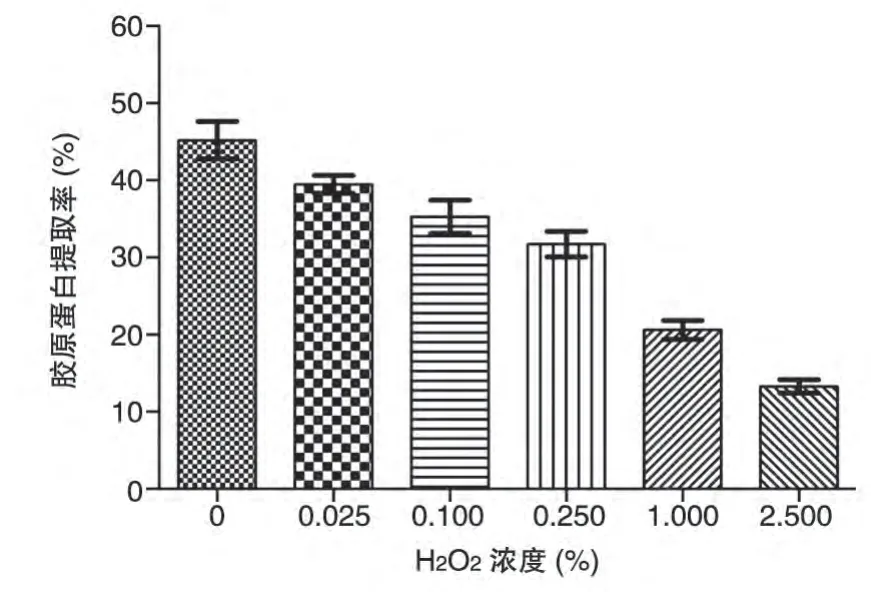
图2 过氧化氢含量对胶原蛋白提取率的影响

图3 ASC与PSC的紫外扫描图谱
迄今,国内外关于中国林蛙皮胶原蛋白的研究报道较少,如吕玲玲等应用木瓜蛋白酶在室温下提取林蛙皮胶原蛋白[6],王长周、张根生等在50℃提取林蛙皮胶原蛋白肽及残体胶原蛋白[3,27],郑淼、李琳琳等应用胃蛋白酶在37℃条件下提取林蛙皮胶原蛋白[15,24]。由于低等脊椎动物和无脊椎动物中胶原蛋白变性温度较低,一般低于猪皮胶原蛋白的变性温度37℃[28],有的甚至低达15℃[29-30],因此易发生胶原变性,不利于胶原蛋白生物活性的保持[4]。朱瑞霞等虽然在4℃用醋酸与胃蛋白酶提取了胶原蛋白,但是可能由于预处理不完全且提取参数有待进一步优化,其提取率较低[31]。鉴于此,本研究为获得具有生物活性的胶原蛋白,整个提取与纯化过程均在4℃条件下完成。在胶原蛋白提取过程中,由于胶原分子之间与分子内部会通过端肽区域的醛基缩合反应产生共价键进行交联,导致其在酸中的溶解度下降,所以林蛙皮不能完全溶于0.5 mol/L 的醋酸溶液,其ASC 得率较低,这一点与Jongjareonrak、Zhang 等的研究结果一致[12,21]。而胃蛋白酶可以在不损害三螺旋结构的情况下切断交联分子之间的端肽的交联作用,使三股螺旋结构的主体部分仍然保留并可溶解在酸中[12,21],所以限制性酶消化法可以提高胶原蛋白的提取率,更有效地得到活性蛋白。本研究通过低温酸酶提取相结合的方法,成功地从林蛙皮粉中提取了胶原蛋白,经初步测定,提取率高达39.46%±1.15%,且林蛙皮中胶原蛋白的质量分数达25.40%,与郑淼等26%的研究结果一致[15]。由于大部分蛋白质含有酪氨酸与色氨酸残基,在280 nm处有最大吸收[17];但胶原蛋白中酪氨酸残基含量低,其最大吸收波长在230 nm左右,这可能与胶原肽链结构中含有C=O、COOH 和CONH2等生色基团有关[17,25]。紫外光谱扫描结果与SDS-PAGE结果均表明所提取的胶原蛋白仍保持三股螺旋结构特征,为Ⅰ型胶原蛋白,具有较好的生物学活性。
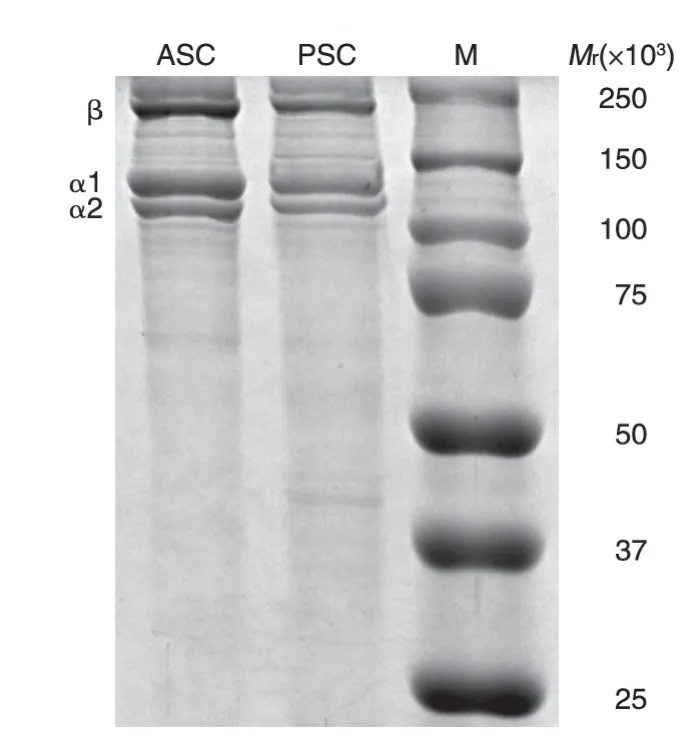
图4 ASC与PSC的电泳结果
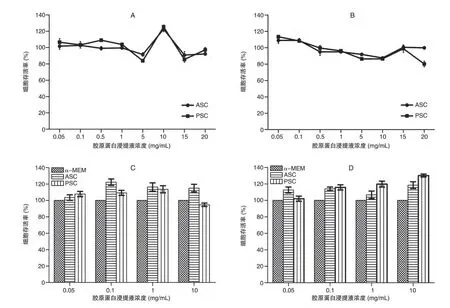
图5 不同浓度胶原蛋白浸提液对细胞生长的影响
胶原是细胞外基质的主要成分,有利于细胞的黏附、增殖和分化[32]。间充质干细胞是一类起源于中胚层的成体干细胞,可从骨髓、脂肪、胎盘、脐带血及脐带中分离纯化,具有自我更新、高度增殖和多向分化的潜能[33]。对UCMSC 增殖影响的实验结果表明,在0.05~20 mg/mL浓度范围,胶原蛋白提取物对细胞生长无明显抑制作用,且部分浓度显现出了促进细胞增殖的趋势,证明林蛙皮胶原蛋白可作为组织工程支架材料的潜在来源。
总之,林蛙皮相对于陆生脊椎动物的皮肤而言,其脂肪含量低、杂蛋白较少,利于胶原蛋白的精制,可以成为一种新的胶原蛋白来源。并且,对林蛙皮胶原蛋白的初步生物学性状研究表明,其具有良好的生物学活性与相容性,在组织工程、保健品以及化妆品领域均具有良好的应用前景。
[1]梁飞,左红梅.胶原和水解胶原蛋白的结构、性能和功效研究及应用前景[J].明胶科学与技术,2013,33(3):115-123.
[2]刘朝霞,陈海光,黄东雨.鱼皮胶原蛋白的提取及其应用[J].广东农业科学,2011,38(20):100-102.
[3]王长周,邱芳萍,房天琪,等.林蛙皮胶原蛋白肽的制备工艺[J].食品工业科技,2012,33(7):309-310.
[4]贾雪婷,孙佳明,张辉.从生物体中获得胶原蛋白的研究进展[J].吉林中医药,2013,33(10):1034-1035.
[5]张焕鹏.维吾尔医常用药材[M].乌鲁木齐:新疆卫生出版社,1992:347-348.
[6]吕玲玲,金香淑,施溯筠.林蛙皮胶原蛋白的提取及抗氧化性[J].食品研究与开发,2013,34(10):20-22.
[7]Wang F,Wang M,She Z,et al.Collagen/chitosan based twocompartment and bi-functional dermal scaffolds for skin regeneration[J].Mater Sci Eng C,2015,52:155-162.
[8]Tedder M E,Simionescu A,Chen J,et al.Assembly and testing of stem cell-seeded layered collagen constructs for heart valve tissue engineering[J].Tissue Eng Part A,2011,17(1-2):25-36.
[9]Gelse K,Pöschl E,Aigner T.Collagens-structure,function,and biosynthesis[J].Adv Drug Deliv Rev,2003,55(12):1531-1546.
[10]Song E,Yeon Kim S,Chun T,et al.Collagen scaffolds derived from a marine source and their biocompatibility[J].Biomaterials,2006,27(15):2951-2961.
[11]许繁,杨德圣.Bio-Gide 胶原膜对兔骨髓间充质干细胞增殖和成骨分化的影响[J].中国组织工程研究,2014,18(30):4797-4803.
[12]Jongjareonrak A,Benjakul S,Visessanguan W,et al.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper(Lutjanus vitta)[J].Food Chem,2005,93(3):475-484.
[13]Nagai T,Araki Y,Suzuki N.Collagen of the skin of ocellate puffer fish(Takifugu rubripes)[J].Food Chem,2002,78(2):173-177.
[14]Lee K J,Park H Y,Kim Y K,et al.Biochemical characterization of collagen from the starfish asterias amurensis[J].J Korean Soc Appl Biol Chem,2009,52(3):221-226.
[15]郑淼,周亚丹,赵敏.东北林蛙皮中胶原蛋白含量的测定及提取工艺[J].东北林业大学学报,2008,36(7):81-83.
[16]Nagai T,Suzuki N.Isolation of collagen from fish waste material-skin,bone and fins[J].Food Chem,2000,68(3):277-281.
[17]Zeng S,Zhang C,Lin H,et al.Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia(Oreochromis niloticus)[J].Food Chem,2009,116(4):879-883.
[18]Nagai T,Yamashita E,Taniguchi K,et al.Isolation and characterisation of collagen from the outer skin waste material of cuttlefish(Sepia lycidas)[J].Food Chem,2001,72(4):425-429.
[19]杨波,李国英.牛蛙皮中未变性Ⅰ型胶原蛋白的提取及性能表征[J].皮革科学与工程,2012,22(5):5-8.
[20]全国肉禽蛋制品标准化技术委员会.GB/T 9695.23-2008 肉与肉制品羟脯氨酸含量测定[S].北京:中国标准出版社,2008.
[21]Zhang M,Liu W,Li G.Isolation and characterisation of collagens from the skin of largefin longbarbel catfish(Mystus macropterus)[J].Food Chem,2009,115(3):826-831.
[22]夏其昌,张祥民,周仲驹,等.蛋白质电泳技术指南[M].北京:化学工业出版社,2007:2.
[23]倪旻,方翔,李全发,等.牛蛙皮胶原蛋白酸提取条件优化及其对细胞生长和粘附性的影响[J].激光生物学报,2012,21(4):379-384.
[24]李琳琳,鲍成伟,杨翔华,等.中国林蛙皮中胶原蛋白的提取研究[J].食品科技,2012,37(2):265-268.
[25]刘苏锐,王坤余,琚海燕.猪皮Ⅰ型胶原蛋白的提取及其结构表征[J].中国皮革,2007,36(7):43-46.
[26]付强,李国英,许燕.天然胶原高提取率的皮预处理方法的研究[J].中国皮革,2006,35(1):28-31.
[27]张根生,范爱月,韩冰,等.响应曲面法优化碱性蛋白酶提取林蛙残体胶原蛋白[J].食品科学,2011,32(2):93-97.
[28]Ikoma T,Kobayashi H,Tanaka J,et al.Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis niloticas[J].Int J Biol Macromol,2003,32(3):199-204.
[29]Jongjareonrak A,Benjakul S,Visessanguan W,et al.Isolation and characterisation of collagen from bigeye snapper(Priacanthus marcracanthus) skin[J].J Sci Food Agric,2005,85:1203-1210.
[30]Singh P,Benjakul S,Maqsood S,et al.Isolation and characterisation of collagen extracted from the skin of striped catfish(Pangasianodon hypophthalmus)[J].Food Chem,2011,124(1):97-105.
[31]朱瑞霞,施溯筠.冰乙酸和胃蛋白酶依次提取新鲜林蛙皮胶原蛋白[J].延边大学学报(自然科学版),2013,39(3):202-205.
[32]Sheu M T,Huang J C,Yeh G C,et al.Characterization of collagen gel solutions and collagen matrices for cell culture[J].Biomaterials,2001,22(13):1713-1719.
[33]王艳,张晋林,黄晓兵,等.脐带间充质干细胞研究现状与临床治疗[J].重庆医学,2013,42(18):2161-2163.
