一种用于检测恶性疟原虫的双环引物环介导等温扩增方法
2015-11-29吕沁风姜侃杨永耀何蕾罗鹏吴忠华
吕沁风,姜侃,杨永耀,何蕾,罗鹏,吴忠华
1.浙江国际旅行卫生保健中心,浙江 杭州 310003;2.浙江省质量监督检测研究院,浙江 杭州 310003
恶性疟是由恶性疟原虫感染引起的疟疾,目前高发于非洲和东南亚热带地区。根据WHO的报道,每年约有65 万人死于恶性疟,57%的非洲人口仍然生活在恶性疟流行的高发地区,在非洲南部恶性疟仍是住院的主要原因,同时给这些地区带来了沉重的经济负担[1-2]。恶性疟潜伏期为9~14 d,平均12 d;常见发冷、发热、出汗等症状,与重症流行性感冒相似;发作周期一般为36~48 h。免疫力低下人群,如未及时治疗或治疗不当易发展为重症疟疾,甚至脑型疟而死亡。国内目前恶性疟主要来源于输入性感染,且存在疟疾的传播媒介按蚊,开发快速检测方法,对恶性疟的防治具有重要的意义。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)是一种新型核酸扩增技术,该方法针对靶基因的6 个区域设计4 种引物,在等温条件60℃~65℃下利用Bst聚合酶即可进行109~1010倍的核酸扩增[3-4]。LAMP 产物通过浊度或荧光变化可用肉眼观察,具有操作简便、特异性强、灵敏度高等优点[5-6]。自2000 年问世以来,LAMP 技术在病原体检测、疾病诊断等领域得到广泛应用[7-10]。目前,如何在现有LAMP 技术的基础上发掘更高效快速的等温扩增方法,成为重要的研究方向。最快速的LAMP反应方法就是加入环引物[11-12]。本研究的目的在于缩短等温扩增的反应时间,达到比加入环引物更快的扩增效率:把LAMP 的环引物由1 对增加至2 对,在进行等温扩增反应时,2 对环引物能同时和反应回环的产物进行贴合,亦即在退火的同时启动了再回环的扩增,从而增加了反应进程,缩短反应时间,达到快速检测的目的。
1 材料与方法
1.1 材料
2011~2014 年口岸截获的疟疾感染者全血标本为本室保存。
DNA 提取试剂盒和胶回收试剂盒购自QIAGEN公司;BstDNA 聚合酶购自NEB 公司;ExTaq酶、dNTP、DL2000 DNA marker、琼脂糖凝胶购自TaKa-Ra 公司;MgSO4和甜菜碱为Sigma-Aldrich 公司产品;EvaGreen 购自Biotium 公司;2720 型PCR 仪购自ABI公司;Chromo 4型荧光定量PCR仪、电泳仪购自BIO-RAD公司。
1.2 引物设计
常规LAMP 技术含有1 对外引物、1 对内引物,选择加入1 对环引物,可在等温条件下进行核酸扩增。本研究根据恶性疟原虫18S rRNA 基因保守区设计了 一组引 物[13-14],分别为F3、B3、FIP、BIP、fLoop1、fLoop2、bLoop1 和bLoop2,第2 对环引物的加入,使等温扩增回环的速率增加,从而缩短反应的时间。引物序列见表1。
1.3 恶性疟原虫DNA的提取
严格按QIAGEN DNA 抽提试剂盒说明书提取DNA,-20℃保存。
1.4 反应体系及反应条件
快速LAMP 反应体系:10×缓冲液2.5 μL,引物混合 物1 μL(F3、B3 各1 μmol/L,FIP、BIP 各15 μmol/L,fLoop1、fLoop2 各5 μmol/L,bLoop1、bLoop2各15 μmol/L),模板DNA 1 μL,8 UBstDNA 聚合酶1 μL,甜菜碱(8 mol/L)2 μL,dNTP(10 mmol/L)2 μL,MgSO4(100 mmol/L)1.2 μL,1.25 μL 20×的EvaGreen,加入灭菌双蒸水补足25 μL。
加入环引物的LAMP 引物混合物为F3、B3 各1 μmol/L,FIP、BIP 各15 μmol/L,fLoop1、fLoop2 各5 μmol/L,其他成分与双环引物LAMP一致。
反应条件:63℃ 55 s,荧光采集5 s,100 个循环。反应在荧光定量PCR仪中进行。
1.5 灵敏度试验
以DNA 为模板,用PCR 混合引物进行扩增,将PCR 产物纯化回收试剂盒进行纯化回收,对纯化后的PCR产物测定D260nm值,根据产物长度和D260nm值计算拷贝数,将产物以1/10 梯度稀释,最终稀释到1×100拷贝/μL。分别取1 μL 作为模板加入反应体系中,在63℃恒温条件下反应60 min。在荧光定量PCR 仪上观察实时荧光反应曲线,反应结束后进行65℃到95℃溶解曲线试验,每增加1℃保温30 s,检测荧光强度,试验结束后取2 μL 反应产物进行10 g/L琼脂糖凝胶电泳,同时用外引物进行PCR反应检测灵敏度。
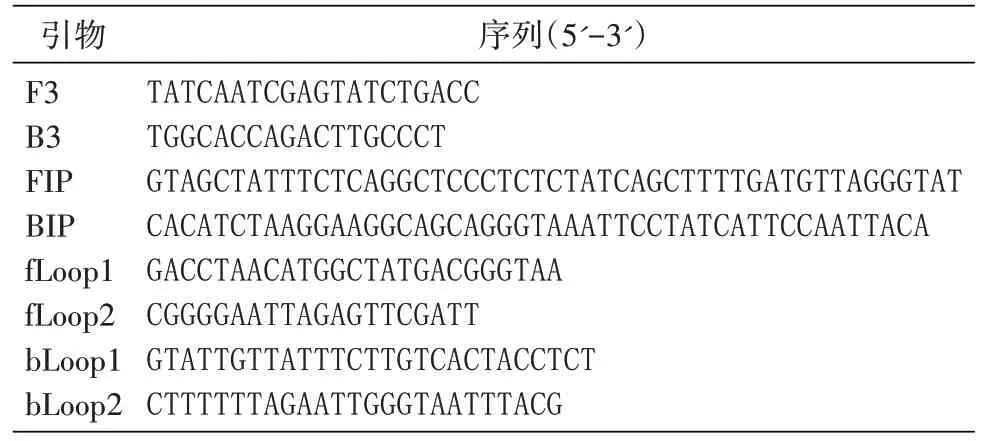
表1 恶性疟原虫快速LAMP扩增引物
1.6 特异性试验
同时提取间日疟、卵形疟和三日疟等感染者全血核酸,同时用双环LAMP方法进行检测。
1.7 重复性试验
根据灵敏度试验结果,选择阴性、1×100拷贝/μL和1×106拷贝/μL 浓度的cDNA 模板分别进行快速LAMP,每份样本各取1 μL 重复3 次,采用实时荧光定量PCR 仪进行检测,观察反应的Ct 值,根据Ct 值计算变异系数,对该方法的重复性进行考核。
1.8 样本检测
采用该方法对全省口岸送检的29 例全血标本及30例健康体检者全血标本进行检测,观察结果。
2 结果
2.1 灵敏度试验结果
在荧光定量PCR 仪上观察实时荧光反应,结果见图1;取2 μL 反应产物进行10 g/L 琼脂糖凝胶电泳,结果见图2,1~5 泳道均出现细密的阶梯状条带,表示有阳性扩增反应。可以判定本方法的检测极限约为1×101拷贝/μL。PCR 灵敏度试验结果见图3,可见检测限为1×102拷贝/μL。经比较双环引物LAMP 检测方法的灵敏度比PCR 法高一个数量级。溶解曲线试验结果见图4,可见每个不同浓度的产物溶解曲线温度都在同一点上。
2.2 特异性试验结果
采用恶性疟快速LAMP 方法进行检测,电泳反应结果见图5,恶性疟出现与普通LAMP 反应相同的的阶梯状条带。此外,阴性对照、间日疟、卵形疟、三日疟核酸的检测结果均为阴性,由此显示了该方法具有很好的特异性。
2.3 重复性试验结果
根据实时荧光LAMP 的结果,记录各次试验的Ct 值。根据Ct 值计算SD值及变异系数(CV),结果见表2,强阳性及临界值样本的CV值均小于5%,重复性良好。
2.4 2种扩增方法的反应时间比较
根据实时荧光检测结果可见,快速LAMP 的反应时间最快可达15 min 左右,加入环引物的LAMP反应时间为25 min左右。实时荧光检测见图6。
2.5 临床样本检测
采用快速LAMP 技术进行检测,发现29 例口岸送检本实验室的样本中有8 例恶性疟阳性,与荧光定量PCR 检测结果相符。30 例健康体检者检测结果全部为阴性。
3 讨论
环介导等温扩增技术由于操作简单、不需要昂贵的专用实验仪器、反应在1~1.5 h 内完成、灵敏度高,而吸引了大量研究力量投入该领域的研究。我们改进的方法缩短了检测时间,在实际检测应用中和定量PCR 检测结果相符,证明本检测方法具有应用价值。但2对环引物设计比1对引物设计要困难,对于扩增片段太短和能设计引物的位置太少的核酸检测并不适合。对能设计双环引物的LAMP 扩增来说,能不能真正提高扩增效率需要通过大量实验进行验证。

图1 恶性疟原虫双环引物LAMP灵敏度检测实时荧光结果

图2 恶性疟原虫双环引物LAMP产物电泳结果
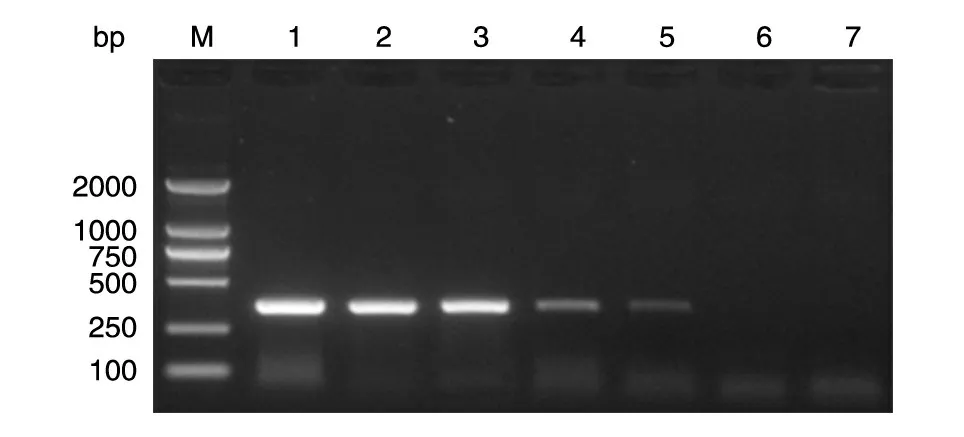
图3 恶性疟原虫PCR产物电泳结果

表2 恶性疟原虫双环引物LAMP重复性实验结果

图4 恶性疟原虫双环引物LAMP产物溶解曲线试验

图5 双环引物LAMP特异性试验结果
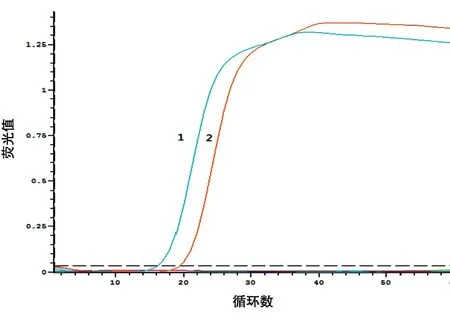
图6 双环引物和环引物扩增速度比较
[1]Maitland K.Management of severe paediatric malaria in resource-limited settings[J].BMC Med,2015,13:42.
[2]Cox-Singh J,Davis T M,Lee K S,et al.Plasmodium knowlesi malaria in humans is widely distributed and potentially life threatening[J].Clin Infect Dis,2008,46(2):165-171.
[3]Notom T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acid Res,2000,28(12):e63.
[4]Nagamine K,Watanabe K,Ohtsuka K,et al.Loop-mediated isothermal amplification reaction using a nondenatured template[J].Clin Chem,2001,47:1742-1743.
[5]Goto M,Honda E,Ogura A,et al.Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxyl naphthol blue[J].Biotechniques,2009,46(3):167-172.
[6]Mori Y,Nagamine K,Tomita N,et al.Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J].Biochem Biophys Res Commun,2001,289(1):150-154.
[7]Lyu Q F,Chen Y,Zheng W,et al.Establishment of a reserve transcription loop-mediated isothermal amplification method for Yellow fever virus[J].Microbiol China,2014,41(1):184-190.
[8]Zhao Z,Fan B,Wu G,Yan X,et al.Development of loop-mediated isothermal amplification assay for specific and rapid detection of differential goat pox virus and sheep pox virus[J].BMC Microbiol,2014,14:10.
[9]Su J,Liu X,Cui H,et al.Rapid and simple detection of methicillinresistance staphylococcus aureus by orfX loop-mediated isothermal amplification assay[J].BMC Biotechnol,2014,14:8.
[10]Tomita N,Mori Y,Kanda H,et al.Loop-mediated isothermal amplification(LAMP) of gene sequences and simple visual detection of products[J].Nat Protoc,2008,3(5):877-882.
[11]Nagamine K,Hase T,Notomi T.Accelerated reaction by loopmediated isothermal amplification using loop primers[J].Mol Cell Probes,2002,16(3):223-229.
[12]Ihira M,Yoshikawa T,Enomoto Y,et al.Rapid diagnosis of human herpesvirus 6 infection by a novel DNA amplification method,loop-mediated isothermal amplification[J].J Clin Microbiol,2004,42(1):140-145.
[13]Oriero C E,van Geertuyden J P,Jacobs J,et al.Validation of an apicoplast genome target for the detection of Plasmodium species using polymerase chain reaction (PCR) and loop mediated isothermal amplification(LAMP)[J].Clin Microbiol Infect,2015,21(7):686.e1-686.e7.
[14]Pakalapati D,Garg S,Middha S,et al Comparative evaluation of microscopy,OptiMAL and 18S rRNA gene based multiplex PCR for detection of Plasmodium falciparum &Plasmodium vivax from field isolates of Bikaner,India[J].Asian Pac J Trop Med,2013,6(5):346-351.
