结核分枝杆菌抗体双抗原夹心ELISA 检测方法的建立及初步应用
2015-11-29蒋纾芳郭兰芹宗克亮杨锡琴刘志强赵照修冰水段翠密陈堃张旭辉张嵘冯晓燕张贺秋
蒋纾芳 ,郭兰芹,宗克亮,杨锡琴,刘志强,赵照,修冰水,段翠密,陈堃,张旭辉,张嵘,冯晓燕,张贺秋
1.军事医学科学院 基础医学研究所,北京 100850;2.沈阳药科大学,辽宁 沈阳 110016;3.华北石油总医院,河北 任丘 062552;4.风帆集团 职工医院,河北 保定 071000;5.首都师范大学 数学科学学院,北京 100148
结核病(tuberculosis,TB)是一种由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的严重危害人类健康的呼吸道传染病,是全球性的重大公共卫生问题和社会问题[1]。据世界卫生组织统计,全世界每年约300 万人死于TB,是造成死亡人数最多的单一传染病。我国是全世界22 个TB 高负担国家之一,患者人数仅次于印度而位居全球第二,这说明我国TB流行趋势严峻,不可小觑[2]。流动人口增加、免疫力下降、耐药性菌株的出现,以及艾滋病共感染等因素,加速了结核病的感染复发与进一步流行。
酶联免疫测定技术(ELISA)是以免疫学反应为基础,将抗原-抗体的特异性反应与酶和底物的高效催化作用相结合的一种敏感性很高的技术。临床上常用间接ELISA法检测TB患者血清中的IgG抗体水平,但IgG 抗体出现较晚,对TB 的早期感染会产生漏检,血清中非特异性物质的吸附干扰也会导致假阳性结果出现。研究表明[3],同时使用间接ELISA 法检测TB 患者血清中的IgG、IgM 和IgA 抗体可显著提高阳性检出率,但联合检测费用较单一检测高,增加了患者的经济负担。为了改进Mtb 血清学诊断方法,我们建立了2种检测抗Mtb总抗体的双抗原夹心ELISA 法,即辣根过氧化物酶(HRP)标记组双抗原夹心ELISA 和生物素标记组双抗原夹心ELISA(以下简称HRP-ELISA 法和Bio-ELISA 法),并利用临床患者样本初步评价了2种方法的临床应用价值。
1 材料与方法
1.1 材料
所有血清均来自北京市朝阳区疾病预防控制中心,全部为临床新近诊断的活动性肺结核患者,未合并感染人免疫缺陷病毒(HIV),未接受抗结核治疗;阴性对照组来自健康体检者。
融合抗原38kD+ESAT6+CFP10(以下简称38+6+10)为本室构建并保存;HRP 购自Sigma 公司;生物素购自Thermo公司;SA-HRP购自VECTOR公司;NaIO4、NaBH4、DMSO、丙三醇、硫酸均为国产分析纯产品;SM-3 型自动化酶免分析仪、ZMX-988B 型自动化酶免洗板机均为北京天石天力医疗器械有限公司产品;CU420 型电热恒温水箱为上海一恒科技有限公司产品;96 孔酶联板为厦门怡佳美实验器材有限公司产品。
1.2 HRP标记融合抗原38+6+10
将1 mL 5 mg/mL 融合抗原装入透析袋,用0.01 mol/L 碳酸盐缓冲液(pH9.5)1000 mL 于4℃透析48 h;取5 mg HRP 溶于0.5 mL 去离子水;加0.5 mL 0.06 mol/L NaIO4,室温下避光轻搅20 min,液体呈黄绿色;加0.5 mL 0.16 mol/L 乙二醇,室温下避光轻搅30 min,终止氧化反应;装入透析袋,用0.01 mol/L 碳酸盐缓冲液(pH9.5)1000 mL 于4℃透析过夜;将透析后的酶标抗原倒入棕色小瓶,加入0.2 mL 5 mg/mL NaBH4,4℃稳定2 h 后,加等量的甘油,小量分装,低温保存备用。
1.3 生物素标记融合抗原38+6+10
将1 mL 2 mg/mL 的融合抗原装入透析袋,用0.01 mol/L 碳酸盐缓冲液(pH9.5)1000 mL 于4℃透析48 h;加10 μL 用20 μg/μL DMSO 溶解的生物素,室温稳定1~2 h;装入透析袋,用0.02 mol/L PBS缓冲液(pH7.4)1000 mL 于4℃透析过夜;小量分装,低温保存备用。
1.4 双抗原夹心ELISA法的优化
采用5份健康对照和6份不同反应强度的TB 患者血清样本,对融合抗原包被浓度以及标记抗原稀释率进行优化,分别计算TB患者血清平均吸光度值P,健康对照血清平均吸光度值N,选择最大P/N 值所对应的反应条件作为最佳反应条件。ELISA 法的具体优化步骤如下:
①将融合抗原38+6+10 用包被液稀释至2、1、0.5 和0.25 μg/mL,100 μL/孔包被96 孔酶联板,4℃过夜;②洗板2 次后拍干,110 μL/孔加入封闭液,室温封闭8 h 后弃液拍干;③100 μL/孔加入血清样本原液,37℃孵育30 min;④洗板5 次后拍干,100 μL/孔加入1∶500 稀释的HRP-38+6+10,37℃孵育20 min(Bio-ELISA 法的此步为:100 μL/孔加入1∶2000稀释的Bio-38+6+10,37℃孵育30 min,洗板5 次后拍干,100 μL/孔加入1∶1000 稀释的SA-HRP,37℃孵育20 min);⑤洗板5 次后拍干,加入TMB 显色液A 和B 各50 μL/孔,37℃避光显色10 min;⑥50 μL/孔加入1 mol/L 硫酸,用酶标仪读取D450nm和D620nm值,分别比较4 组不同抗原包被浓度的P/N 值,选择P/N较大者作为最佳抗原包被浓度;⑦用已确定的最佳抗原包被浓度包被酶联板,将待检血清与样品稀释液的加样量分别按比例10+90、20+80、30+70、40+60和100 μL血清原液加入酶联板各孔中,其他反应条件相同,按上述步骤进行检测,分别比较5 组不同样品稀释率的P/N值,选择P/N值较大者作为最佳样品稀释率;⑧用已确定的最佳抗原包被浓度包被酶联板,并用所确定的样品稀释率加样后,将HRP-38+6+10 按1∶500、1∶1000 稀释,将Bio-38+6+10 按1∶2000、1∶4000 稀释,其他反应条件相同,按上述步骤进行检测,分别比较2组不同标记抗原稀释率的P/N值,选择P/N值较大者作为最佳标记抗原稀释率。
1.5 已建立双抗原夹心ELISA法的初步应用
用最佳反应条件建立的HRP-ELISA 法和Bio-ELISA法检测血清样本,根据检测结果计算2种检测方法的灵敏度、特异性、P/N值和AUC。
1.6 统计学方法
应用SPSS 17.0 和GraphPad Prism 6 统计分析软件对数据进行统计学分析。分析结果中P 为TB患者的平均吸光度值,N 为健康人的平均吸光度值;AUC 表示受试者工作特征曲线下的面积,该值越大且越接近于1即表明该方法的诊断效能越好。
2 结果
2.1 最佳反应条件的确定
2.1.1 融合抗原包被浓度的确定 将融合抗原按不同包被浓度进行包被,其他条件相同下进行ELISA检测,结果见表1、2。HRP-ELISA 法和Bio-ELISA法的融合抗原分别按2、0.25 μg/mL 包被时得到的P/N值最高,为各自的最佳包被浓度。
2.1.2 样品稀释率的确定 用已确定的最佳抗原包被浓度包被酶联板后,将待检血清与样品稀释液的加样量分别按不同比例加入酶联板各孔中,其他条件相同下进行ELISA 检测,结果见表3、4。HRPELISA法和Bio-ELISA法均在加入100 μL血清原液时得到的P/N值最高,为各自的最佳样品稀释率。
2.1.3 标记抗原稀释率的确定 用已确定的包被浓度进行包被,并用所确定的样品稀释率加样后,将标记抗原按不同稀释率进行稀释,其他条件相同下进行ELISA检测,结果见表5、6。HRP-ELISA 法 和Bio-ELISA 法分别按1∶500、1∶2000 稀释时得到的P/N值最高,为各自的最佳标记抗原稀释率。
2.2 对血清样本的检测结果
用所确定的最佳反应条件对71 份TB 患者和90份健康对照血清的检测结果见表7,HRP-ELISA 法和Bio-ELISA 法的散点图和ROC 曲线见图1。Bio-ELISA 法的临界值为0.044,显著低于HRP-ELISA法,灵敏度 为52.11%、P/N 值 为74.42、AUC 为0.9746,均显著高于HRP-ELISA 法。HRP-ELISA 法和Bio-ELISA 法的TB 患者抗体水平均显著高于健康对照,差异具有统计学意义(均为P<0.0001)。

表1 HRP-ELISA法融合抗原包被浓度的选择

表2 Bio-ELISA法融合抗原包被浓度的选择

表3 HRP-ELISA法样品稀释率的选择

表4 Bio-ELISA法样品稀释率的选择
3 讨论
生物素-亲合素系统(biotin-avidin system,BAS)是20 世纪70 年代后期应用于免疫学,并得到迅速发展的一种新型生物反应放大系统。它具有多级放大效应,并与荧光素、酶、放射性核素等免疫标记技术有机地结合,使各种示踪免疫分析的特异性和灵敏度进一步提高,已经广泛应用于生物医学研究的各个领域。生物素广泛分布于动、植物组织中,在机体内以辅酶形式参与各种羧化酶反应,故又称为辅酶R或维生素H。它有2个环状结构,分别为咪唑酮环(与亲合素结合的主要部位)和噻吩环(其末端羧基是结合抗体和其他生物大分子的惟一结构)。链霉亲合素(streptavidin,SA)和生物素之间的亲和力极强,一个SA 分子可以结合4 个生物素分子,二者的亲和常数为1015/mol,比抗原与抗体的亲和力至少高1 万倍[4]。因此二者能快速结合且反应不易受外界干扰,具有高度特异性和稳定性,所以在实际应用中BAS的精确度较高、操作误差较小。
本研究中所用的抗原是由本实验室已构建、表达和纯化的高活性融合抗原38+6+10,包含38kD 抗原、ESAT6和CFP10的优势表位抗原区段,在先前建立的间接ELISA 法结核IgG 抗体检测技术中已证明该融合抗原具有较好的灵敏度和特异性[5]。其中38kD 是一种磷酸盐转运蛋白,参与磷盐的代谢,是Mtb 的主要抗原,因此用于TB 血清学诊断检测的灵敏度和特异性均较高。它只在分枝杆菌复合体中表达,且卡介苗(BCG)合成38kD 蛋白的量只有Mtb 的1/10,是目前最为常用的TB 诊断抗原之一。同时,它是最早发展用于商业化诊断试剂盒的抗原,对活动性肺结核的诊断效果较好[6]。ESAT6 是一种主要的Mtb 分泌蛋白,具有良好的抗原性。1996 年Harboe 等通过PCR、Southern 杂交和免疫印迹分析,从基因和蛋白水平上揭示ESAT6仅存在于致病性分枝杆菌(如Mtb、牛分枝杆菌)中,而不存在于BCG 及其他非致病分枝杆菌中[7]。CFP10 基因位于ESAT6 基因的上游,以单拷贝的形式分布于相同的分枝杆菌中,在BCG 所有菌株中不存在。它与ESAT6 约有40%的同源性,且具有相同的免疫学特性[8],能够刺激机体产生特异性细胞免疫应答。同时,CFP10 蛋白具有与天然蛋白相同的抗原性,可诱发结核菌素试验阳性者的外周血单核细胞中出现增殖反应并产生较ESAT6分泌水平高的IFN-γ。根据其BCG缺失的特点,ESAT6-CFP10 蛋白已成为目前应用最为广泛的诊断用抗原[9-10]。
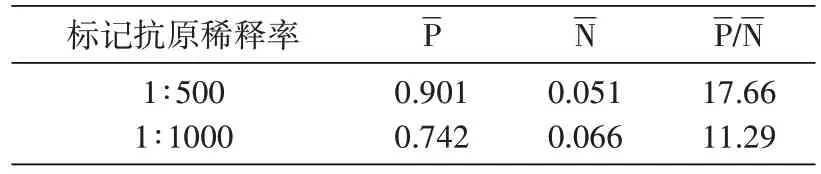
表5 HRP-ELISA法标记抗原稀释率的选择

表6 Bio-ELISA法标记抗原稀释率的选择
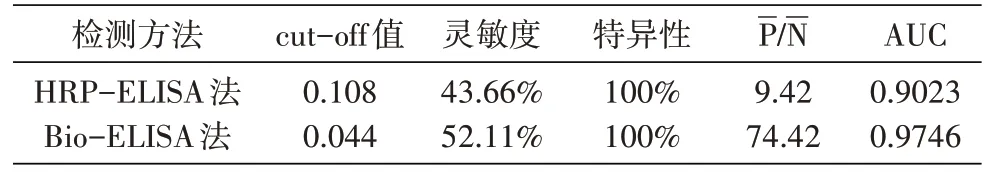
表7 HRP-ELISA法和Bio-ELISA法对血清标本的检测结果

图1 HRP-ELISA法和Bio-ELISA法的散点图(A)和ROC曲线(B)
我们使用HRP 和生物素标记融合抗原,其后经过一系列反应条件的优化,建立了2种Mtb双抗原夹心ELISA 法,分别为HRP-ELISA 法和Bio-ELISA法,所确定的最佳抗原包被浓度依次为2和0.25 μg/mL,最佳样品稀释率均为100 μL 血清原液,最佳标记抗原稀释率数依次为1∶500和1∶2000。用建立的抗体检测方法对71份TB 患者和90份健康对照血清进行初步临床应用,比较分析后发现Bio-ELISA 法的灵敏度、P/N 值和AUC 均显著高于HRP-ELISA法,这是因为生物素标记的蛋白具有多价性,且标记后的抗原生物活性不变,而每个SA 有4 个生物素结合位点,可同时以多价形式结合到生物素化大分子衍生物和标志物上,因此BAS 具有多级放大作用。虽然2 种方法的特异性均为100%,但Bio-ELISA 法的P/N 值(74.92)显著大于HRP-ELISA 法(9.42),且Bio-ELISA 法的AUC 值也高于HRP-ELISA 法,表明Bio-ELISA 法区分阴性和阳性样本的能力显著高于HRP-ELISA法,试剂的检测性能更好。
综上所述,本研究建立的2种双抗原夹心ELISA法均适用于TB 的临床辅助诊断,其中Bio-ELISA 法的诊断性能明显优于HRP-ELISA 法,更加适合用于TB的临床辅助诊断。
[1]陈静.结核病的预防与治疗[J].基层医学论坛,2015,19(3):359-360.
[2]邵传贤.远离结核病,首选良方是预防[J].医生谈疾病预防,2015,3:20-21.
[3]Feng Xiaoyan,Yang Xiqin,Xiu Bingshui,et al.IgG,IgM and IgA antibodies against the novel polyprotein in active tuberculosis[J].BMC Infect Dis,2014,14:336.
[4]沈关心,周汝麟.现代免疫学实验技术[M].2版.石家庄:河北科学技术出版社,2002:178-180.
[5]冯晓燕,陈堃,宋晓国,等.结核分枝杆菌抗原优势肽段融合抗原38kD+ESAT6+CFP10构建与抗原性初步检测[J].中国实验诊断学,2009,13(3):285-288.
[6]张欣,张荣波.结核分枝杆菌抗原诊断研究进展[J].中国人兽共患病学报,2006,22(12):1164-1165.
[7]Lincoln E M,Sordillo V R,Davies P A.Tuberculous meningitis in children:a review of 167 untreated and 74 treated patients with special reference to early diagnosis[J].Pediatric,1960,57:807-823.
[8]Colangeli R,Spencer J S,Bifani P,et al.MTBSA-10,the product of the Rv3874 gene of Mycobacterium tuberculosis,elicites tuberculosis-specific,delayed-type hypersensitivity in guinea pigs[J].Infect Immun,2000,68(2):990-993.
[9]霍霏霏,张丽帆,刘晓清.评价Y 干扰素释放分析T-SPOT.TB在肺外结核病诊断中的敏感性[J].中国医学科学院学报,2009,31(4):449-452.
[10]Stephan C,Wolf T,Goetsch U,et al.Comparing QuantiFERON-tuberculosis gold,T-SPOT tuberculosis and tuberculin skin test inHIV-infected individuals from a low prevalence tuberculosis country[J].AIDS,2008,22(18):2471-2479.
