H-Ras结构域的原核表达及纯化
2015-11-29冯滢滢张云静徐小洁李玲郭靖洪甜张蓉赵克叶棋浓
冯滢滢 ,张云静,徐小洁,李玲,郭靖,洪甜,张蓉,赵克,叶棋浓
1.第二炮兵总医院 肛肠科,北京 100088;2.军事医学科学院 生物工程研究所,北京 100850
H-Ras 基因首先从人膀胱癌细胞系中被发现,由Der等[1]分离得到。它位于人类第11号染色体,与K-Ras、N-Ras 共同组成Ras 家族。Ras 蛋白属于小G 蛋白,通过参与细胞信号转导而调控细胞分化与增殖[2]。Ras 癌基因与人类肿瘤细胞的发生与发展密切相关。H-Ras癌基因正常时可调控细胞生长路径,发生异常时可导致细胞持续生长以至癌变[3]。因此,探讨Ras 基因对研究部分肿瘤的发生与发展具有重要意义。
Ras 基因编码相对分子质量约21×103的蛋白,又称p21 蛋白或Ras 蛋白[4]。H-Ras、K-Ras、N-Ras的氨基酸序列有85%的同源性,N端1~165位氨基酸残基高度保守,165~189/188位氨基酸残基存在高度差异,从而导致其功能的差异[5]。研究发现,K-Ras、N-Ras、H-Ras 在不同肿瘤细胞系中的表达不同,其功能也不尽相同。基于此认识,我们拟将H-Ras 基因片段化,分别构建H-Ras(1-165)和H-Ras(165-189)的原核表达载体,为下一步深入研究H-Ras 基因奠定基础。
1 材料和方法
1.1 材料
大肠杆菌DH5α、Rossate,原核表达载体pGEXKG,质粒Myc-H-Ras由军事医学科学院生物工程研究所保存;限制性核酸内切酶BamHⅠ和XhoⅠ、T4DNA 连接酶购自TaKaRa 公司;GST-Sepharose 4B购自Pharmacia 公司;引物由北京赛百盛生物技术公司合成;测序由北京奥科生物技术有限责任公司完成。
1.2 人H-Ras(1-165)和H-Ras(165-189)编码区基因的扩增
以人Myc-H-Ras 质粒为模板,根据文献报道的人H-Ras(1-165)序列合成上游引物(5'-CGGGAT CCATGACGGAATATAAGCTGGTGGTG-3')和下游引物(5'-CCGCTCGAGTCACTGCCGGATCTCACGC ACCAAC-3'),按以下条件扩增H-Ras(1-165)编码区:95℃ 5 min;95℃ 30 s,58℃ 60 s,72℃ 30 s,30个循环;72℃延长7 min。
以人Myc-H-Ras 质粒为模板,根据文献报道的人H-Ras(165-189)序列合成上游引物(5'-CGGGA TCCCACAAGCTGCGGAAGCTGAAC-3')和下游引物(5'-CCGCTCGAGTCAGGAGAGCACACACTTGCAG C-3'),按以下条件扩增H-Ras(165-189)编码区:95℃5 min;95℃30 s,58℃60 s,72℃20 s,30 个循环;72℃延长7 min。
1.3 重组表达质粒的构建、鉴定
用BamHⅠ和XhoⅠ双酶切pGEX-KG 载体,经10 g/L 琼脂糖凝胶电泳后,胶回收载体大片段;将PCR 片段回收后再用BamHⅠ和XhoⅠ双酶切,形成带有黏端的双链,用T4DNA 连接酶连接入pGEXKG 载体,转化大肠杆菌DH5α,挑选克隆,培养并提质粒,用BamHⅠ和XhoⅠ双酶切鉴定,酶切鉴定正确的克隆送北京奥科生物公司测序。
1.4 融合蛋白GST-H-Ras(1-165)、GST-H-Ras(165-189)在大肠杆菌中的小量诱导表达及鉴定
将鉴定正确的重组表达质粒转化大肠杆菌Rossate 感受态细胞,挑取菌落,37℃振荡培养至D600nm为0.6~1.0,加入IPTG 至终浓度为1 mmol/L,37℃继续培养4 h,离心收集菌体,进行Western印迹检测。
1.5 融合蛋白GST-H-Ras(1-165)、GST-N-Ras(165-189)的纯化与洗脱
将含pGEX-KG-H-Ras(1-165)、pGEX-KG-HRas(165-189)和pGEX-KG 的大肠杆菌Rossate 分别接种于含氨苄西林的LB 液体培养基中,37℃振荡培养过夜活化,按10%的比例转种于同种液体培养基中,30℃振荡培养至D600nm为0.4~0.6,加入IPTG 至终浓度为0.1 mmol/L,20℃继续培养16 h,离心收集菌体,按Pharmacia 公司提供的方法进行GST 融合蛋白的纯化:加入裂解液,超声波破碎,收集上清,加入适量GST-Sepharose 4B 结合4 h,离心收集GST-Sepharose 4B 小颗粒,充分洗脱未结合蛋白质,用还原性谷胱甘肽小量多次地将GST-H-Ras(1-165)、GST-H-Ras(165-189)从珠子上逐渐洗脱,最后以SDS-PAGE鉴定纯化与洗脱的蛋白。
2 结果
2.1 人H-Ras(1-165)和(165-189)编码区基因的克隆
以Myc-H-Ras 质粒为模板扩增H-Ras(1-165)和H-Ras(165-189)的编码区,获得大小分别约为500和100 bp的PCR产物,与预期一致(图1)。
2.2 重组表达载体的构建与鉴定
将2 种PCR 产物用BamHⅠ和XhoⅠ双酶切后分别与经相同双酶切的pGEX-KG载体连接,转化大肠杆菌DH5α,挑选阳性克隆提质粒,经酶切鉴定,凝胶电泳可分别见约500 和100 bp 的条带(图2),表明H-Ras(1-165)、H-Ras(165-189)基因的编码序列已分别插入pGEX-KG 上游的多克隆位点中。DNA 序列测定结果显示与已知序列完全一致,无突变发生(数据略)。
2.3 融合蛋白GST-H-Ras(1-165)、GST-H-Ras(165-189)的诱导表达及鉴定
将鉴定正确的重组表达质粒转化大肠杆菌Rossate感受态细胞,经过小量诱导后收集菌体,Western印迹检测发现GST-H-Ras(1-165)、GST-H-Ras(165-189)融合蛋白获得正确表达(图3)。
2.4 融合蛋白GST-H-Ras(1-165)、GST-H-Ras(165-189)的纯化与洗脱
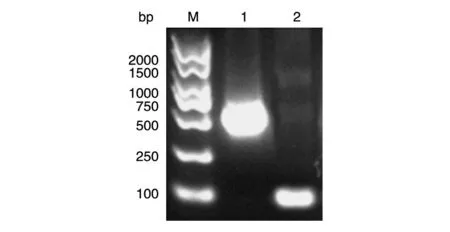
图1 目的基因的PCR扩增
融合蛋白经GST-Sepharose 4B 亲和珠纯化、还原性谷胱甘肽小量多次洗脱、考马斯亮蓝染色,结果显示获得一定量的纯度较高的GST-H-Ras(1-165)和GST-H-Ras(165-189)蛋白(图4)。
3 讨论

图2 重组质粒的双酶切鉴定

图3 融合蛋白的Western印迹

图4 融合蛋白纯化并洗脱后的SDS-PAGE分析
自1982 年Weinberg 等发现人的膀胱癌细胞中有活化的H-Ras 基因后,Ras 基因家族H-Ras、KRas 和N-Ras 相继被发现,分别定位于11、12 和1 号染色体上。Ras 基因的编码产物是具有GTP 结合作用和GTP酶活性的G蛋白,位于细胞膜内侧,能够传递生长信号,结合GTP 时为活化状态,而结合GDP时为失活状态,正常状态下Ras蛋白与GDP 结合,参与Ras/RAF/MEK/ERK/MAPK 途径的信号传导[6]。Ras基因最常见的激活方式为点突变,约30%的人类恶性肿瘤存在Ras 基因的点突变,常见的突变位点是12、13、61位密码子,其中又以第12位密码子突变最为常见[7]。不同类型肿瘤中存在不同的Ras 基因突变。膀胱癌和甲状腺癌常见H-Ras基因突变。一旦Ras 基因激活,导致其GTPase 活性下降或Ras 蛋白构型改变从而与GTP 结合后,不需外界生长信号的刺激,便保持持续活化状态,激活下游MAPK 级联反应,导致细胞大量增殖,凋亡减少,细胞恶性转化。此外,正常的Ras 基因也可因过度表达而诱导恶性转化[8]。最近的研究发现Ras 激活还能调控细胞周期,促进血管内皮生长因子的表达,从而促进血管生成,与细胞自噬、细胞能量代谢也存在一定的关系[9-10]。不仅如此,Ras 的突变还与肠癌患者表皮生长因子受体单克隆抗体(西妥昔单抗)的耐药密切相关[11]。所以,构建原核表达载体GST-H-Ras,有助于进一步了解H-Ras在肿瘤发生、发展中的作用。
Ras蛋白家族具有高度特异性和同源性[12],所有的Ras家族成员的基因编码区都有5个外显子,其中1个外显子不编码蛋白质,因为前165位氨基酸残基序列无种属间差别且高度保守。Ras 家族3 个高度同源的亚型的不同生物学功能主要归于C 端高度变异区的不同序列,这后25位氨基酸残基(166~188/9)是它们之间惟一不同的区域,也包含着Ras 与细胞膜内信号联系的必要蛋白序列[5]。
综上,我们以人Myc-H-Ras 质粒为模板扩增了H-Ras(1-165)和H-Ras(166-189)编码序列,首次将H-Ras 基因片段化,构建出上述2 个片段的原核表达载体,并表达、纯化得到纯度较高的重组蛋白GST-H-Ras(1-165)和GST-H-Ras(165-189),为后续研究H-Ras 片段与其他癌/抑癌蛋白之间的相互作用,深入探讨其致癌机制奠定了实验基础。
[1]Der C J,Krontiris T G,Cooper G M.Transforming genes of human bladder and lung carcinoma cell lines are homologous to the Ras genes of Harvey and Kirsten sarcoma viruses[J].Proc Natl Acad Sci USA,1982,79(11):3637-3640.
[2]Kompier L C,Lurkin I,van der Aa M N,et al.FGFR3,HRas,KRas,NRas and PIK3CA mutations in bladder cancer and their potential as biomarkers for surveillance and therapy[J].PLoS One,2010,5(11):e13821.
[3]伍岳,王文军.Ras 与肿瘤[J].医学临床研究,2006,23:2014-2017.
[4]Sun D,Yu F,Ma Y,et al.microRNA-31 activates the Ras pathway and functions as an oncogenic microRNA in human colorectal cancer by repressing Ras p21 GTPase activating protein 1(RasA1)[J].J Biol Chem,2013,288(13):9508-9518.
[5]Hancock J F.Ras proteins:different signals from different locations[J].Nat Rev Mol Cell Biol,2003,5(4):373-384.
[6]吴远昊,张守鹏.Ras基因突变在甲状腺癌中的研究进展[J].中国医学工程,2012,20(8):185-186.
[7]Yu S H,Wang T H,Au L C.Specific repression of mutant K-Ras by 10-23 DNAzyme:sensitizing cancer cell to anticancer therapies[J].Biochem Biophys Res Commun,2009,378(2):230-234.
[8]李蠡,薛春雨,邢新.恶性黑色素瘤细胞凋亡特点的研究进展[J].医学研究生学报,2005,18(9):849-852.
[9]Lock R,Debnath J.Ras,autophagy and glycolysis[J].Cell Cycle,2011,10(10):1516-1517.
[10]Chesney J,Telang S.Regulation of glycolytic and mitochondrial metabolism by Ras[J].Curr Pharm Biotechnol,2013,14(3):251-260.
[11]Custodio A,Feliu J.Prognostic and predictive biomarkers for epidermal growth factor receptor-targeted therapy in colorectal cancer:beyond KRas mutations[J].Crit Rev Oncol Hematol,2013,85(1):45-81.
[12]Vakiani E,Solit D B.KRas and BRAF:drug targets and predictive biomarkers[J].J Pathol,2011,223(2):219-229.
