木薯细菌性萎蔫病菌的LAMP 快速检测方法
2015-11-25封立平李洪林甘琴华
封立平, 李洪林, 倪 新, 王 简, 纪 瑛, 甘琴华
(1. 山东出入境检验检疫局,青岛 266002;2. 滨州出入境检验检疫局, 滨州 256603;3. 临沂出入境检验检疫局综合技术服务中心, 临沂 276034)
木薯细菌性萎蔫病菌的LAMP 快速检测方法
封立平1, 李洪林2, 倪 新3, 王 简1, 纪 瑛1, 甘琴华1
(1. 山东出入境检验检疫局,青岛 266002;2. 滨州出入境检验检疫局, 滨州 256603;3. 临沂出入境检验检疫局综合技术服务中心, 临沂 276034)
建立了一种木薯细菌性萎蔫病菌的环介导恒温扩增快速检测方法,为木薯细菌性萎蔫病的快速检测提供有力的技术支持。针对木薯细菌性萎蔫病菌TAL效应器蛋白质(pthBXam)靶序列的6个位点设计4条特异性引物,并对反应温度和内引物浓度等参数进行了优化,设计的引物与试验中提供的其他黄单胞近缘种都没有扩增反应,表现了较好的特异性。LAMP 方法对木薯细菌性萎蔫病菌菌株DNA的检测下限为1 pg/μL,比常规PCR灵敏度高100倍。该方法采用SYBR Green I染料法对扩增产物闭管检测,裸眼观察颜色变化判断反应结果,能快速、准确地对田间样品进行检测,没有出现假阳性和假阴性。与其他检测方法相比,LAMP 方法检测时间短,效率高,降低了设备投入,易于操作,适合木薯细菌性萎蔫病菌的现场检疫和大规模监测。
木薯细菌性萎蔫病菌; 环介导等温扩增; 检测
木薯是重要的热带薯类作物,在保障全球粮食安全及发展生物质能等方面具有重要的作用[1]。中国是世界上最大的木薯进口国,而木薯细菌性萎蔫病是木薯上重要的检疫性病害。该病具有高风险、分布广、可种传的特点,是木薯繁育的重要限制因子[2]。该病害目前在除欧洲以外的许多国家都有报道,木薯感染此病后产量可下降12%~100%[3-4]。引起该病害的病原菌木薯细菌性萎蔫病菌(Xanthomonasaxonopodispv.manihotis)在我国新出台的《中华人民共和国进境植物检疫性有害生物名录》中被列为检疫性有害生物,也是国际上重要的植物检疫对象。该病菌主要危害木薯的叶片、茎部,引起萎蔫和顶枯,属维管束系统性侵染病害。木薯细菌性萎蔫病菌主要靠带菌的种茎进行远距离传播,此外雨水、昆虫、病土及带菌工具也可传播[5]。如何利用先进的检测技术有效地对进境木薯繁殖材料进行检疫和对木薯产区的木薯细菌性萎蔫病菌进行监测,保护我国的木薯良种引种繁育和生产安全是亟待解决的问题。
目前一些分子检测方法如各类PCR、杂交探针、RAPD、 AFLP等已被广泛应用于木薯细菌性萎蔫病菌的检测鉴定,并且在口岸检疫中缩短了检测周期,但其昂贵的仪器设备和较高的假阳性率,限制了其推广[6-10]。环介导恒温扩增技术(LAMP)是Notomi等2000年开发的一种恒温核酸扩增方法[11]。其原理是针对靶基因的6个区域,设计4条特异性引物,利用一种链置换Bst DNA聚合酶,恒温反应1 h左右可合成109~1010拷贝的靶DNA序列,通过直接观察产物颜色进行结果判定。该技术从2003年开始首先被用于医学的临床检测,取得了引人注目的效果[12]。目前许多学者利用LAMP 技术对难以培养的细菌、生化反应不明显及传统表型方法不能鉴定的细菌进行了快速准确的鉴定[13]。但该技术目前在植物病原细菌检测领域应用较少,未见木薯细菌性萎蔫病菌的LAMP 检测方法的报道。
本研究建立了一种木薯细菌性萎蔫病菌的LAMP 高通量检测方法,适合木薯繁殖材料的大量、即时、现场的检测,特异性、灵敏度比普通PCR方法高,同时不需高昂的仪器投入,便于基层推广。该方法的建立可为进境木薯繁殖材料的检疫和大田监测提供技术支持,保护我国木薯产业的健康发展。
1 材料与方法
1.1 供试材料
感染木薯细菌性萎蔫病菌的木薯植株叶片由华南热带农业大学环境与保护学院提供;其他供试菌株和来源:木薯细菌性萎蔫病菌(Xanthomonasaxonopodispv.manihotis)ATCC 51302;地毯草黄单胞菌槟榔致病变种(Xanthomonasaxonopodispv.arecae)ACCC 03534;野油菜黄单胞菌野油菜致病变种(Xanthomonascampestrispv.campestris)ACCC 10491;甘蓝黑腐病禾草类致病变种(Xanthomonascampestrispv.cerealis)ACCC 14146;水稻白叶枯病菌(Xanthomonasoryzaepv.oryzae)ACCC 11602;风信子黄腐病菌(Xanthomonashyacinthi)ATCC 12612;地毯草黄单胞菌万年青致病变种(Xanthomonasaxonopodispv.dieffenbachiae)ATCC 23379。ATCC为美国标准菌种库,ACCC为中国农业微生物菌种保藏管理中心。
试剂:Bst DNA polymerase large fragment,购于New England Biolabs(NEB)公司;DNA marker,购于宝生物工程(大连)有限公司;dNTPs,购于上海生工生物工程有限公司;琼脂糖,购于Promega公司;细菌DNA提取试剂盒,购于天根生化科技(北京)有限公司;营养肉汤,购于北京陆桥技术有限责任公司;SYBR GreenⅠ,购于嘉美生物有限公司。
仪器:水浴锅,购于上海森信实验仪器有限公司; BioPhotometer Plus核酸蛋白测定仪,购于Eppendorf 中国有限公司;DYCP-32C型水平电泳仪,购于北京六一仪器厂;Vilber Lourmat凝胶成像系统,购于法国Vilber Lourmat公司;WFH-201B紫外透射反射仪,购于上海沪粤明科学仪器有限公司;LAMP Realtime Turbidimeter LA-320c,购于日本荣研化学株式会社。
1.2 试验方法
1.2.1 细菌培养及DNA提取
根据天根细菌总DNA提取试剂盒说明书进行各病原菌总DNA的提取。所提样品DNA的A260/A280在1.6~2.0范围内,核酸浓度在40~100 ng/μL范围内。-20 ℃冰箱保存备用。
1.2.2 引物的设计与合成
以GenBank中木薯细菌性萎蔫病菌致病质粒Pbsf2上的TAL效应器蛋白质(pthBXam)保守基因(GenBank 登录号:HQ113297.1)为靶标,利用Primer Explorer Version 4.0在线设计4条LAMP 特异性引物。其中F3 (5′-CAGAACATCCCGAC-GCTG-3′)和B3(5′-GCCCTGTGGCCGTTGA-3′)为外侧引物,FIP(5′-AGCGCGACCGCTTAAGTCAAGGTTCCGGCTTACATCCCCA-3′)和BIP(5′-GGCATTGCCGGCGATCACTTCGAGCTTCGGAAAGGACCA-3′)为内侧引物。引物由上海生工生物工程技术服务有限公司合成。设计的引物通过NCBI BLAST进行比对后显示该内、外侧引物扩增的靶标是木薯细菌性萎蔫病菌特有的TAL效应器蛋白质(pthBXam)保守基因序列。
1.2.3 常规PCR检测
自行设计木薯细菌性萎蔫病菌的常规PCR检测体系。采用25 μL体系:10×PCR反应缓冲液2.5 μL,DNA 模板1 μL,2.5 mmol/L MgC12溶液1.5 μL,50 mmol/L上游引物(5′-GTCCTGCCCACGAACTTCTG-3′)和50 mmol/L下游引物(5′-TGACAGCGACGGTCCCTAA-3′)各1 μL,2.5 mmol/L dNTPs 1 μL,5 U/μLTaqDNA聚合酶0.5 μL。补水至25 μL。PCR扩增条件:94 ℃ 5 min;94 ℃ 45 s,54 ℃ 45 s,72 ℃ 1 min,30个循环;最后72 ℃延伸7 min。PCR产物用1.5%琼脂糖凝胶电泳检测,扩增片段大小为602 bp。该方法用于后续LAMP 和PCR的检测灵敏度分析。
1.2.4 LAMP 反应体系优化及扩增产物检测
LAMP 反应采用25 μL反应体系:菌株DNA 2 μL,8 U/μL Bst DNA Polymerase 2 μL,10 mmol/L dNTPs 4 μL,基础反应液[10×Thermol buffer,20 mmol/L Tris-HCl (pH 8.8,25 ℃),10 mmol/L KCl,10 mmol/L (NH4)2SO4,8 mmol/L MgSO4,0.01% Triton X-100]12.5 μL,5 μmol/L的外引物(F3与B3)1 μL,10 μmol/L的内引物(FIP与BIP)1 μL,补水至25 μL。其中各组分均为工作液浓度。反应条件设定为62 ℃(根据Bst酶推荐的扩增温度60~65 ℃的特性确定)60 min,然后80 ℃ 10 min终止反应,降温至4 ℃。LAMP 反应前在PCR反应管内盖上加入1 μL 1∶10倍稀释的SYBR GreenⅠ荧光染料,待反应结束后瞬时离心将SYBR GreenⅠ加入LAMP 反应液中进行显色观察,避免开盖可能导致的气溶胶污染。在此反应体系基础上,根据不同条件下扩增的最短起始时间、扩增产物量等确定反应的最佳温度和最佳内外引物浓度。
温度优化:根据内外引物组的Tm值,将反应混合物分别在59、60、61、62、63、64和65 ℃反应60 min然后80 ℃ 10 min终止反应。用LAMP Realtime Turbidimeter LA-320c对反应进行实时监控,收集扩增起始时间信息,进行显著性分析,筛选出最佳反应温度。
内引物浓度优化:外引物F3、B3只在LAMP 反应的最初阶段起引导作用,用量很少,因此内引物浓度的优化比较重要。固定外引物F3、B3的用量为5 μmol,设置内引物FIP、BIP的用量以10、20、30、40、50、60 μmol依次递增,用LAMP Realtime Turbidimeter LA-320c对反应进行实时监控,收集扩增起始时间信息,进行显著性分析,筛选出最佳引物浓度。
扩增产物通过荧光染料法或凝胶电泳法检测。荧光染料法: LAMP 反应前在PCR反应管内盖上加入1 μL 1∶10倍稀释的SYBR Green Ⅰ荧光染料,待反应结束后瞬时离心将SYBR Green Ⅰ加入LAMP 反应液中进行显色反应。阳性扩增产物(大量双链DNA)的颜色为翠绿色,阴性扩增产物为橙色。凝胶电泳法:将LAMP 反应的产物,用含溴化乙锭(EB)的1.5%琼脂糖凝胶电泳。在紫外透射仪下观察核酸带,阳性扩增产物可见从点样孔的拖尾现象以及很多不同扩增长度的条带;阴性则没有条带。
1.2.5 利用LAMP 方法特异性检测木薯细菌性萎蔫病菌
以木薯细菌性萎蔫病菌的近缘细菌为对照菌检测LAMP 方法的特异性。对照菌包括地毯草黄单胞菌槟榔致病变种、野油菜黄单胞菌野油菜致病变种、甘蓝黑腐病禾草类致病变种、水稻白叶枯病菌、风信子黄腐病菌、地毯草黄单胞菌万年青致病变种。分别以感染木薯细菌性萎蔫病菌的叶片总DNA、木薯细菌性萎蔫病菌菌株DNA、上述6种对照菌的DNA为模板,采用已优化的反应体系进行LAMP 方法特异性检测,检测结果通过荧光染料法和1.5%琼脂糖凝胶电泳进行分析。
1.2.6 LAMP 方法灵敏度检测
以感染木薯细菌性萎蔫病菌的木薯叶片总DNA为模板进行灵敏度分析。利用核酸蛋白仪测定DNA浓度并稀释为100 ng/μL。取1 μL DNA按照10倍进行梯度稀释,用不同稀释度的DNA为模板进行LAMP 灵敏度检测。同时以相同的模板进行常规PCR试验,以比较常规PCR与LAMP 方法灵敏度的差异。检测结果通过1.5%琼脂糖凝胶电泳进行分析。
1.2.7 染病植株检测
用建立的Xam-LAMP 检测方法和常规PCR方法对广西木薯研究所收集的已经过致病性检测的30份染病木薯叶片样品和30份未染病的健康叶片样品进行检测。以木薯细菌性萎蔫病菌菌株DNA为阳性对照。对比LAMP 检测方法和常规PCR方法的检出率,并比较与致病性结果是否一致。
2 结果与分析
2.1 LAMP 反应体系和反应条件优化
2.1.1 LAMP 反应温度优化结果
LAMP 产物经1.5%琼脂糖凝胶电泳检测表明,反应在59、60、61、62、63、64和65 ℃下都有扩增,特征电泳条带均很亮,表明设计的引物好,反应条件宽松(图1a)。SYBR Green Ⅰ荧光染料检测结果显示,1~7号反应管反应液颜色变绿,表明有扩增反应;8号反应管内的反应液保持橙色不变,表明未发生扩增反应(图1b)。用邓肯氏新复极差测验分析不同反应温度下的起始反应时间统计结果表明,随着温度的上升,反应时间呈现先降后升的趋势,当温度为61 ℃时,28.16 min即开始扩增,起始反应时间最短,扩增效率高(表1)。因此,将61 ℃确定为Xam-LAMP 检测的最适温度。

图1 Xam-LAMP反应温度的优化Fig.1 Optimization of reaction temperature of Xam-LAMP test

温度/℃Temperature3个重复起始时间/minStartingtimeof3replicates123平均值/minMean5938.0038.5639.2038.59b6030.0230.7831.0030.60d6128.0227.6528.8028.16e6231.2532.2231.8531.77c6332.0033.0231.4532.16c6444.0044.5144.2044.23a6544.5044.3245.8044.87a
1) 表中不同字母表示经邓肯氏新复极差测验,各处理间在0.05水平差异显著。下同。
Different letters in the table indicate the significant difference between each treatment at 0.05 level by Duncan’s new multiple range test. The same below.
2.1.2 LAMP内引物浓度优化结果
采用LAMP Realtime Turbidimeter LA-320c设备,使用LAMP浊度法分析不同内引物浓度下的起始反应时间。设备自动生成扩增速率和扩增曲线图(图2)。用邓肯氏新复极差测验分析不同内引物浓度下起始反应时间。统计结果表明,相同反应条件下,FIP/BIP引物为40 μmol时,起始反应时间平均值为27.47 min,比其他用量的起始反应时间都短,扩增效率最高。增加或减少FIP/BIP用量,扩增效率降低,起始反应时间延迟(图2和表2)。因此引物FIP、BIP、F3与B3的终浓度比为8∶8∶1∶1较适宜。
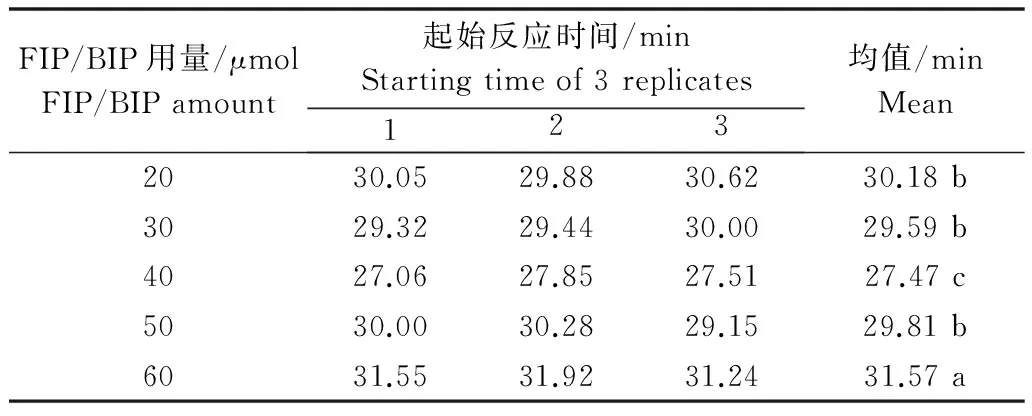
表2 不同FIP/BIP用量下起始反应时间
2.2 LAMP方法特异性检测
分别以感染木薯细菌性萎蔫病菌的叶片总DNA、木薯细菌性萎蔫病菌菌株和其对照菌株的核酸DNA为模板,用优化的反应体系进行LAMP特异性测试,琼脂糖电泳结果显示感染木薯细菌性萎蔫病菌的叶片、木薯细菌性萎蔫病菌菌株均出现典型的梯状特异性条带,而其他6种对照近缘细菌都没有扩增。SYBR GreenⅠ荧光染料法显示,染病木薯叶片、木薯细菌性萎蔫病菌菌株反应管反应液颜色变绿,表明有扩增反应;其他对照菌反应管内的反应液保持橙色不变,表明未发生扩增反应。两种扩增产物检测方法结果一致,结果表明本方法设计的引物对木薯细菌性萎蔫病菌的特异性强,可以准确鉴定木薯细菌性萎蔫病菌(图3)。

图2 不同FIP/BIP浓度下的扩增速率和扩增曲线Fig.2 The amplification rate and amplification curve at different concentrations of primer FIP/BIP

图3 木薯细菌性萎蔫病菌的LAMP特异性试验Fig.3 Specificity test for Xam-LAMP assay
2.3 LAMP方法灵敏度检测结果
将感染木薯细菌性萎蔫病菌的木薯叶片DNA稀释成不同浓度,用优化的LAMP检测方法扩增,琼脂糖电泳结果表明,随着模板浓度的降低,梯状特异性条带逐渐变淡,至稀释度10-6时没有扩增产物(图4a),与LAMP的SYBR Green Ⅰ的检测结果(图4b)一致。根据DNA浓度计算得出,本LAMP方法的检测下限为1 pg/μL。用普通PCR方法扩增不同稀释浓度的模板,结果表明,当稀释度为10-4时没有扩增产物,PCR方法的检测下限约为100 pg/μL(图4c)。通过比较可以看出,LAMP方法的灵敏度是普通PCR的100倍左右。
2.4 染病植株检测结果
染病植株检测结果显示,阳性样品叶片Xam-LAMP的检出率为 93.3%,普通PCR方法的检出率为90%。2种方法对30份健康叶片的检测结果均为阴性。由此可见运用Xam-LAMP方法能够对木薯活体植株样品实施准确检测,电泳结果与致病性检测结果一致,没有出现假阴性和假阳性,且检测的准确性优于PCR方法。
3 讨论
木薯起源于热带美洲,是热带地区主要的块根作物,目前已成为我国华南地区的一种重要的旱地经济作物。木薯可作为食品和饲料及食品、化工等产业的原料。由于中国木薯生产不能满足国内需求,近年来木薯进口一直呈上升趋势。木薯细菌性萎蔫病菌是我国的检疫性病原细菌,也是国际上重要植物检疫对象,由它引起的木薯细菌性萎蔫病是木薯生产上最严重的细菌病害。感染该病后可导致木薯产量的巨大损失,以及木薯繁殖材料品质的下降。2007—2010年对我国广西、海南、云南木薯主产区的病害普查发现,该病害的发生面积较大,严重威胁到木薯产业的健康发展。木薯细菌性萎蔫病菌主要通过感病的种质材料传播。此病菌可以在不引起病症的情况下,潜伏侵染木薯。所以建立准确、高效、快速的木薯细菌性萎蔫病菌的检测方法,可以有效提高该病害的检疫和监测质量,为木薯的无病良种繁育提供技术支持,保护我国木薯生产安全。

图4 Xam-LAMP的灵敏度试验Fig.4 Sensitivity test for Xam-LAMP assay
目前木薯细菌性萎蔫病菌传统的检测主要是病菌的分离培养鉴定,但该方法检测灵敏度低、耗时长,已不能满足口岸快速检测的需要。依托PCR仪的各种检测方法已成为该病菌检测的主要手段。1998年Verdier 等建立了一种木薯细菌性萎蔫病菌的PCR检测方法,可以实现对木薯叶片和茎组织的检测,从染病组织中均可特异性地扩增出898 bp的序列,检测下限达到3×102cfu/mL[6]。随后,Ojeda等采用巢式PCR实现了木薯种子中木薯细菌性萎蔫病菌的检测[7],Verdier 等建立了木薯细菌性萎蔫病菌的杂交探针检测方法等[8]。 指纹图谱技术被运用到木薯细菌性萎蔫病菌的鉴定中,如Ogunjobi等采用RAPD 和 AFLP技术对尼日利亚西部的木薯细菌性萎蔫病菌进行了遗传变异的比较分析[10]。但是这些技术操作起来非常繁琐,实验时间长,各类PCR检测还需要琼脂糖电泳结果,不能满足快速检测的要求。而实时荧光定量PCR所采用的检测设备和耗材更加昂贵。因此PCR检测技术和杂交探针等方法在田间即时检测方面不具备优势。本试验采用LAMP技术建立木薯细菌性萎蔫病菌快速检测体系,由于LAMP技术采用4条引物(其中2条超过40 bp)来识别目的片段6个特异性区域,使得LAMP检测方法比PCR方法具有更好的特异性、便捷性、灵敏性。在本研究中,LAMP检测下限为1 pg/μL,灵敏度为普通PCR的100倍。LAMP产物通过SYBR GreenⅠ染料染色,肉眼观察颜色变化来判断,1 h即可得到结果,具有无可比拟的可视性、即时性的检测优势。此外,LAMP检测在恒温下进行,只需要一台水浴锅或者培养箱即可,容易在田间地头及货场进行检测,也更适合在农技基层部门推广使用。
木薯细菌性萎蔫病菌菌株中广泛存在致病质粒Pbsf2,该质粒与木薯细菌性萎蔫病菌的病理特性密切相关。pthBXam基因是木薯细菌性萎蔫病菌致病质粒Pbsf2上重要的编码致病蛋白的基因,该致病蛋白对于木薯细菌性萎蔫病菌的强致病力具有重要作用[14-16]。本研究采用pthBXam的保守基因设计引物, 保证了检测方法的特异性。我们使用的这个基因序列在数据库中未发现同源序列,根据设计的LAMP特异性引物进行该病菌及其对照菌的LAMP检测,发现仅木薯细菌性萎蔫病菌获得了预期的扩增产物,而黄单胞菌属的其他近缘种均未检测出相应的DNA片段。Xam-LAMP实现了受侵染木薯活性植株中该病原菌的准确检测,没有出现假阴性和假阳性。木薯细菌萎蔫病菌在分类上原划归为油菜黄单胞(Xanthomonascampestris),目前划归为地毯草黄单胞(X.axonopodis)。本研究收集了黄单胞菌属内油菜黄单胞和地毯草黄单胞的近缘种作为对照菌株,保证了检测结果的可靠性。研究采用了不开盖检测,在LAMP反应前在PCR管内盖上加入SYBR Green Ⅰ荧光染料,使其附在管盖内侧,待反应结束后瞬时离心将SYBR Green Ⅰ加入LAMP反应液中进行显色观察,避免了开盖造成气溶胶污染。
综合试验结果可以看出,本研究建立的木薯细菌性萎蔫病菌的环介导恒温扩增(LAMP)检测方法与其他分子生物学技术相比检测时间短,效率高;检测仪器简单,无须昂贵的PCR仪,降低了设备投入,是一种适合口岸检验检疫机构和基层实验室进行检疫和监测的方法,具有较广阔的应用前景。
[1] 方佳, 濮文辉, 张慧坚. 国内外木薯产业发展近况[J].中国农学通报,2010, 26(16):353-361.
[2] 李开绵, 林雄, 黄洁. 国内外木薯科研发展概况[J].热带农业科学,2001, 89(1):56-60.
[3] Verdier V, Restrepo S, Mosquera G, et al. Genetic and pathogenic variation ofXanthomonasaxonopodispv.manihotisin Venezuela [J].Plant Pathology,1998, 47(5):601-608.
[4] Restrepo S, Velez C M, Duque M C, et al. Genetic structure and population dynamics ofXanthomonasaxonopodispv.manihotisin Colombia from 1995 to 1999 [J].Applied and Environmental Microbiology, 2004, 70(1):255-261.
[5] 封立平, 王英超, 庞国兴等. 木薯细菌性萎蔫病菌的检疫方法研究[J].植物检疫, 2007, 21(5):261-264.
[6] Verdier V, Mosquera G, Assigbetse K.Detection of the cassava bacterial blight pathogen,Xanthomonasaxonopodispv.manihotis, by polymerase chain reaction[J].Plant Disease, 1998, 82(1):79-83.
[7] Ojeda S, Verdier V.DetectingXanthomonasaxonopodispv.manihotisin cassava true seeds by nested polymerase chain reaction assay [J].Canadian Journal of Plant Pathology, 2000, 22(3):241-247.
[8] Verdier V, Mosquera G.Specific detection ofXanthomonasaxonopodispv.manihotiswith a DNA hybridization probe [J].Journal of Phytopathology,1999, 147(7):417-423.
[9] Restrepo S, Duque M, Tohme J, et al. AFLP fingerprinting: an efficient technique for detecting genetic variation ofXanthomonasaxonopodispv.manihotis[J].Microbiology-UK,1999, 145:107-114.
[10]Ogunjobi A A, Fagade, O E, Dixon A G O. Comparative analysis of genetic variation amongXanthomonasaxonopodispv.manihotisisolated from the western states of Nigeria using RAPD and AFLP [J].Indian Journal of Microbiology,2010,50(2):132-138.
[11]Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research, 2000, 28(12): E63.
[12]路超, 王长印, 董振芳,等. 环介导等温扩增技术的应用[J].分子诊断与治疗杂志, 2011, 3(2):138-144.
[13]王丽, 石磊, 李琳. DNA环介导的恒温扩增法在快速鉴定病原微生物中的应用[J].生命的化学,2006, 26(5):462-465.
[14]Verdier V, Bother B, Maraite H, et al.Pathological and molecular characterization ofXanthomonascampestrisstrains causing diseases of cassava (Manihotesculenta)[J]. Applied and Environmental Microbiology,1994, 60(12):4478-4486.
[15]Verdier V, Restrepo S, Mosquera G, et al. Recent progress in the characterization of molecular determinants in theXanthomonasaxonopodispv.manihotis-cassavainteraction[J].Plant Molecular Biology, 2004, 56(4):573-584.
[16]Santaella M, Suarez E, Lopez C, et al. Identification of genes in cassava that are differentially expressed during infection withXanthomonasaxonopodispv.manihotis[J].Molecular Plant Pathology,2004,5(6):549-558.
(责任编辑:杨明丽)
Loop-mediated isothermal amplification (LAMP) for rapid detection ofXanthomonasaxonopodispv.manihotis
Feng Liping1, Li Honglin2, Ni Xin3, Wang Jian1, Ji Ying1, Gan Qinhua1
(1. Shandong Entry-Exit Inspection and Quarantine Bureau, Qingdao 266002, China; 2. Binzhou Entry-Exit Inspection and Quarantine Bureau, Binzhou 256603, China; 3. Comprehensive Technical Service Center of Linyi Entry-Exit Inspection and Quarantine Bureau, Linyi 276034, China)
A rapid loop-mediated isothermal amplification (LAMP) method was established for quick detection ofXanthomonasaxonopodispv.manihotis. The target sequence pthBXam was amplified by a set of four specific primers that recognize six distinct target sequences. The parameters, including the reaction temperature and the inner primer concentrations, were optimized. The LAMP primers did not react with other closely relatedXanthomonasin this test. The lower limit of detection of this LAMP assay was about 1 pg/μL DNA,which was 100 times more sensitive than PCR method. The amplification products could be checked by naked-eye visualization by a closed-tube detection technique with SYBR Green I staining. The LAMP method is simple and rapid method for detection ofX.axonopodispv.manihotisfrom the infected cassava sampled in the field. The LAMP assay has advantage of short detection time, high efficiency and low cost, which provides a new tool for on-site quarantining and large-scale monitoring of this pathogen.
Xanthomonasaxonopodispv.manihotis; LAMP; detection
2014-12-17
2015-03-09
国家质检总局科技计划项目(2009IK254;2011IK286);“十二五”国家科技支撑计划(2012BAK11B02);山东出入境检验检疫局科研项目(2005SK09)
S 432.41;S 436.43
A
10.3969/j.issn.0529-1542.2015.03.018
联系方式 E-mail: fengciq@163. com
