澎溪河消落带典型植物群落根际土壤无机氮形态及氮转化酶活性
2015-11-19王晓锋袁兴中岳俊生蔚建军重庆大学煤矿灾害动力学与控制国家重点实验室重庆00030重庆大学三峡库区生态环境教育部重点实验室重庆00030重庆大学资源及环境科学学院重庆00030西南大学资源环境学院重庆00716第三军医大学军事预防医学院重庆00038
王晓锋,刘 红,张 磊,罗 珍,袁兴中,岳俊生,蔚建军(1.重庆大学煤矿灾害动力学与控制国家重点实验室,重庆 00030;2.重庆大学三峡库区生态环境教育部重点实验室,重庆 00030;3.重庆大学资源及环境科学学院,重庆 00030;.西南大学资源环境学院,重庆 00716;.第三军医大学军事预防医学院,重庆00038)
澎溪河消落带典型植物群落根际土壤无机氮形态及氮转化酶活性
王晓锋1,2,3,刘 红1,3*,张 磊4,罗 珍5,袁兴中1,2,3,岳俊生1,2,3,蔚建军4(1.重庆大学煤矿灾害动力学与控制国家重点实验室,重庆 400030;2.重庆大学三峡库区生态环境教育部重点实验室,重庆 400030;3.重庆大学资源及环境科学学院,重庆 400030;4.西南大学资源环境学院,重庆 400716;5.第三军医大学军事预防医学院,重庆400038)
三峡库区消落带是典型的生态脆弱带,其土壤N循环因受到植物根际效应和季节性淹水的影响而具有特殊性.本研究以三峡库区一级支流澎溪河消落带为例,选择4种植被(狗牙根、香附子、苍耳以及玉米)覆盖区,采集植物根际、非根际土壤,分析根际土壤与非根际土壤理化性质、无机氮形态以及7种N素转化相关酶,并比较了4种植物根际效应强度,以反映不同植物覆盖对消落带土壤N循环过程的影响.研究表明:供试植物根际土壤pH值均低于非根际,有机质、全氮、全磷含量均高于非根际,表明植物根际对消落带土壤养分有富集作用;4种植物根际土壤硝态氮、铵态氮、亚硝态氮及14d可矿化氮含量均高于非根际,且土壤硝态氮、亚硝态氮以及14d可矿化氮含量呈现香附子>狗牙根>苍耳/玉米;总体上根际土壤N转化酶活性高于非根际,且狗牙根和香附子覆盖区脲酶、亚硝酸还原酶、谷氨酰胺酶、脱氢酶显著高于玉米和苍耳覆盖区;蛋白酶、脲酶、谷氨酰胺酶活性与4种N形态均呈显著相关性,是消落带土壤N转化的主要参与酶类;根际效应分析结果香附子和狗牙根对消落带土壤N转化的根际效应强度大于苍耳和玉米,有利于土壤N素的固定和保持.植物根际效应对消落带土壤N素循环的影响可为消落带植被恢复工程中植被选择提供参考,也为改善消落带土壤退化相关研究提供科学支撑.
消落带;根际土壤;氮转化;典型植物;酶活性
根际是植物、土壤、微生物相互关联的重要生态区域[1],许多学者在植物根际效应的养分有效性[2]、有机质降解[3]、土壤污染修复[4-5]、土壤退化[6]、营养动力学[7]、微生物群落变化[8-9]以及根际沉积[10]等领域展开了大量研究,根际土壤与非根际土壤在物理、化学、生物等特性上都有明显差异[8-9].根际作为土壤水分和矿物质进入根系并参与生物循环的门户,对环境变化极其敏感[11].不同植物由于其生理特性的差异,对根际土壤的影响也不同.三峡水库成库之后,在水库两岸形成了一个落差30m,面积达348.39km2的消落带[12],其冬季完全淹没水下,夏季露出,是库区水域与周边陆地环境的重要界面,具有水、陆环境的双重特点,同时植物群落因季节性水淹而处于不断变动并逐渐趋于稳定[13-15].孙荣等[16]与Wang等[13-14]分别对三峡库区消落带2008、2009、2010年植物群落进行调查研究,认为季节性干湿交替导致三峡库区消落带植物群落发生较大变动,澎溪河消落带优势植物群落从2008年的苍耳、狗牙根群落[16]逐渐转变为狗牙根、香附子群落[13].这种植物群落的演变对消落带土壤过程和功能必然产生重要影响.目前研究者分别对消落带植物群落变化[13]、土壤养分形态[17,18]、微生物过程[19]进行了研究,而从植物群落和根际效应角度研究消落带土壤养分转化过程却很少涉及.N素是生态系统物质循环和生物代谢作用中的关键元素,是水体富营养化最重要的限制因子.因此,研究消落带不同植物根际与非根际土壤N素形态和N转化酶活性,对了解不同植物覆盖对消落带土壤N循环影响和消落带植被恢复的科学筛选具有重要意义.
针对三峡库区消落带土壤过程的复杂性和植物群落的更替性,本研究以三峡入库支流澎溪河消落带3种典型草本和1种农作物为研究对象,对根际与非根际土壤N形态和N转化酶活性进行研究,探讨N形态和酶活性之间的关系,通过探索不同植物根际效应对消落带土壤N素转化酶活性差异,探究不同植物改善土壤氮质量的作用机理,理解其对消落带系统稳定性和养分保持的意义,为三峡库区消落带的植被恢复工作提供科学依据.
1 研究区域概况与研究方法
1.1 研究区域概况
研究区域位于三峡水库澎溪河支流回水末端,澎溪河左岸一级支流白夹溪(108°32′51'E,31°42′16″N).白夹溪发源于开县金峰乡,河谷平坦,地势开阔,河口最低海拔145m.受三峡水库175m蓄水水位影响河段长11km,消落带面积3.19km2.该区域属亚热带湿润季风气候,年平均气温为17.3℃,全年无霜期>300d,年降水量1006mm,区域内云雾多,日照偏少,年日照时数为1316h,年平均相对湿度84%.由于地质构造复杂,土壤母质多样,土壤类型主要为紫色土和冲积潮土.研究区域植被以草丛为主,分布大面积狗牙根、香附子、苍耳等典型消落带草本,盖度达85%以上,同时部分坡度较缓的消落带每年退水后被当地农民开垦种田,主要以种植玉米和水稻为主.
1.2 采样设计
本研究选取三峡库区消落带典型植物群落狗牙根(Cynodon dactylon)、香附子(Cyperus rotundus)、苍耳(Anthium sibiricum)和玉米(Zea mays L)作为研究对象.其中,狗牙根为禾本科多年生草本,具有种子和根茎两性繁殖能力,须根浅生,抗逆性极强,是消落带分布最广泛的草本植物;苍耳为菊科苍耳属一年生草本,适应性强,耐旱、耐盐,156m蓄水初期苍耳成片分布,为澎溪河流域消落带优势物种,前期调查发现,随着时间推移,苍耳群落逐渐被其他草本群落替代[13,15];香附子属莎草科多年生草本植物,有匍匐根状茎,细长,生态适应性强,种群扩繁容易,经济价值高,是三峡水库高水位运行后逐渐形成的主要替代群落[13-14],也是未来三峡水库消落带植被恢复建设的重要草本植物;玉米是三峡库区主要农作物,夏季消落带露出后会吸引附近居民对其进行垦荒耕种,因此本研究将玉米作为一种非自然的植物类型.
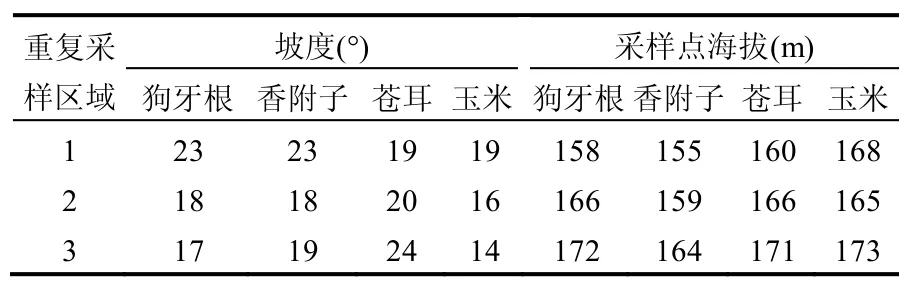
表1 各植物类型采样点立地信息Table 1 Sampling sites features
2014年6月中旬,三峡水库低水位(145.03~145.49m)运行且消落带植被生长旺盛期,选取白夹溪坡度<25°的消落带,对4种植物生长集中的位置设置面积为1m×1m的样方,样方选取避免设在田边、路边、沟边等特殊地形的部位以及堆过肥料的地方,并确保选择样方内研究植物盖度大于95%.每个植物群落设置3个平行采样点,记录每个样方内主要物种和盖度,样方立地信息见表1.
1.3 样品采集
根际土壤是指黏着在活性植物根系表面1mm以内土壤,非根际土壤是指植物覆盖区除去根际土壤之外剩余的根周土壤[20].因此本研究按照Riley[21]的方法:每种植物样方内采用S型布点选择9株,挖取有完整根系的土体(体积大小视根系的范围而定),轻轻敲碎并抖落大块不含根系的土壤,作为非根际土,然后用毛刷刷取根系表面(<1mm)附着的土壤作为根际土壤,为保证研究样品足够,在附近采集多株植株进行根际土壤采集,分别混合后按照四分法取样.将采集的土样混合,密封后带回室内,仔细除去其中可见植物残体,风干磨碎过100目土壤筛后待测.
同时,将样方内植物地上部和根系全部收割,装入编号的采样袋中,带回实验室分析其生物量特征.具体生物量统计信息见表2.
1.4 测定项目及方法
土壤理化性质分析方法参照《土壤农业化学分析方法》[22].土壤pH值测定采用玻璃电极法(土水比1:5),土壤有机质采用重铬酸钾-硫酸氧化法测定,全氮采用高氯酸-硫酸消化和凯氏定氮法测定,全磷采用酸溶-钼锑抗比色法测定,全钾(TK)采用火焰光度法测定,有效磷采用碳酸氢钠提取-钼锑抗比色法测定,速效氮采用扩散法测定,速效钾采用火焰光度法测定.
土壤氮素形态分析:土壤硝态氮含量采用1mol/L CaCl2溶液提取后用酚二磺酸比色法测定,铵态氮采用2mol/L KCl浸提—靛酚蓝比色法测定,亚硝态氮采用1mol/L CaCl2溶液提取后用重氮偶合分光光度法分析[23];土壤14d 可矿化氮采用好气培养法培养风干土样2周,测定硝态氮、铵态氮、亚硝态氮总量变化[23].
土壤N转化酶分析:蛋白酶活性测定采用茚三酮比色法,活性单位以24h后1g土壤中氨基氮的毫克数表示(U);脲酶采用苯酚钠比色法测定,活性单位以3h后1g风干土壤生成的铵态氮的微克数表示[24],本研究采用换算成1kg土壤生成的铵态氮的毫克数表示(U);硝酸盐还原酶采用酚二磺酸比色法测定,活性单位以1g风干土壤反应1h后底物硝酸盐减少的微克数表示(U)[24-25];亚硝酸还原酶活性采用重氮偶合分光光度法测定,活性单位采用1g风干土壤反应1h后底物亚硝酸盐减少的微克数表示(U)[24];天门冬酰胺酶和谷氨酰胺酶活性均采用纳氏比色法,分别以天门冬酰胺和谷氨酰胺为底物,37 ℃陪养24h后测定酶促反应生成氨氮含量,活性单位采用1g风干土壤24h反应生成氨氮的微克数表示(U)[22];脱氢酶测定采用三苯基四氮唑氯化物(TTC)还原法,用葡萄糖作为氢供体,三苯基四氮唑氯化物作为氢受体,以1g风干土壤1h生成的TPF的微克数(U)表示脱氢酶的活性单位[25].
根际效应强度计算采用Yin[26]的方法:

1.5 数据处理
原始数据在在Excel 2003中进行标准化处理,应用SPSS 18.0对试验数据进行方差分析,5%水平下LSD 多重比较检验各处理平均值之间的差异显著性.

表2 5种植物根系及生物量特征Table 2 Biomass and root characteristics of the five plant species (mean±SD, n = 10)
2 结果与分析
2.1 典型植物群落根际与非根际土壤理化性质差异
如表3所示,4种植物根际土壤pH值均低于非根际,除玉米外均达到显著水平;有机质、全氮、全磷、有效磷含量均表现为根际土壤高于非根际;根际土壤有机质、全氮含量均表现为香附子>狗牙根>苍耳>玉米,全磷、全钾含量则表现为狗牙根最大,玉米根际养分含量均低于其他3种草本植物;此外,不同植物根际对养分的富集率表现差异显著,狗牙根、香附子根际土壤有机质、全氮富集率均高于苍耳和玉米,而全磷富集率则以香附子和玉米较高;玉米根际全钾和速效钾均表现负富集,可能与玉米根际活化和根系吸收有关.综合分析,狗牙根和香附子根际效应对土壤理化性质的影响高于苍耳和玉米,而玉米对土壤养分的保持效果较差.
2.2 典型植物根际与非根际土壤无机氮形态差异
根际土壤硝态氮含量范围在14.21~ 32.16mg/kg,非根际土壤为8.35~18.66mg/kg,二者在不同植物之间均表现显著差异,且香附子最大,狗牙根次之,苍耳和玉米最小;除玉米外,其他3种植物根际土壤硝态氮含量显著高于非根际.植物根际效应提高了土壤铵态氮含量(玉米除外),且香附子和苍耳根际显著高于非根际,不同植物之间根际与非根际土壤铵态氮含量均表现为香附子显著高于其他3种植物,由于农田翻耕导致玉米根际与非根际土壤通气性高,而铵态氮在高氧分压条件下会被快速转化,因此含量较低.根际土壤亚硝态氮含量范围为0.020~0.060mg/kg,非根际土壤中为0.016~0.050mg/kg,根际土壤亚硝态氮含量狗牙根和香附子高于苍耳和玉米,非根际土壤亚硝态氮含量狗牙根>香附子>苍耳>玉米;除苍耳外,根际亚硝态氮含量均比非根际高,但无显著差异.
14d可矿化氮在不同植物根际与非根际土壤中变化较大,被认为可以较为敏感地表征植物根际效应下土壤氮含量变化[27].由图可见,香附子根际土壤可矿化氮含量最高,为77.38mg/kg,显著高于其它3种植物,玉米根际土壤可矿化氮含量最低,为32.80mg/kg,狗牙根与苍耳根际土壤可矿化氮含量差异不显著,但显著高于玉米;非根际土壤可矿化氮含量表现为香附子显著高于其它3种植物,狗牙根高于苍耳,高于玉米,但均无显著差异;狗牙根、香附子和苍耳根际土壤可矿化氮显著高于非根际,可见植物根际效应对土壤可矿化氮含量的影响显著.

表3 三峡库区典型植物群落根际与非根际土壤理化性质及富集率Table 3 Soil nutrients in the rhizosphere and non-rhizosphere of the four typical plant species in the littoral zone of three gorges reservoir (mean±SE, n=3)

图1 典型植物根际与非根际土壤硝态氮(mg/kg)、铵态氮(mg/kg)、可矿化氮(mg/kg)以及亚硝态氮(µg/kg)含量Fig.1 Nitrate N(mg/kg), ammonium N(mg/kg), mineralizable N(mg/kg), and nitrite N (µg/kg) contents in rhizosphere and non-rhizosphere soil under different vegetation types (mean ± SD)
2.3 典型植物根际与非根际土壤的氮素转化酶活性差异
酶活性是土壤肥力和微生物活性的重要表征[28],也是土壤养分转化的重要参与者,研究土壤酶活性变化对全面分析土壤生理生化和养分动力学相关的关键过程具有重要意义[29-30].
结果显示,除苍耳根际土壤脱氢酶低于非根际外,其他植物根际N素转化酶活性均高于非根际,不同植物根际土壤酶活性也有所差异.根际土壤蛋白酶活性以狗牙根最高,为0.660U,显著高于其他3种植物,玉米最低,为0.344U;非根际土壤蛋白酶活性也表现为狗牙根显著高于其他3种植物,苍耳>香附子>玉米,但无显著差异;除苍耳外,其他3种植物根际土壤蛋白酶活性均显著高于非根际,且香附子和狗牙根差异最大,分别增加0.167,0.135U.
4种植物根际土壤脲酶活性高于非根际,但均无显著差异;根际土壤脲酶活性香附子最大(74.4U),狗牙根次之(61.1U),苍耳和玉米较低(分别为42.8,38.1U);香附子和狗牙根根际与非根际相比,土壤脲酶活性分别提升了31.1%和37.3%,玉米根际效应对脲酶活性的影响最小.
根际与非根际土壤硝酸还原酶活性均表现为狗牙根显著高于其他3种植物,且香附子、苍耳、玉米之间没有显著差异;狗牙根和苍耳根际土壤硝酸还原酶活性显著高于非根际,分别增加1.87,1.07U.
亚硝酸还原酶在不同植物覆盖的土壤中变化最大,无论根际与非根际,狗牙根均最高(根际与非根际分别为0.433,0.858U),与其他3种植物达到显著差异,香附子次之,显著高于苍耳和玉米;仅有狗牙根根际亚硝酸还原酶活性显著高于非根际,提高了0.415U.
天冬酰胺酶的活性能够反映土壤中含氮有机物的转化能力.根际土壤天门冬酰胺酶活性在53.8~98.3U,不同植物类型之间存在显著差异,狗牙根>苍耳>香附子>玉米,非根际土壤具有相似规律;根际土壤天门冬酰胺酶活性均高于非根际,且除玉米外,其他3种植物均达到显著水平,以狗牙根根际效应对天门冬酰胺酶活性影响最大.
谷氨酰胺酶能够促使土壤谷氨酰胺的酰胺氮水解,生成谷氨酸和氨,是植物N源的重要组成.谷氨酰胺酶活性表现为香附子和狗牙根显著高于苍耳和玉米,根际土壤谷氨酰胺酶活性均高于非根际,且香附子和苍耳根际达到显著水平.
脱氢酶与土壤有机质和微生物活性具有一定相关性,对土壤有机质分解具有重要意义.除苍耳外,其他三种植物根际土壤脱氢酶活性高于非根际,但均无显著差异,根际土壤脱氢酶活性以狗牙根最高(0.334U),显著高于其他3种植物,香附子和玉米显著高于苍耳,但非根际土壤脱氢酶活性4种植物间没有显著差异.

表4 典型植物群落根际与非根际土壤N素转化酶活性Table 4 Soil enzyme activity of the rhizosphere and non-rhizosphere soils under different vegetation types (Mean ± SD)
2.4 典型植物根际与非根际土壤的氮素转化酶与无机氮形态的相关性分析
表5可以看出,土壤氮素转化酶之间存在明显的相关性,除脲酶与硝酸还原酶、天冬酰胺酶以及谷氨酰胺酶与硝酸盐还原酶、脱氢酶之间相关性没达到显著水平(P>0.05),其他均呈显著相关.硝态氮含量与蛋白酶、脲酶、亚硝酸还原酶、谷氨酰胺酶活性呈显著正相关关系,土壤铵态氮和硝态氮含量与脲酶、谷氨酰胺酶活性均呈极显著正相关关系.总氮与除脱氢酶外的其他N素转化酶类均呈显著相关,且与硝态氮、铵态氮有极显著相关关系,可矿化氮与蛋白酶、脲酶、谷氨酰胺酶有显著相关关系,与硝态氮、铵态氮、亚硝态氮以及总氮也存在显著相关性.蛋白酶、脲酶、谷氨酰胺酶与土壤N素形态存在显著相关关系,可见其可能是土壤N素转化的重要驱动者. 2.5 典型植物对土壤氮形态和N素转化酶的根际效应

表5 根际与非根际土壤酶活性、氮形态之间的相关性分析Table 5 Correlation coefficients between soil nitrogen forms and enzyme activity in rhizosphere and non-rhizosphere soils

图2 4种典型植物对土壤蛋白酶(PR),脲酶(UR),硝酸盐还原酶(NR),亚硝酸盐还原酶(SNR),天门冬酰胺酶(NS),谷氨酰胺酶(GL),脱氢酶(DE)和硝态氮、铵态氮、亚硝态氮、可矿化氮的根际效应差异

不同种植物对土壤生物地化过程的根际效应强度也存在显著差异[31],是植物根系和根际过程对土壤生态影响的重要指标.如图2所示,香附子根际效应对蛋白酶、脲酶、脱氢酶、硝态氮、铵态氮的影响最大,分别达到49%、37%、52%、 72%、78%,狗牙根对硝酸盐还原酶、亚硝酸盐还原酶的根际效应最大,分别达到73%和98%,苍耳对谷氨酰胺酶、铵态氮的根际效应最大,分别达到55%和63%,玉米对天门冬酰胺酶和亚硝态氮根际效应强度最大,分别达到50%和35%.总体上看,狗牙根对11个指标中9个指标根际效应强度>30%,香附子则对11个指标中10个指标的根际效应强度>30%,苍耳根际效应强度>30%的指标为5个,玉米为4个,计算同种植物对11个指标根际效应强度均值,狗牙根和香附子分别为45.8%和46.4%,高于苍耳和玉米的29.6%和23.3% (P= 0.04).
3 讨论
3.1 不同植物根际与非根际土壤养分与N形态
根际是围绕于植物活根的土壤微域,受到根系与微生物代谢的强烈影响,使得根际土壤理化性质与非根际土壤存在一定的差异[4,6].本研究表明,不同植物根际土壤有机质、全氮、全磷、有效磷含量均高于非根际,表现出明显的养分富集,这与多数研究结果一致[31-33].Cheng等[33]认为,植物17%以上的光合产物通过根系不断释放到根周土壤,直接提高土壤有机碳及其他养分总量,同时促使根围微生物的快速生长固定大量养分,进而表现为根际土壤养分含量高于非根际.不同植物根际对根际土壤养分富集特性差异明显[34],本研究中狗牙根和香附子根际效应对土壤理化性质的影响高于苍耳和玉米.由于植物根际环境pCO2变化、阳离子不平衡吸收、根系酸性分泌物产生等导致根际土壤pH值偏低[35],本研究4种植物根际土壤pH值均低于非根际,这也与Zhang等[32]研究结果一致.
植物生长能够通过根系和根际过程对土壤N素循环产生影响,并进一步影响生态系统N循环模式.Yin等[26]对两种乔木根际N转化研究结果表明,N矿化速率和硝化速率均显著高于非根际土壤,Nie等[36]研究表明,水稻根际土壤氨氮、溶解性有机氮、微生物量氮显著低于非根际,硝态氮与非根际没有显著差异,而本研究中不同植物根际硝态氮、铵态氮、亚硝态氮均高于非根际,尤其14d可矿化氮显著高于非根际(玉米除外).不同植物根际效应对N素转化影响程度不同[31,36-37],香附子根际与非根际土壤不同形态无机氮含量均为最高,玉米和苍耳根际与非根际土壤硝态氮、亚硝态氮以及14d可矿化氮均低于香附子和狗牙根,朱秋莲等[27]研究宁南山区典型植物根际与非根际氮形态也表明不同植物根际14d可矿化氮差异显著,本研究不同植物非根际土壤的N形态差异也进一步表明,不同植被覆盖对土壤可矿化氮含量的改变是影响消落带土壤氮循环的重要因素.
3.2 不同植物根际与非根际土壤N素转化酶活性及其与土壤N形态相关性
酶活性可作为不同环境条件下微生物活性和物质循环效率重要表征[37],其是参与根际微环境生物地化循环的重要中间物质[38],受到植物根系、微生物活性和土壤性质的影响.大量研究表明,植物根系会直接向根际土壤分泌大量酶,同时微生物在根际土壤的大量繁殖也分泌各种胞外酶,从而导致根际土壤酶活性高于非根际[29,30,39-40].少量研究表明,植物根际土壤脲酶[41]、硝酸盐还原酶[25]、亚硝酸还原酶[25]低于非根际.本研究结果表明,4种植物根际土壤N转化酶活性总体上高于非根际(苍耳脱氢酶除外),这与大部分关于植物根际土壤酶活性的研究结果一致,但与Weng等[25]结果有差异,可能与消落带土壤环境和植物根系差异有关,但缺乏直接证据;脲酶、亚硝酸还原酶、谷氨酰胺酶、脱氢酶在狗牙根和香附子覆盖土壤显著高于玉米和苍耳覆盖区,可见不同植物覆盖对消落带土壤N循环影响不同,进一步反映根际土壤微生物活性存在差异.
在土壤N转化过程中N素转化酶起着重要作用[25,30,41],Weng等[25]研究表明,硝酸还原酶、亚硝酸还原酶、酰胺酶活性与根际、非根际土壤N形态有一定相关性.本研究中,4种植物根际与非根际土壤N形态与N素转化酶之间存在一定相关性,表明植物根际与非根际N转化酶变化是不同植物根际N形态差异的重要原因,其中蛋白酶、脲酶、谷氨酰胺酶与土壤N素形态相关性较高,可能是消落带土壤N素转化的主要参与酶类.总之,植物覆盖通过提高微生物活性来促进土壤N固定和矿化,对土壤N保持具有重要意义.
3.3 不同植物对土壤N素转化的根际效应强度差异
植物根系向土壤中释放新鲜有机物,刺激微生物的快速繁殖和大量胞外酶的释放,进而促进土壤有机物分解[42]和N素循环的改变[43].不同植物根系生理特征的差异引起根际对土壤微环境影响的差异,这些可以通过根际土壤酶活性的增加[37-39,42]和N素转化状态[44]得以呈现.本研究参考Yin等[31]的方法评估不同植物对N素转化的根际效应强度差异,结果表明狗牙根和香附子覆盖对土壤N转化的根际效应高于苍耳和玉米,狗牙根和香附子在消落带的覆盖对与土壤N素矿化和固定的影响高于苍耳和玉米,有利于土壤N素的保持.总之,植物根际能够通过根系吸收、根系沉积、微生物过程等影响根际养分循环,也进一步影响植物生长、土壤养分保持和生态系统稳定,因此需要进一步针对不同植物覆盖下消落带土壤N循环和微生物过程展开深入探讨.
4 结论
4.1 4种供试植物根际土壤pH值均低于非根际,有机质、全氮、全磷含量均高于非根际,表明植物根际对消落带土壤养分有富集作用.
4.2 植物根际土壤硝态氮、铵态氮、亚硝态氮及14d可矿化氮含量均高于非根际,且土壤硝态氮、亚硝态氮以及14d可矿化氮含量呈现香附子>狗牙根>苍耳/玉米.
4.3 狗牙根和香附子覆盖区脲酶、亚硝酸还原酶、谷氨酰胺酶、脱氢酶显著高于玉米和苍耳覆盖区;蛋白酶、脲酶、谷氨酰胺酶活性与4种N形态均呈显著相关性,是消落带土壤N转化的主要参与酶类.
4.4 根际效应分析结果香附子和狗牙根对消落带土壤N转化的根际效应强度大于苍耳和玉米,有利于土壤N素的固定和保持.
[1]Lynch J P. Root architecture and plant productivity [J]. Plant Physiology, 1995,109(1):7-13.
[2]Youry P, Alexander P, Roberto T, et al. Plant-microorganism-soil interactions influence the Fe availability in the rhizosphere of cucumber plants [J]. Plant Physiology and Biochemistry, 2015,87:45-52.
[3]Cairney J W, Meharg A A. Interactions between ectomycorrhizal fungi and soil saprotrophs: implications for decomposition of organic matter in soils and degradation of organic pollutants in the rhizosphere [J]. Canadian Journal of Botany, 2002,80(8):803-809.
[4]Diana K O, Diego Z, José A G, et al. Degradation of benzene,toluene, and xylene isomers by a bacterial consortium obtained from rhizosphere soil of Cyperus sp. grown in a petroleumcontaminated area [J]. Folia Microbiologica, 2013,58(6):569-577.
[5]Wang Z Y, Xu Y, Zhao J, et al. Remediation of petroleum contaminated soils through composting and rhizosphere degradation [J]. Journal of Hazardous Materials, 2011,190(1-3):677-685.
[6]Josef K, Fuensanta C, Antonio R. Effect of drought on the stability of rhizosphere soil aggregates of Lactuca sativa grown in a degraded soil inoculated with PGPR and AM fungi [J]. Applied Soil Ecology, 2009,42(2):160-165.
[7]Schenkeveld W D C, Kraemer S M. Equilibrium and kinetic modelling of the dynamic rhizosphere [J]. Plant and Soil,2015,386:395-397.
[8]马栋山,熊 薇,张琼琼,等.基于T-RFLP和因子分析的香蒲根际细菌群落研究 [J]. 中国环境科学, 2014,34(10):2684-2691.
[9]Zhang C, Liu G B, Xue S, et al. Changes in rhizospheric microbial community structure and function during the natural recovery of abandoned cropland on the Loess Plateau, China [J]. Ecological Engineering, 2015,75:161-171.
[10]Roberto T, Stefano C, Tanja M. Dynamics, thermodynamics and kinetics of exudates: crucial issues in understanding rhizosphere processes [J]. Plant and Soil, 2015,386(1/2):399-406.
[11]Lynch J P. Root architecture and productivity [J]. Plant Physiology, 1995,109:7-13.
[12]Yuan X Z, Zhang Y W, Liu H, et al. The littoral zone in the Three Gorges Reservoir, China: challenges and opportunities [J]. Environmental Science and Pollution Research, 2013,20(10):7092-7102.
[13]Wang Q, Yuan X Z, Martin W J H, et al. Diversity and Above-Ground Biomass Patterns of Vascular Flora Induced by Flooding in the Drawdown Area of China's Three Gorges Reservoir [J]. PLOS One, 2014,9(6):e100889.
[14]Wang Q, Yuan X Z, Liu H, et al. Effect of Long-Term Winter Flooding on The Vascular Flora in The Drawdown area of the three Gorges Reservoir, China [J]. Polish Journal of Ecology,2012,60(1):95-106.
[15]Sun R, Deng W Q, Yuan X Z, et al. Riparian vegetation after dam construction on mountain rivers in China [J]. Ecohydrology,2014,7(4):1187-1195.
[16]孙 荣,刘 红,丁佳佳,等.三峡水库蓄水后开县消落带植物群落数量分析 [J]. 生态与农村环境学报, 2011,27(1):23-28.
[17]Zhang B, Fang F, Guo J S, et al. Phosphorus fractions and phosphate sorption-release characteristics relevant to the soil composition of water-level-fluctuating zone of Three Gorges Reservoir [J]. Ecological Engineering, 2012,40:153-159.
[18]Ye C, Cheng X L, Zhang Y L, et al. Soil nitrogen dynamics following short-term revegetation in the water level fluctuation zone of the Three Gorges Reservoir, China [J]. Ecological Engineering, 2012,38:37-44.
[19]Chen Z B, Zhou Z Y, Peng X, et al. Effects of wet and dry seasons on the aquatic bacterial community structure of the Three Gorges Reservoir [J]. World Journal of Microbiology and Biotechnology,2013,29(5):841-853.
[20]Phillips R P, Fahey T J. Tree species and mycorrhizal associations influence the magnitude of rhizosphere effects [J]. Ecology,2006,87,1302-1313.
[21]Riley D, Barber S A. Salt accumulation at the soybean root soil interface [J]. Soil Science Society of America Journal, 1970,34:154-155.
[22]鲍士旦主编.土壤农化分析 [M]. 3版.北京:中国农业出版社,2000,49-61.
[23]Chu H Y, Zhu J G, Xie Z B, et al. Effects of lanthanum on dehydrogenase activity and carbon dioxide evolution in a HaplicAcrisol [J]. Australian Journal of Soil Research, 2003,41:731-739.
[24]关松荫.土壤酶及其研究法 [M]. 北京:农业出版社, 1986:260-359.
[25]Weng B S, Xie X Y, Yang J J, et al. Research on the nitrogen cycle in rhizosphere of Kandelia obovata under ammonium and nitrate addition [J]. Marine Pollution Bulletin, 2013,76:227-240.
[26]Yin H J, Xu Z F, Chen Z, et al. Nitrogen transformation in the rhizospheres of two subalpine coniferous species under experimental warming [J]. Applied Soil Ecology, 2012,59:60-67.
[27]朱秋莲,邢肖毅,程 曼,等.宁南山区典型植物根际与非根际土壤碳、氮形态 [J]. 应用生态学报, 2013,24(4):983-988.
[28]Badiane N N Y, Chotte J L, Pate E, et al. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions [J]. Applied Soil Ecology, 2001,18:229-238.
[29]Wang B, Xu S, Liu G B, et al. Changes in soil nutrient and enzyme activities under different vegetations in the Loess Plateau area, Northwest China [J]. Catena, 2012,92:186-195.
[30]Schimel J P, Weintraub M N. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil: a theoretical model [J]. Soil Biology and Biochemistry, 2003,35,549-563.
[31]Zhao Q, Zeng D H, Fan Z P. Nitrogen and phosphorus transformations in the rhizospheres of three tree species in a nutrient-poor sandy soil [J]. Applied Soil Ecology, 2010,46:341-346.
[32]Zhang C, Liu G B, Sha X, et al. Rhizosphere soil microbial activity under different vegetation types on the Loess Plateau,China [J]. Geoderma, 2011,161:115-125.
[33]Cheng W. Rhizosphere priming effect: its functional relationships with microbial turnover, evapotranspiration, and C-N budgets [J]. Soil Biology and Biochemistry, 2009,41:1795-1801.
[34]Turpault M P, Utérano C, Boudot J P, et al. Influence of mature Douglas fir roots on the solid soil phase of the rhizosphere and its solution chemistry [J]. Plant and Soil, 2005,275:327-336.
[35]Hinsinger P, Plassard C, Tang C, et al. Origins of root mediated pH changes in the rhizosphere and their responses to environmental constraints: a review [J]. Plant and Soil, 2003,248:43-59.
[36]Nie S A, Xu H J, Li S, et al. Relationships Between Abundance of Microbial Functional Genes and the Status and Fluxes of Carbon and Nitrogen in Rice Rhizosphere and Bulk Soils [J]. Pedosphere,2014,24(5):645-651.
[37]Mahmoud S A Z, Ishac Y Z, Alaa El-Din M N, et al. Nitrogen transformations in soil and rhizosphere of rice plants [J]. Zentralblatt für Mikrobiologie, 1984,139:157-162.
[38]Boerner R E J, Brinkman J A, Smith A. Seasonal variations in enzyme activity and organic carbon in soil of a burned and unburned hardwood forest [J]. Soil Biology and Biochemistry,2005,37:1419-1426.
[39]TrasarC C, Gil S F, Leirós M C. Thermodynamic parameters of enzymes in grassland soils from Galicia, NW Spain [J]. Soil Biology and Biochemistry, 2007,39,311-319.
[40]Yuan L, Huang J, Yu S. Responses of nitrogen and related enzyme activities to fertilization in rhizosphere of wheat [J]. Pedosphere, 1997,7:141-148.
[41]邱 权,李吉跃,王军辉,等.西宁南山4种灌木根际和非根际土壤微生物、酶活性和养分特征 [J]. 生态学报, 2014,34(24):7411-7420.
[42]Phillips R P, Finzi A C, Bernhardt E S. Enhanced root exudation induces microbial feedbacks to N cycling in a pine forest under elevated long-term CO2fumigation [J]. Ecology Letters, 2011,14:187-194.
[43]Zhu B, Cheng W X. Rhizosphere priming effect increases the temperature sensitivity of soil organic matter decomposition [J]. Global Change Biology, 2011,17:2172-2183.
[44]Kuzyakov Y, Xu X L. Tansley review: competition between roots and microorganisms for nitrogen: mechanisms and ecological relevance [J]. New Phytologist, 2013,198:656-669.
Inorganic nitrogen forms and related enzyme activity of rhizosphere soils under typical plants in the littoral zone of Pengxi River.
WANG Xiao-feng1,2,3, LIU Hong1,3*, ZHANG Lei4, LUO Zhen5, YUAN Xing-zhong1,2,3, YUE Jun-sheng1,2,3, YU Jian-jun4(1.State Key Laboratory of Coal Mine Disaster Dynamics and Control, Chongqing University,Chongqing 400030, China;2.Key Laboratory of Three Gorges Reservoir Region's Eco-Environment, Ministry of Education, Chongqing University, Chongqing 400030, China;3.College of Resource and Environmental Science,Chongqing University, Chongqing 400030, China;4.College of Resources and Environment, Southwest University,Chongqing 400716, China;5.College of Military Preventive Medicine, Third Military Medical University, Chongqing 400038, China). China Environmental Science, 2015,35(10):3059~3068
The Three Gorges Reservoir (TGR), which is the largest water conservancy project ever built in the world,produced a drawdown area of about 348.93km2due to flooding control. The biological geochemical cycle of the soil in the drawdown zone has been changed as the result of long-term winter flooding and summer drought and vegetation covering. The loss of soil nitrogen in the drawdown zone poses a threat to the water environmental in TGR. Pengxi River, which has the largest drawdown area among all of the tributaries in TGR basin has been selected in present study. The four typical vegetation types, Cynodon dactylon, Cyperus rotundus, Anthium sibiricum and Zea mays L as control, were studied to measure nutrient characteristics and nitrogen forms of rhizosphere and non-rhizosphere soils. The variables included soil physical-chemical proprieties, ammonium nitrogen), nitrate nitrogen), nitrite nitrogen,nitrogen mineralization in 14d (NN) and 7 types N invertase enzymes including protease (PR), urease (UR), nitrate reductase (NR), nitrite reductase (SNR), dehydrogenase (DE), glutaminase (GL) and asparaginase (AS). The resultsshowed: 1) pH of rhizosphere soil was generally lower than non-rhizosphere soil under different vegetation in different type soils because of the possible organic acid and H+released from plant roots and cation absorption differences. All nutrient concentrations in rhizosphere soil were higher than those in non-rhizosphere except potassium (Total K and available K). 2),,and NN of rhizosphere soil were generally higher than non-rhizosphere soil,by following the order of Cyperus rotundus>Cynodon dactylon>Anthium sibiricum and Zea mays L under different vegetation. 3) All 7 types invertases showed the better activeness in the rhizosphere soil compared with them under non-rhizosphere. UR, SNR, DE and GL in the zone covered by Cyperus rotundus and Cynodon dactylon were significantly higher than those in Anthium sibiricum and Zea maysL. 4) There was significant correlation between soil N forms and PR, UR and GL.was significantly correlated with SNR. Rhizosphere effects on all N forms and invertase enzyme activity were done to evaluate the incidence of the soil N cycle by different vegetations, and results showed that rhizosphere effects of Cyperus rotundus and Cynodon dactylon were greater than those of Anthium sibiricum and Zea mays L. The present research could provide that the drawdown zone covered with different vegetations has different soil processes and function for N cycle, so the vegetation recovery in the drawdown zone should consider the rhizosphere effect of different vegetations on N cycle.
drawdown zone;rhizosphere soils;nitrogen transformation;typical plants;enzyme activity
X53,S182
A
1000-6923(2015)10-3059-10
王晓锋(1987-),男,河南三门峡人,重庆大学博士研究生,主要研究方向为湿地生态学.发表论文15篇.
2015-02-09
国家重大科技专项(2013ZX07104-004-05)
* 责任作者, 副教授, hliu63@sina.com
