体外鉴定衣原体质粒侵袭细胞相关毒力基因
2015-11-07毕田田王娜侯淑萍刘原君岑醒洪王惠平
毕田田 王娜 侯淑萍 刘原君 岑醒洪 王惠平
体外鉴定衣原体质粒侵袭细胞相关毒力基因
毕田田 王娜 侯淑萍 刘原君 岑醒洪 王惠平
目的 比较几种转化沙眼衣原体鼠肺炎株(MoPn)对宿主细胞的感染力,鉴定与衣原体质粒侵袭细胞相关的毒力基因。方法 培养携带敲除了不同开放阅读框架(ORF)质粒的转化菌株,并不断扩增收集。测定浓度后,以相同菌量接种并按离心+二乙胺乙基葡聚糖(DEAE)、离心、DEAE、无任何处理4个条件分别对菌株进行处理,采用间接免疫荧光法计数包涵体数目;分别于(20、40、60 h)观察各菌株连续3代感染细胞后菌斑形成速度与面积。用Lugol碘染色观察各菌株包涵体内糖原合成情况。结果 敲除质粒编码蛋白Pgp4的菌株 pGFP::CMΔPgp4在 4种条件下包涵体数目分别为(10.20±1.30)、(6.80±0.44)、(3.00±1.22)、(0.80±0.45)个,阴性对照组质粒缺失株CMUT3包涵体数目分别为(6.40±0.89)、(3.80± 0.83)、(1.60±0.89)、(0.60± 0.54)个,同一条件下两者均表现出相近的感染力,包涵体数目均低于同一条件下其他菌株(均P<0.01)。同一菌株不同条件下,包涵体数目差异有统计学意义(F=845.310,P<0.01),各菌株在离心+DEAE条件下包涵体数目最多;连续3代感染细胞时菌斑形成速度和大小均低于其他菌株;并有糖原累积的障碍。结论 Pgp4是衣原体质粒侵袭细胞相关的毒力基因之一。
沙眼衣原体;质粒;包涵体;毒力;基因;体外研究
沙眼衣原体(Chlamydia trachomatis,Ct)感染在全球呈增长态势,已居性传播疾病首位[1]。Ct感染与输卵管阻塞关系密切,是造成不孕不育的主要原因之一[2-3]。Ct对输卵管的致病机制尚不明确,许多实验室对衣原体质粒缺失株和野生株进行了对比性研究,发现质粒缺失株在体内实验中对于动物组织引起的病变均明显低于野生株,甚至不引起病变[4-6]。研究发现,决定输卵管病变的毒力基因位于衣原体质粒上[7],但迄今尚未鉴定出具体的毒力基因。Ct质粒长约7.5 kb,共编码8个开放阅读框架(ORF)pORF1-8[8],导致输卵管病变的基因或许在这8个ORF中,毒力基因可能是一个或多个ORF,在感染的过程中表达8种蛋白,分别为质粒编码蛋白 Pgp1-8。在转录水平上发现,Pgp1、2、6、8 对于维持质粒的稳定性是必须的,无法进行基因敲除。目前已成功敲除Pgp3、4、5、7,并构建了重组质粒的转化菌株[9],在此基础上,本实验旨在体外实验中初步鉴定毒力基因并探索其致病的机制,为临床治疗Ct感染提供新的思路。
作者单位:300052天津医科大学总医院皮肤科(毕田田、侯淑萍、刘原君、岑醒洪、王惠平);兰陵县妇幼保健院检验科(王娜)
资料与方法
一、资料
1.细胞及菌株来源:Hela细胞系由天津市性传播疾病研究所细胞培养室保存。鼠肺炎型沙眼衣原体菌株:WT为野生株,CMUT3为质粒缺失株,pGFP::CM为鼠型沙眼衣原体Mopn菌株质粒CM与pGFP载体融合菌株。pGFP上携带氨苄西林的抗性基因,可用含氨苄西林的培养基对融合成功的质粒进行筛选,pGFP载体还可以表达发绿色荧光的蛋白。pGFP::CMΔPgp3、4、5、7分别为敲除开放阅读框不同基因的质粒携带株。各菌株原体EB来自美国得克萨斯大学圣安东尼奥医学科学中心钟光明教授实验室,保存于-80℃中备用。
2.主要试剂:细胞培养液(含Earlys盐的MEM培养基,10%胎牛血清,50 mg/L庆大霉素);衣原体感染液(细胞培养液中加入两性霉素B、万古霉素和1 mg/L放线菌酮);二乙胺乙基葡聚糖(DEAE-D);细胞消化液:0.25%胰酶液与0.02%乙二胺四乙酸(EDTA)的混合液,两者体积比 1∶3,0.2 μm 抽滤器抽滤灭菌;SPG磷酸盐缓冲液:蔗糖74.62 g,磷酸二氢钾0.512 g,磷酸氢二钾1.237 g,L谷氨酸0.845 g,溶于800 ml水中,用10 mol/L NaOH调节至7.2,用纯水调节最终体积至1L,0.2 μm滤器抽滤灭菌,分装后4℃保存;一抗为单克隆抗体MC22(鼠抗沙眼衣原体主要外膜蛋白MOMP蛋白),来自美国得克萨斯大学圣安东尼奥医学科学中心钟光明教授实验室;二抗为FITC标记山羊抗小鼠IgG,来自北京中杉金桥生物技术有限公司。
3.主要器材:6孔细胞培养板、24孔细胞培养板、细胞刮子购自美国Costar公司,超净工作台购自天津市医疗器械工业公司医药净化设备厂。
二、方法
1.细胞培养:将Hela细胞从液氮罐中复苏培养成功后,接种到6孔培养板,在5%CO2温箱37℃培养16~24 h,待细胞长成致密单层后吸出培养液,每孔加入30 mg/L DEAE-D 2 ml室温下作用30 min。
2.沙眼衣原体的培养与扩增:吸出各细胞孔中的DEAE-D液,加离心液(不加血清的DMEM液),将冻存于-80℃的上述菌株常温解冻,倍比稀释后接种于预先放置有载玻片的24孔板上,32℃1 200×g离心1 h,5%CO2孵箱37℃培养20~24 h。采用间接免疫荧光技术检测包涵体以确定衣原体培养成功,并观察不同稀释度下各菌株的感染率。在6孔板中进行衣原体的扩增,扩增时选用感染率达60%左右的稀释浓度进行接种,扩增数代后,选用1 000 ml SPG收集2个6孔板的衣原体,每管50 μl分装至无菌的微量离心管中,-80℃保存,待测衣原体浓度。
3.间接免疫荧光法对沙眼衣原体浓度的测定:将不同菌株按 1 ∶1 000、1 ∶2 000、1 ∶4 000……倍比稀释后接种于预先放置有载玻片的24孔板中,培养20~24 h后,吸出细胞培养孔中的衣原体感染液,用预冷的PBS洗涤;冰甲醇固定单层细胞10 min;经预冷PBS洗涤1遍;用200~500 μl含10%胎牛血清的DMEM液封闭放于4℃8 h;加入一抗(1∶40稀释)200 μl,4℃过夜;PBS清洗 6遍;加入二抗(1∶80稀释)50 μl避光放于37℃孵箱中1 h;PBS洗涤3~6遍;缓冲甘油封片,荧光显微镜(×400)观察计数,计算不同菌株的浓度。每ml包涵体形成单位(IFU)=镜下包涵体个数×876.16×稀释倍数×(1 000/实际体积)。
4.在4种条件下计数包涵体:不同菌株均以1.5×104IFU接种,每个菌株接种时均设置4个不同的条件(离心+DEAE、离心、DEAE、无任何处理),培养20~24 h后,间接免疫荧光法计数不同条件每孔包涵体的数目。计数时每孔计数5个不同的视野最后计算平均值。
5.菌斑形成情况:将不同菌株按能达相近的感染率(约10%)时的菌量接种,衣原体感染宿主细胞后,分别在20、40、60 h固定细胞,免疫荧光染色,观察不同菌株连续3代感染细胞后的菌斑形成情况。
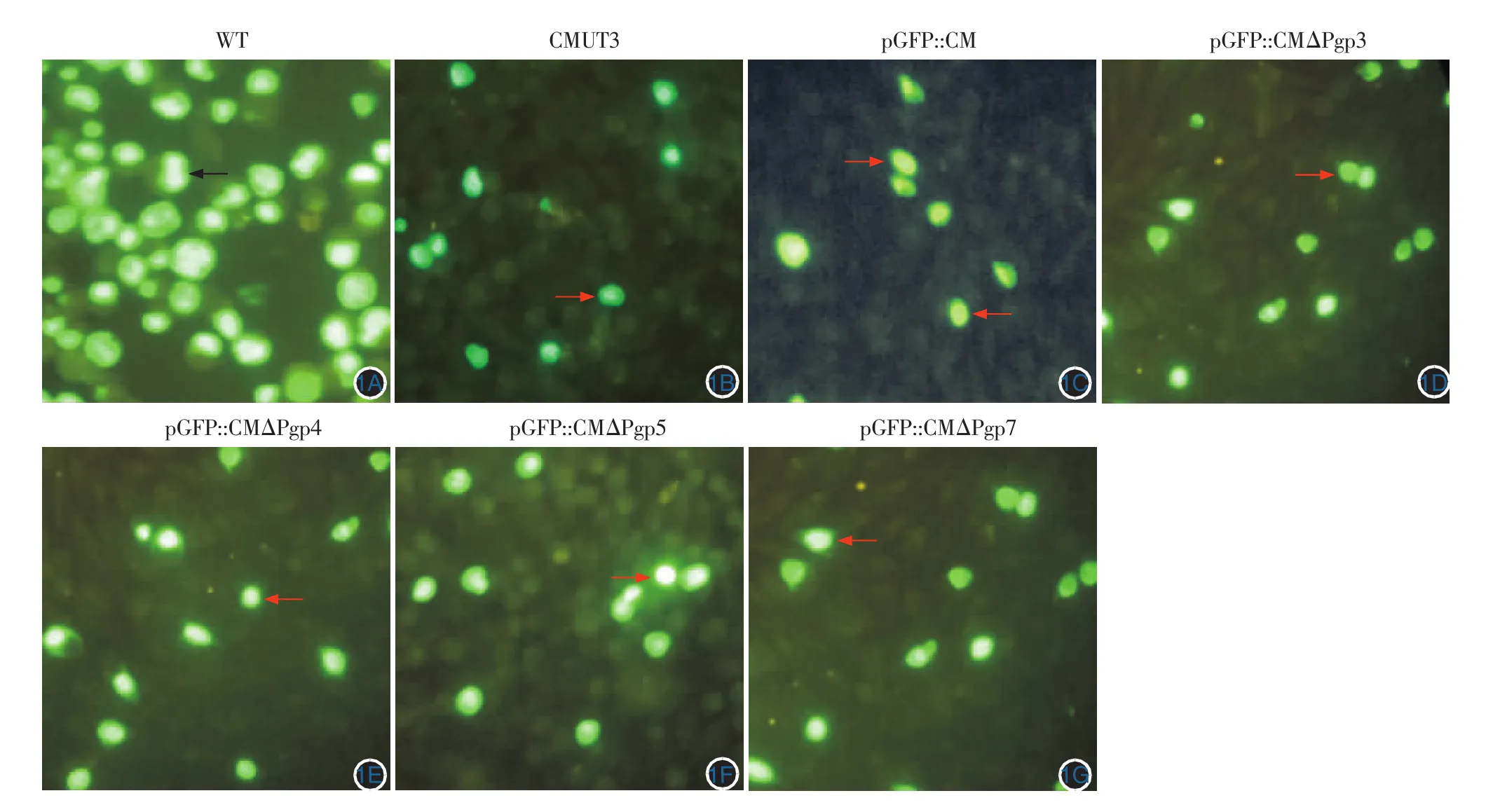
图1 接种培养后通过间 接免疫荧光检测包涵体(箭头,免疫荧光× 400) 1A ~ 1G:分别表示野生株WT、质粒缺失株CMUT3、融合菌株pGFP::CM、转化菌株pGFP::CMΔPgp3、pGFP::CMΔPgp4 、pGFP : : CMΔPgp5 、pGFP::CMΔPgp7;培养后均见包涵体形成
6.沙眼衣原体包涵体Lugol碘液染色检查:吸出细胞培养孔中的衣原体感染液,自然风干或者吹干后,用冰甲醇固定单层细胞10 min,Lugol碘液母液用蒸馏水稀释4~5倍后染色,观察不同菌株的包涵体内糖原染色情况。
三、统计学分析
各组实验重复3次,用SPSS 17.0统计软件进行数据分析。所有数据用±s表示,同一条件下菌株pGFP::CMΔPgp4与其他菌株包涵体数目的比较和不同条件下同一菌株间包涵体数目之间的比较,采用析因设计的方差分析,P<0.05为差异有统计学意义。
结 果
一、接种培养后通过间接免疫荧光检测包涵体
免疫荧光显微镜下观察(×400),可见亮绿色、具有直径2~3 mm典型大小中强绿色的点状或团块状荧光即为包涵体,见图1。

表1 各衣原体菌株浓度测定结果
二、各衣原体菌株浓度测定的结果
不同稀释浓度的菌株接种培养20~24 h后,按条件(离心+DEAE)进行处理,采用间接免疫荧光法,×400免疫荧光显微镜下观察并计数每孔包涵体数目,每个稀释浓度计数5个视野,按公式计算所收集的微量离心管管中衣原体浓度。见表1。
三、体外检测各菌株感染能力
按相同的菌量(1.5×104IFU)接种,比较各转化菌株在不同条件侵袭和粘附宿主细胞的能力。阳性对照组为野生株WT,阴性对照组为质粒缺失株CMUT3。见图2。
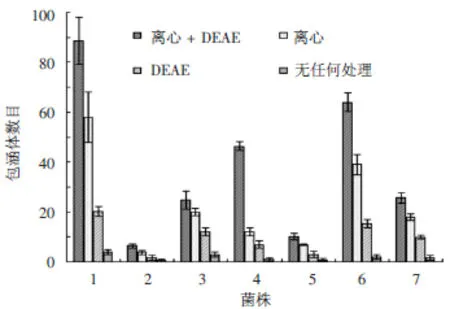
图2 不同条件下不同菌株包涵体数目 1:WT;2:CMUT3;3:pGFP::CM;4:pGFP::CMΔPgp3;5:pGFP::CMΔPgp4;6:pGFP::CMΔPgp5;7:pGFP::CMΔPgp7
析因分析提示不同条件之间各菌株包涵体数目差异有统计学意义(F=845.310,P<0.01),离心+DEAE条件下包涵体数目最多,无任何处理时包涵体数目最少,提示离心和DEAE均能增强毒力基因在体外对宿主细胞的侵袭和粘附能力;相同条件下pGFP::CMΔPgp4与 WT,pGFP::CM,pGFP::CMΔPgp3,pGFP::CMΔPgp5,pGFP::CMΔPgp7两两比较,包涵体数目均较低,差异有统计学意义,(F值分别为558.036,801.825,234.146,1324.473,121.784,均P<0.01),提示Pgp4是衣原体质粒侵袭细胞相关的毒力基因之一;不同条件和不同菌株之间交互效应显著(F=89.645,P<0.01)。
四、各菌株菌斑形成能力的检测
菌斑形成实验是用来检测衣原体在细胞与细胞之间的传播能力的方法之一。本实验中,各菌株连续3代感染细胞后,在相同时间段(感染后20、40、60 h)观察各菌株菌斑形成的速度及大小,结果发现,在相同感染率接种的情况下,相同时间段野生株菌斑形成速度最快,面积最大;质粒缺失株菌斑形成速度慢,面积小;Pgp4敲除的菌株菌斑形成速度与面积均低于其他菌株,提示Pgp4基因影响衣原体在细胞与细胞之间的传播能力。
五、各菌株糖原合成能力的检测
倒置显微镜下观察包涵体内糖原染色,野生株和毒力基因携带株中糖原染色阳性,包涵体呈红褐色或棕褐色。质粒缺失株CMUT3和质粒敲除株pGFP::CMΔPgp4糖原染色阴性,提示Pgp4基因影响糖原的积累。见图3。
讨 论
衣原体质粒是一个相对分子质量小,基因序列高度保守的双链环状DNA分子。广泛存在于多种衣原体中,其中包括沙眼衣原体及鼠肺炎衣原体。通过质粒缺失株和野生株的对比性研究,发现质粒是参与衣原体致病的毒力因子[10]。质粒缺失株的成功转化,为研究质粒携带株的致病性提供了分子学基础,为鉴定出具体的毒力基因,阐明致病机制提供可能。
沙眼衣原体的自然宿主是人,虽然它能成功感染小鼠的下生殖道,但却不能引起小鼠输卵管的病变,沙眼衣原体鼠肺炎株(MoPn)也称为鼠肺炎衣原体,现已划分为一个新的衣原体种(Chlamydia muridarum)[11],经证实不仅可以感染小鼠的生殖道,而且还可引起输卵管的病变[12],与女性泌尿生殖道Ct感染后的疾病发展过程一致[13]。目前,MoPn鼠生殖道感染模型已被广泛应用于Ct致病机制及疫苗研发等方面的研究[11]。目前运用基因重组技术已成功构建了重组质粒pGFP::CM,并成功转化了质粒缺失株CMUT3。Pgp1,2,6,8是维持质粒基本结构的因子,故目前只成功敲除了Pgp3、4、5、7并构建各转化菌株[14]。转化成功的菌株命名为 pGFP::CMΔPgp3、pGFP::CMΔPgp4、pGFP::CMΔPgp5、pGFP::CMΔPgp7[15]。
在体外试验中,相同菌量接种培养时,质粒缺失株CMUT3和Pgp4敲除的菌株免疫荧光显微镜下计数包涵体数目均明显低于其他菌株,提示质粒缺失株CMUT3和Pgp4敲除的菌株对宿主细胞的感染能力低于其他菌株。碘染时两菌株均出现包涵体内糖原染色障碍,提示Pgp4是与毒力基因密切相关的转录调节因子并影响包涵体内糖原的合成;以相同感染率接种培养相同时间观察各菌株菌斑形成情况发现,Pgp4敲除的菌株与质粒缺失株菌斑形成速度与面积均低于其他菌株,提示毒力基因Pgp4影响衣原体在细胞与细胞之间传播的能力,可为动物实验鉴定影响衣原体上行感染能力的毒力基因提供基础。Pgp4是质粒编码的开放阅读框中最小的片段,编码102个氨基酸[15],质粒编码的许多基因的表达都依赖于Pgp4[14],无论是在沙眼衣原体或者鼠型沙眼衣原体感染中,均已证实Pgp4是一个正转录调节因子[15]。

图3 碘染色在倒置显微镜下观察衣原体包涵体(箭头,碘染色 × 100) 3A、3C、3D、3F、3G:分别表示野生株、融合菌株pGFP::CM、转化菌株pGFP::CMΔPgp3、pGFP::CMΔPgp5、pGFP::CMΔPgp7,均可见棕褐色包涵体形成;3B、3E:分别表示质粒缺失株和pGFP::CMΔPgp4菌株细胞内均未见包涵体形成
本研究还对衣原体的培养设定了4种条件:离心+DEAE、离心、DEAE-D、无任何处理。4种条件下,Pgp4敲除的菌株间接免疫荧光结果显示包涵体形成数目均最少,离心+DEAE-D的条件下,各菌株包涵体形成数目均最多,提示DEAE和离心都能增加衣原体毒力基因对宿主细胞的侵袭和粘附能力。离心作用的原理是通过离心力使衣原体粒子容易沉淀在细胞表面而提高感染率,DEAE-D的强化作用可能是其带正电荷因而同带负电的沙眼衣原体结合起到一种吸附作用。本研究在国内首次采用基因敲除的重组质粒菌株来感染细胞,在体外试验中初步鉴定出侵袭细胞的毒力基因Pgp4,为进一步进行动物实验提供一定基础。
[1]杨晓静,杨丽娜,姜勇,等.天津地区泌尿生殖道沙眼衣原体临床株药敏分析[J].中华皮肤科杂志,2009,42(5):352-354.
[2]Kari L,Goheen MM,Randall LB,et al.Generation of targetedChlamydia trachomatisnull mutants[J].Proc Natl Acad Sci U S A,2011,108(17):7189-7193.
[3]Hou S,Lei L,Yang Z,et al.TheChlamydia trachomatisouter membrane complex protein B(OmcB)is processed by the protease CPAF[J].J Bacteriol,2013,195(5):951-957.
[4]Lei L,Chen J,Hou S,et al.Reduced live organism recovery and lack of hydrosalpinx in mice infected with plasmid-freeChlamydia muridarum[J].Infect Immun,2014,82(3):983-992.
[5]Carlson JH,Whitmire WM,Caldwell HD,et al.TheChlamydia trachomatisplasmid is a transcriptional regulator of chromosomal genes and a virulence factor[J].Infect Immun,2008,76(6):2273-2283.
[6]O′Connell CM,AbdelRahman YM,Green E,et al.Toll-like receptor 2 activation byChlamydia trachomatisis plasmid dependent,and plasmid-responsive chromosomal loci are coordinately regulated in response to glucose limitation byC.trachomatisbut not byC.muridarum[J].Infect Immun,2011,79(3):1044-1056.
[7]侯淑萍.衣原体质粒的研究进展[J].微生物学通报,2013,40(5):866-870.
[8]Li Z,Chen D,Zhong Y,et al.The chlamydial,plasmid-encoded protein pgp3 is secreted into the,cytosol ofChlamydia-infected cells[J].Infect Immunity,2008,76(8):3415-3428.
[9]LiuY,ChenC,GongS,etal.TransformationofChlamydiamuridarumreveals a role for Pgp5 in suppression of plasmid-dependent gene expression[J].J Bacteriol,2014,196(5):989-998.
[10]Russell M,Darville T,Chandra-Kuntal K,et al.Infectivity acts asin vivoselection for maintenance of the Chlamydial cryptic plasmid[J].Infection Immun,2011,79(1):98-107.
[11]陈丽丽,吴移谋,周洲,等.MyD88在鼠衣原体生殖道感染过程中的作用[J].微生物学通报,2010,37(6):937-942.
[12]刘勇,刘原君,姚卫锋,等.低血清铁生殖道沙眼衣原体持续感染动物模型的研究[J].中华皮肤科杂志,2010,43(10):702-704.
[13]Shah AA,Schripsema JH,Imtiaz MT,et al.Histopathologic changes related to fibrotic oviduct occlusion after genital tract infection of mice withChlamydia muridarum[J].Sex Transm Dis,2005,32(1):49-56.
[14]Gong S,Yang Z,Lei L,et al.Characterization ofChlamydia trachomatisplasmid-encoded open reading frames[J].J Bacteriol,2013,195(17):3819-3826.
[15]Song L,Carlson JH,Whitmire WM,et al.Chlamydia trachomatisplasmid-encoded Pgp4 is a transcriptional regulator of virulenceassociated genes[J].Infect Immun,2013,81(3):636-644.
Identification of cell invasion-related virulence genes in chlamydial plasmidsin vitro
Bi Tiantian*,Wang Na,Hou Shuping,Liu Yuanjun,Cen Xinghong,Wang Huiping.*Department of Dermatology,General Hospital,Tianjin Medical University,Tianjin 300052,China
ObjectiveTo compare the infectivity of several transformedChlamydia trachomatis(Ct)mouse pneumonitis(Mopn)strains to host cells,and to identify cell invasion-related virulence genes in Chlamydial plasmids.MethodsSeveral Ct strains,including wild-type Ct Mopn strain(WT strain),plasmid-free Ct strain(CMUT3 strain),Ct Mopn strain transformed with the shuttle vector carrying pGFP and the completeC.muridarum(CM)plasmid(pGFP::CM strain)and Ct Mopn strains transformed with shuttle vectors carrying pGFP and mutant CM plasmids with inframe deletions of Pgp3,4,5 or 7 (pGFP::CM△Pgp3,4,5,7 strains),were cultured,amplified and collected.After the concentrations of Ct were determined,each of these strains was divided into four groups to be inoculated at a same amount(1.5 × 104inclusion forming units(IFU))followed by four different treatments respectively:centrifugalization+DEAE group treated with centrifugalization followed by ion-exchange chromatography on diethylaminoethyl(DEAE)-cellulose columns,centrifugalization group treated with centrifugalization only,DEAE group treated with chromatography on DEAE-cellulose columns only,control group receiving no treatment.After additional culture for 20-24 hours,indirect immunofluorescence assay was performed to count the number of chlamydial inclusions.At 20,40 and 60 hours after infection,the growth rate and area of chlamydial plaques were assessed after three continuous passages.Lugol′s iodine staining was conducted to observe glycogen synthesis in bacterial inclusions.ResultsThe inclusion number in the centrifugalization+DEAE group,centrifugalization group,DEAE group and control group was 10.20±1.30,6.80±0.44,3.00±1.22 and 0.80±0.45 respectively for the pGFP::CM△Pgp4 strain,6.40±0.89,3.80±0.83,1.60±0.89 and 0.60±0.54 respectively for the CMUT3 strain.Under same experiment conditions,the pGFP::CM△Pgp4 strain and CMUT3 strain showed similar infectivity,and formed less inclusions compared with the other Ct strains (allP<0.01).The number of inclusions formed by the same Ct strains were significantly different among the 4 groups(F=845.310,P<0.01),and were highest in the centrifugalization+DEAE group for all the strains.The pGFP::CM△Pgp4 strain showed significantly lower growth rate and area of plaques with an abnormality in glycogen accumulation compared with the other strains at 20,40 and 60 hours after infection.ConclusionThe plasmid-encoding gene Pgp4 may be a cell invasionassociated virulence gene in chlamydial plasmids.
Chlamydia trachomatis;Plasmids;Inclusion bodies;Virulence;Genes;In vitro
Wang Huiping,Email:huiping1208@163.com
10.3760/cma.j.issn.0412-4030.2015.05.003
国家自然科学基金青年科学基金(81301469)
王惠平,Email:huiping1208@163.com
2014-05-23)
(本文编辑:吴晓初)
