Fe(II)改性蒙脱石去除Cr(VI)的性能及其机理研究
2015-11-02吴宏海魏西鹏管玉峰何广平张延霖
杜 巍, 吴宏海, 魏西鹏, 管玉峰, 何广平, 张延霖
(华南师范大学化学与环境学院;环境化学省部共建教育部重点实验室,广州 510006)
Fe(II)改性蒙脱石去除Cr(VI)的性能及其机理研究
杜巍, 吴宏海*, 魏西鹏, 管玉峰, 何广平, 张延霖
(华南师范大学化学与环境学院;环境化学省部共建教育部重点实验室,广州 510006)
通过逐步加入抗坏血酸与硫酸亚铁盐到蒙脱石浆液,制备了一种环境友好型抗氧化型还原功能矿物材料(A-Fe(II)-Mt);同时制备了单独加入Fe(II)离子改性的蒙脱石Fe(II)-Mt,比较这2种还原功能材料对Cr(VI)的去除性能. 结果表明:pH为2~7时A-Fe(II)-Mt去除效果最好,最大去除量为34.9 mg/g,而Fe(II)-Mt为26.8 mg/g.反应在90 min内趋于平衡,符合假二级动力学方程. 其中,A-Fe(II)-Mt 对Cr(VI)的去除过程:首先Cr(VI)阴离子被吸附到亚铁改性蒙脱石表面,接着被还原为低毒的Cr(III),之后Cr(III)可能形成氢氧化物或被蒙脱石吸附而固定.这种去除六价铬的治理方法对于铬的稳定化处置具有高效和安全性,应用前景广泛.
亚铁; 抗坏血酸; 蒙脱石; 去除Cr(VI); 还原
近年来,治理Cr(VI)污染的研究热点已转向研制环境友好型功能材料[1],还原改性粘土矿物是一个研究案例.黏土矿物储量丰富、来源广、价格较低,具有表面反应多样性,诸如吸附、氧化还原、非均相催化和表面沉淀等,能够有效控制环境污染物的迁移、转化与归宿[2].研究表明,生态毒物的还原转化过程中,环境中大量的Fe(II)物种是重要的还原剂[3].Fe(II)物种具有不同的形态,包括化合态(如Fe3O4、FeS2和FeCO3等)、结构态(如黏土矿物中类似同像替换)以及吸附态(如离子交换和表面配位).黄铁矿、磁铁矿、菱铁矿和绿锈含有化合态亚铁;黏土结构片层中有可利用的结构态亚铁,已有较多报道[4].但是黏土矿物层间域Fe(II)的还原行为及稳定性仍不太清楚.本文采用离子交换法,使抗坏血酸与亚铁离子结合形成抗坏血酸亚铁配合物阳离子替换进入蒙脱石层间,制备了一种抗氧化型的还原功能粘土矿物材料,通过对废水中Cr(VI) 的去除实验,探讨该材料的还原性能与应用前景.
1 研究方法
1.1实验试剂
主要化学试剂:硫酸亚铁、抗坏血酸、盐酸、硫酸、磷酸、无水乙醇、铬酸钾、二苯碳酰二肼均为分析纯,钠基蒙脱石购自内蒙古赤峰.实验用水为二次去离子水.
1.2改性蒙脱石的制备
抗氧化型Fe(II)-蒙脱石:250 mL锥形瓶中倒入100 mL水,加入2.0 g蒙脱石(Na-Mt),氮气环境中置于磁力恒温搅拌器(广州比朗仪器有限公司)搅拌30 min,然后加入一定量硫酸亚铁,使混合体系中亚铁离子浓度为0.035 mol/L,加入0.5 g抗坏血酸在氮气中搅拌30 min,用橡胶塞密封,继续搅拌8 h,再陈化24 h. 改性产物用超纯水清洗多次,45 ℃下真空干燥12 h,得到白色的抗氧化型Fe(II)蒙脱石,记为A-Fe(II)-Mt.
Fe(II)-蒙脱石:主要步骤同A-Fe(II)-Mt制备,但不加抗坏血酸,得到淡黄色的还原剂(颜色变黄的原因可能是部分亚铁离子已氧化成三价铁[5]),记为Fe(II)-Mt. 干燥、研磨后过0.074 mm筛,密封保存备用.
1.3改性蒙脱石对Cr(VI)的去除实验
采用批处理方法,即分别向装有一系列50 mL的溶液的锥形瓶中加入一定量的A-Fe(II)-Mt、Fe(II)-Mt和天然钠基蒙脱石等3种不同去除剂;采用精密pH计(PHS-3C,上海雷磁仪器厂)调节反应所需要的pH;在室温下振荡4 h,经滤膜(0.45 μm)过滤测定滤液的Cr (Ⅵ)含量[6]. 考察下面几个因素的影响(表1).
1.4解析实验
采用1 mol/L的盐酸对A-Fe(II)-Mt去除Cr(VI)的固体产物进行酸溶出实验,作用时间24 h,离心分离,经滤膜过滤,测定上清液的 Cr(Ⅵ)离子与总Cr含量,判定Cr (Ⅵ)是否发生还原转化[7]
1.5测试方法
按照文献[8]的方法,测定总Cr含量用火焰原子吸收分光光度计(TAS-986,北京普析通用仪器有限公司)法;Cr(Ⅵ)含量的测定采用二苯碳酰二肼分光光度法,紫外-可见光光度计(UV-3802 型,尤尼克上海仪器有限公司).
表1溶液反应条件改变对去除Cr(VI)的影响
Table 1Effects of reaction conditions on the removal of Cr(VI) in solution
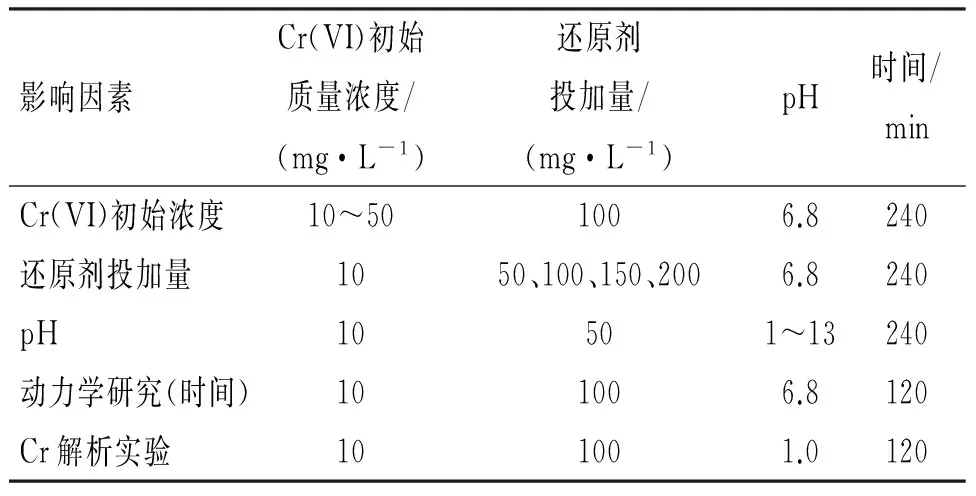
影响因素Cr(VI)初始质量浓度/(mg·L-1)还原剂投加量/(mg·L-1)pH时间/minCr(VI)初始浓度10~501006.8240还原剂投加量1050、100、150、2006.8240pH10501~13240动力学研究(时间)101006.8120Cr解析实验101001.0120
2 结果与讨论
2.1Fe(II)改性蒙脱石的材料表征
图1 表示样品在小角度3°~10°的X射线衍射图谱(XRD).通过代入2θ到谢乐公式[9]中,计算出蒙脱石原样的特征峰d(001)为1.23 nm,改性后该特征峰往小角度移动,层间距相应发生了改变:A-Fe(II)-Mt的d(001)a为1.51 nm,说明抗坏血酸亚铁络合离子成功插层; Fe(II)-Mt的d(001)b值亦变为1.52 nm.A-Fe(II)-Mt的该特征衍射峰尖锐,说明改性使得 Fe(II)与抗坏血酸形成配位化合物在蒙脱石层片间发生了有序排列,亚铁离子配合物进入层间域,改性产物呈白色[10].与之相反,Fe(II)-Mt呈黄色,说明部分 Fe(II)被氧化形成Fe(III)[11].
分别加入0.25、0.50、1.00 g抗坏血酸,制备了不同的抗坏血酸与Fe(II)改性的还原剂蒙脱石产物(分别记为a、b、c).图2中的XRD图谱上2θ=17.2°位置出现了磁铁矿的{111}峰,且该峰随着抗坏血酸(Vc)投加量的增大而加强.可能由于Vc可以保护亚铁离子,较多的Fe(II)与三价铁形成了热力学稳定磁铁矿形貌(正八面体),其中{111}面是热力学最稳定晶面[12].此外,仅改变制备样品c的烘干条件,鼓入空气干燥制备而获得了样品d.其{111}相对于样品c的变得弱一些,同时在2θ=12.4°处出现了新的衍射峰,对应位置为纤铁矿FeO(OH)[13].说明不同气氛的烘干制样方法所得到的样品发生了结构形貌的改变,比如亚铁被氧化为三价铁,同时证实了A-Fe(II)-Mt样品中有结构亚铁的存在.
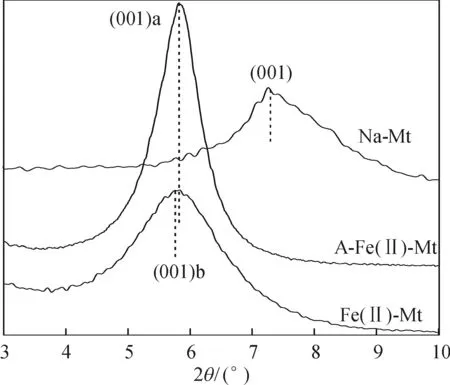
图1 Fe(II)改性蒙脱石产物的小角度3°~10°的衍射图谱
Figure 1XRD patterns of the Na-montmorillonite, Fe(II)-montmorillonite and antioxidant-Fe(II)-montmorillonite samples at 3°-10°
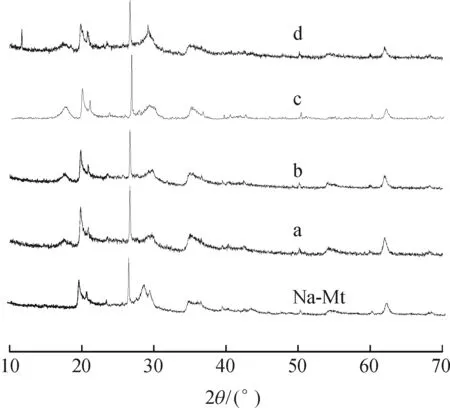
图2 不同抗坏血酸投加量制得样品的XRD衍射图谱
Figure 2XRD patterns of samples with the different amount of ascorbic acid and different drying methods

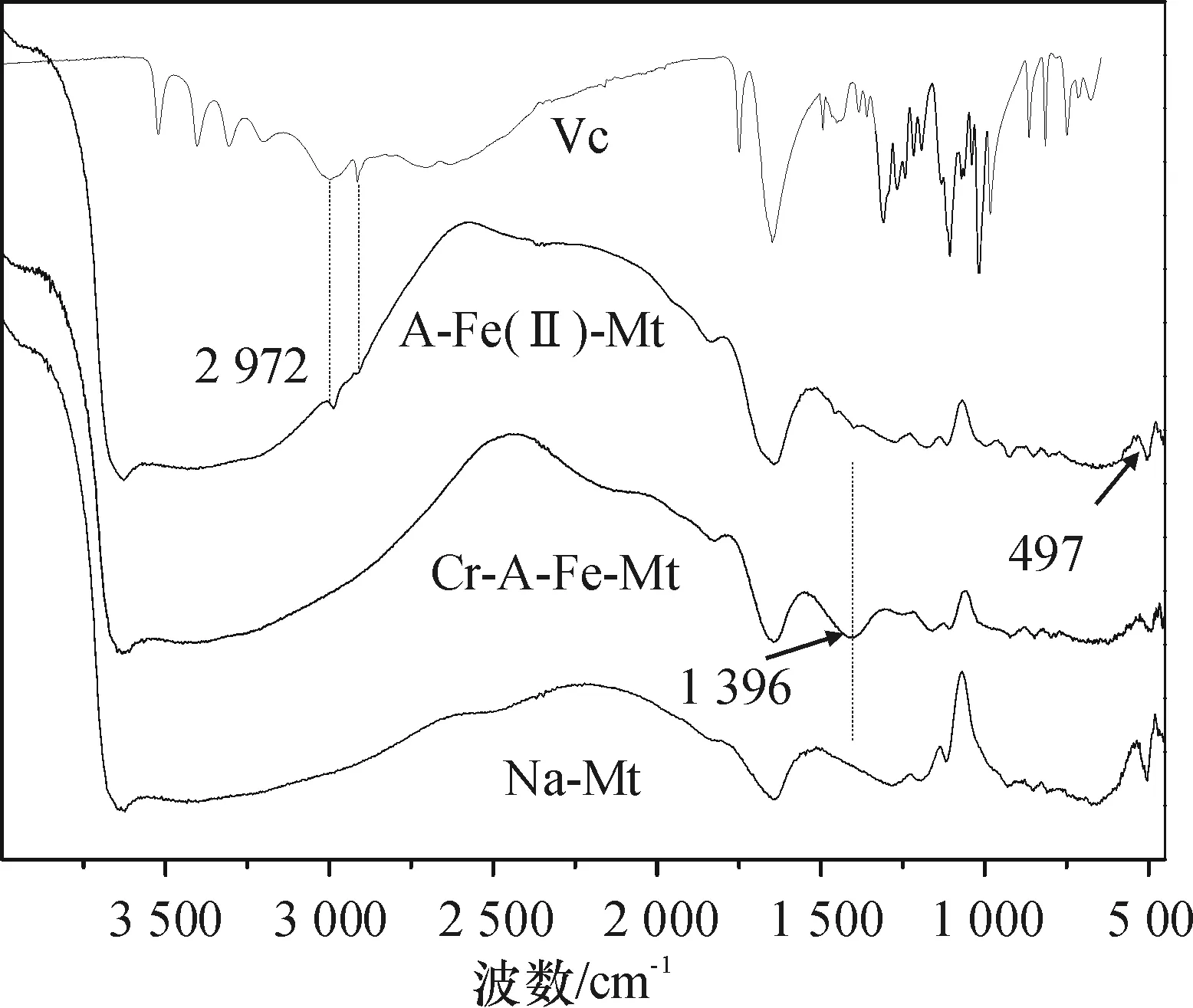
图3 去除剂及其反应产物的FT-IR谱图
Figure 3FT-IR spectra of antioxidant-Fe(II)-montmorillonite and the reduction products
改性蒙脱石表面光滑(图4),层片之间有剥离现象,使蒙脱石有更大的比表面积和更强的吸附性能.A-Fe(II)-Mt的EDX分析:A-Fe(II)-Mt中元素质量百分数分别为C:14.15、Si:24.59、O:47.09、Al:8.52、K:0.40、Mg:1.87、Fe:3.38.

图4 钠基蒙脱石和A-Fe(II)-Mt的扫描电镜图谱
2.2Cr(VI) 去除条件的确定
2.2.1溶液Cr(VI)初始质量浓度A-Fe(II)-Mt和Fe(II)-Mt对Cr(VI)的还原去除率都随Cr(VI)初始质量浓度的增加而减小(图5),因为蒙脱石的CEC最大为1.20 mmol/g[14],层间域Fe(II)的交换量有限.这样,样品Fe(II)还原容量有限,当溶液中含较高质量浓度的Cr(VI)时,部分Cr(VI)不能被还原转化,故只能少量被吸附在蒙脱石层间或表面.当100 mg的A-Fe(II)-Mt和Fe(II)-Mt投加到初始质量浓度10 mg/L的Cr(VI)溶液中,Cr(VI)的去除率分别达到93%和70%.在A-Fe(II)-Mt中的Vc不仅能保护Fe(II)不被氧化,而且还能与Cr(VI)发生还原反应,因此该样品对Cr(VI)的去除率明显高得多.
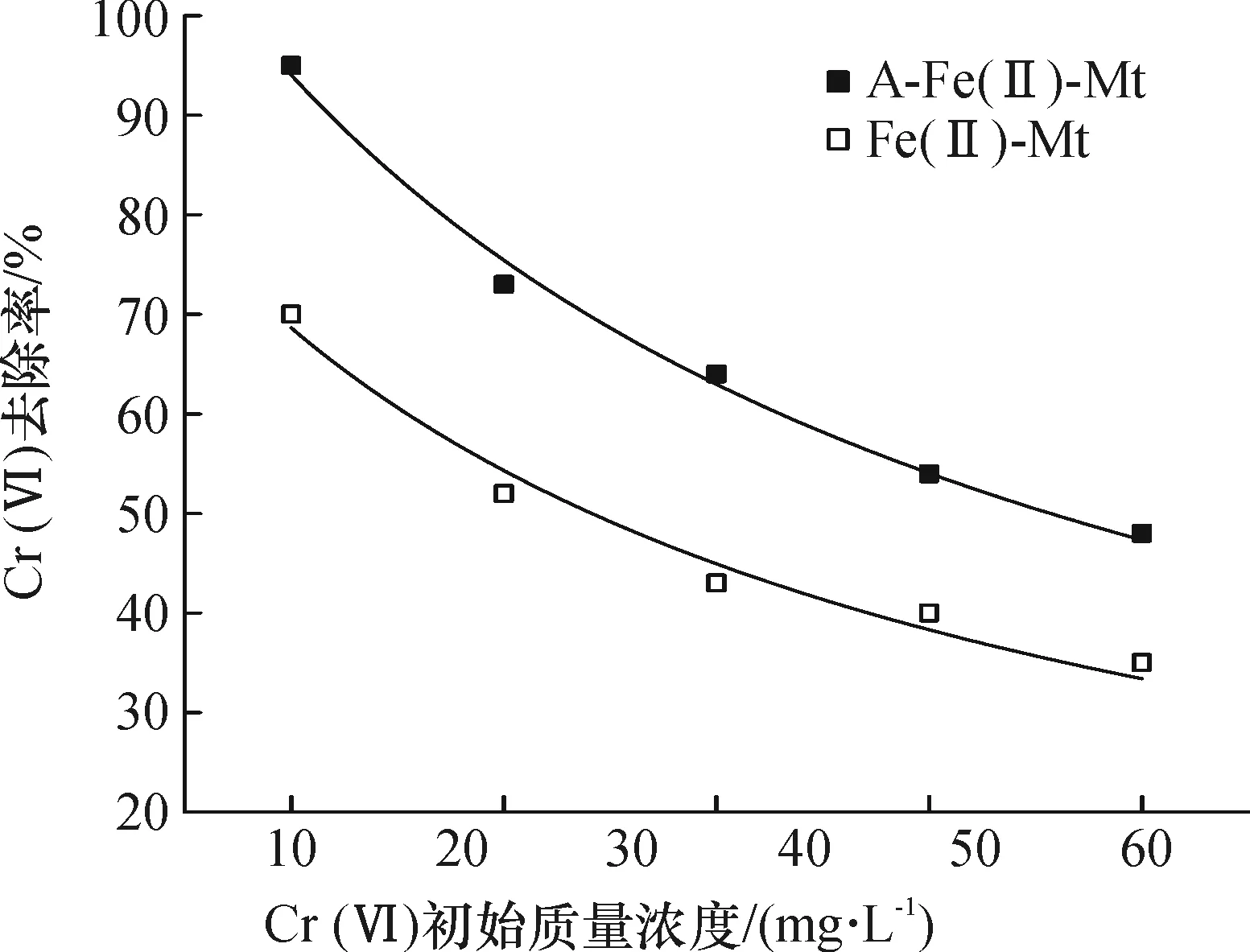
图5 溶液Cr(VI)初始质量浓度的影响
2.2.2去除剂投加量钠基蒙脱石结构含铁量非常少.天然含铁蒙脱石的铁含量一般在2%~3%.由于钠基蒙脱石的永久性负电荷对大阴离子团具有排斥作用,可影响其对Cr(VI)的吸附去除,钠基蒙脱石对Cr(VI)的去除率不明显.A-Fe(II)-Mt和Fe(II)-Mt完全去除Cr(VI)的投加量分别为2.5、4.0 g/L.相对于钠基蒙脱石和含铁蒙脱石,A-Fe(II)-Mt和Fe(II)-Mt对Cr(VI)具有很好的还原去除性能(图6).
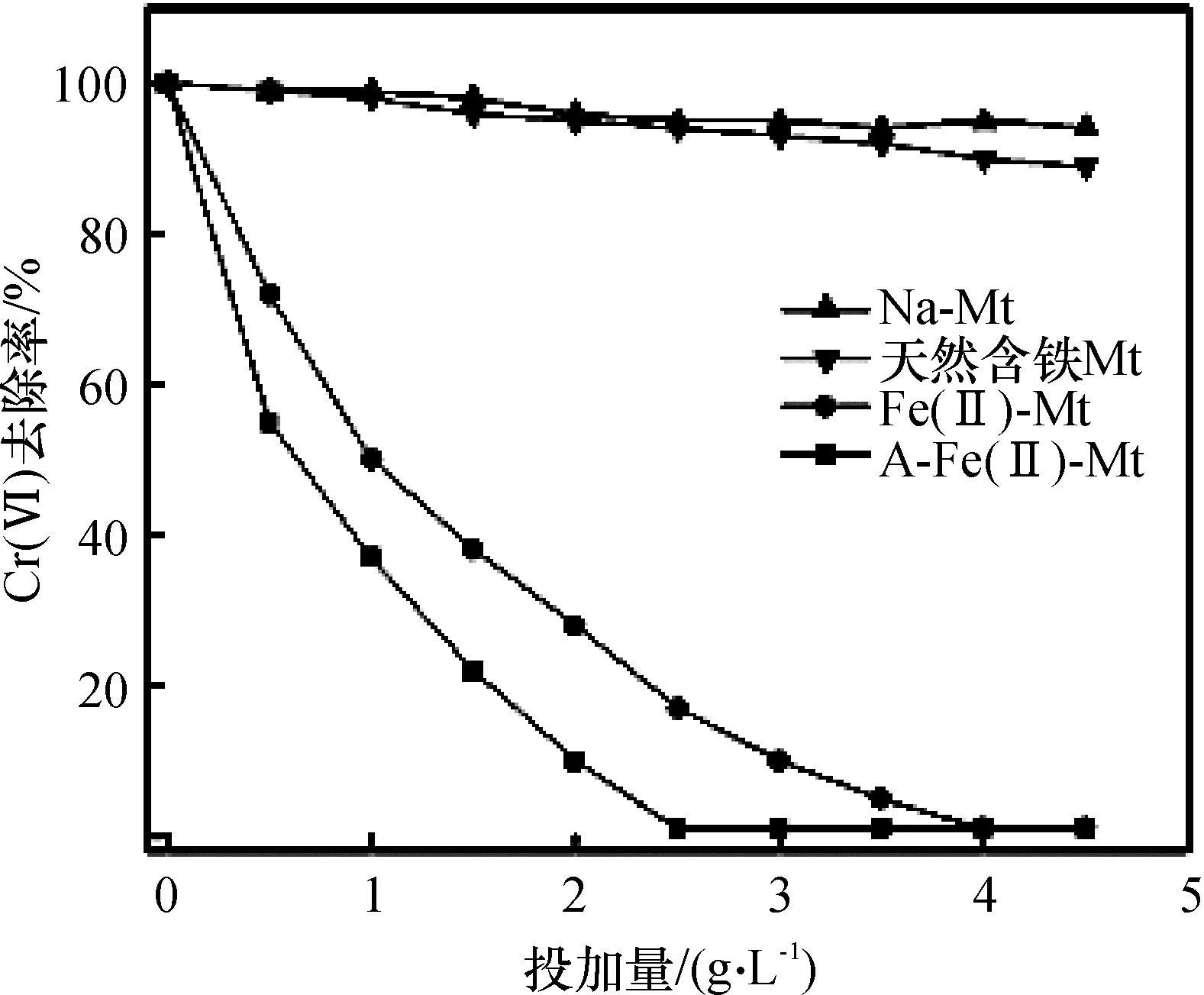
图6 样品的投加量对Cr(VI)去除对比
Figure 6Effect of removing agent dose on the removal of Cr(VI)
2.2.3溶液pH图7表明,与固体样品等量的亚铁溶液与Cr(VI)发生氧化还原反应([Fe(II)]∶[Cr(VI)]=1.5∶1.0),随pH变化的游离亚铁离子形态影响明显Cr(VI)去除率.
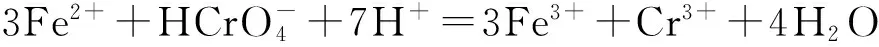
(1)
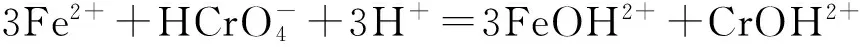
(2)

(3)


图7 pH对Cr(VI)的去除影响
2.3溶液中Cr(VI)去除的动力学模型
去除动力学过程分为2个反应阶段(图8),反应前20 min左右,Cr(VI)的去除量迅速提高,归为初始快速反应阶段;之后缓慢进行,反应至90 min趋近于平衡.获得A-Fe(II)-Mt和Fe(II)-Mt两者的最终吸持去除量分别为34.9、26.8 mg/g.本实验确定120 min作为最佳去除反应时间.
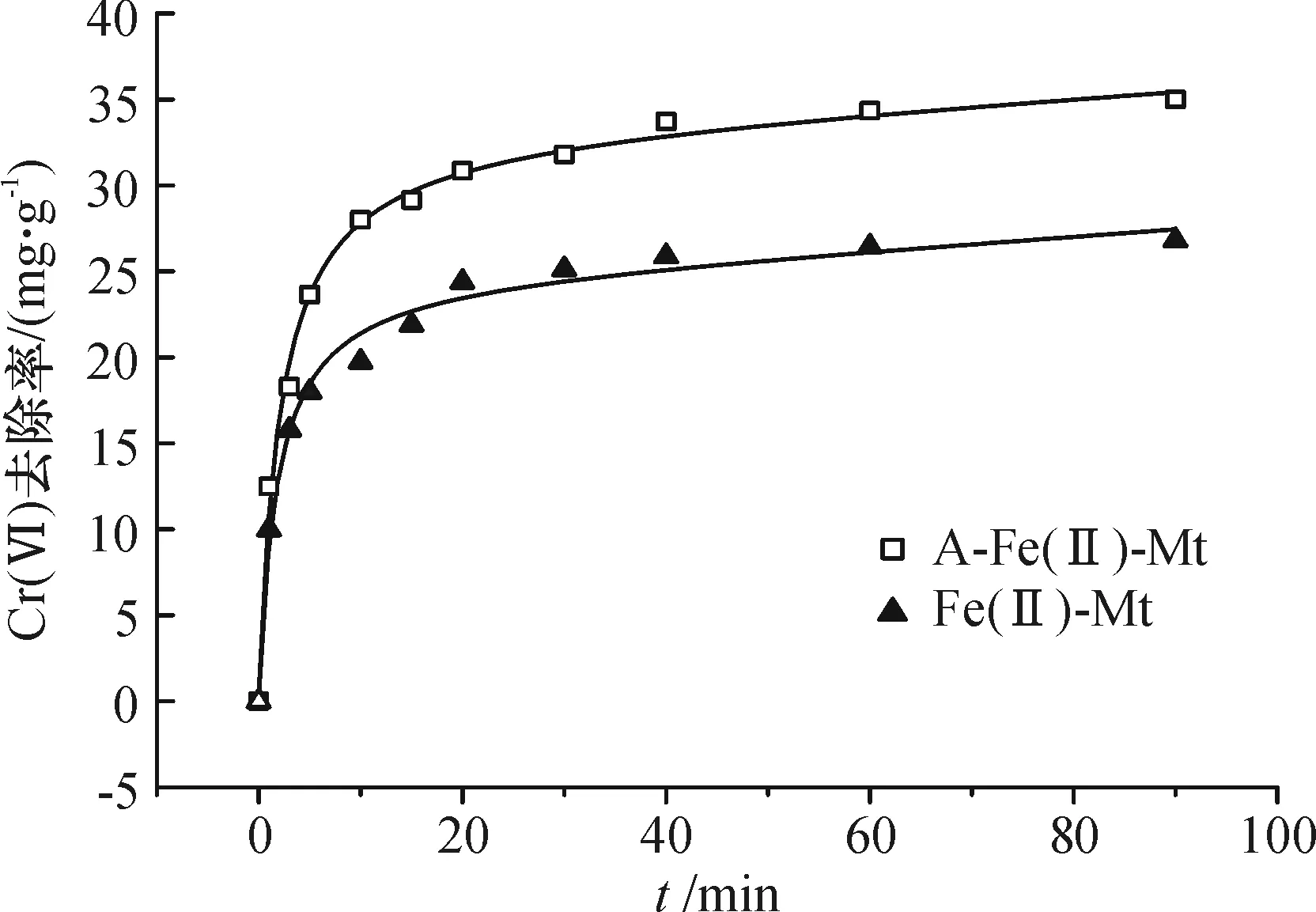
图8 2种还原剂对Cr(VI)的去除动力学曲线
Figure 8Reduction kinetic curves of two removing agent
分别采用拟一级速率方程(式4)、拟二级速率方程(式5)对图5的去除动力学实验数据进行拟合,拟合结果见图9,其相关拟合参数列于表2.
ln (qe-qt)=lnqe-k1t,
(4)
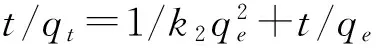
(5)
表2不同还原催化剂动力学曲线拟合结果
Table 2The fitting results of reduction kinetic curves to two reactions
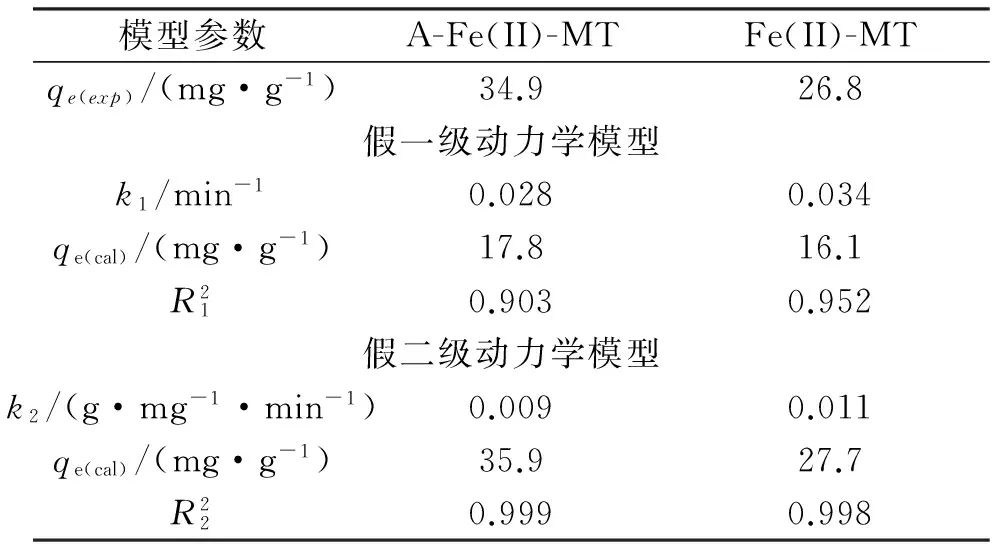
模型参数A-Fe(II)-MTFe(II)-MTqe(exp)/(mg·g-1)34.926.8假一级动力学模型k1/min-10.0280.034qe(cal)/(mg·g-1)17.816.1R210.9030.952假二级动力学模型k2/(g·mg-1·min-1)0.0090.011qe(cal)/(mg·g-1)35.927.7R220.9990.998
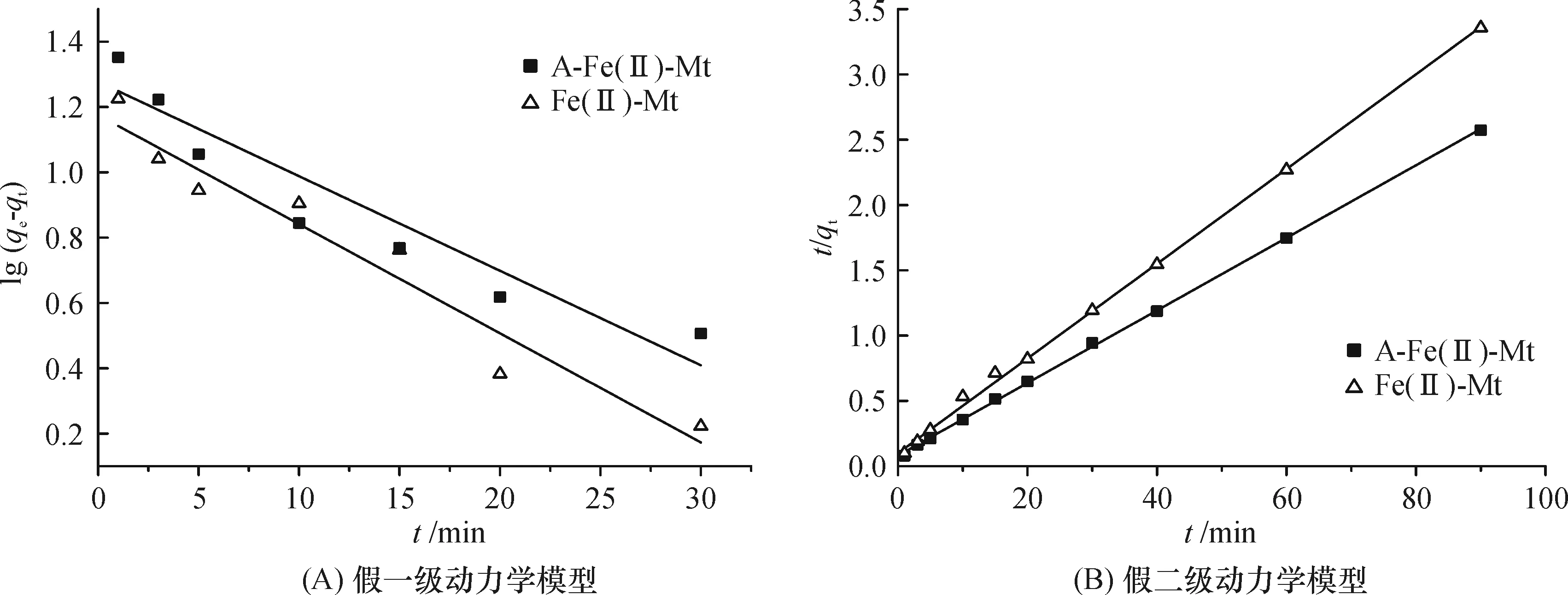
图9 2种材料对去除Cr(VI)的动力学模型
2.4溶液中Cr(VI)的去除机制
发现经A-Fe(II)-Mt解析液中含有极少量的Cr(VI),此时解析出来的总Cr几乎为吸附在蒙脱石层间的Cr(III).从吸持量计算得出上清液中理论总Cr,解析与理论值相吻合(图10).Cr元素在A-Fe(II)-Mt还原体系中元素总量守恒,从而证实了去除Cr(VI)的作用机制为Cr(VI)首先被吸附到A-Fe(II)-Mt蒙脱石表面,再被还原转化为低毒的Cr(III),后者被蒙脱石吸附,或与Fe(III)形成氧化物[19].而对Fe(II)-Mt反应产物进行酸解析,解析的上清液中Cr(VI)含量远多于A-Fe(II)-Mt,说明Fe(II)-Mt的去除机制为表面吸附和Fe(II)还原的共同作用(图11).归因于在样品制备过程中Fe(II)被氧化为Fe(III)形成了磁铁矿.A-Fe(II)-Mt能将一定质量浓度的Cr(VI) 完全还原转化为Cr(III),并固定于蒙脱石复合体中而被稳定去除[20].
解析实验的结果表明,还原反应基本将Cr(VI)转化为低毒的Cr(III).为了进一步验证该反应机理,故收集上述A-Fe(II)-Mt与Cr-A-Fe-Mt 2种样品,分析其XRD结构并作了对比(图12).特征衍射峰(001)位置几乎不变,说明在层间存在的Cr(III)或Fe(III)阳离子将层间距继续撑大.A-Fe(II)-Mt出现的类磁铁矿的特征峰(111)在还原产物Cr-A-Fe-Mt对应位置几乎消失,说明A-Fe(II)-Mt的还原作用,首先是表面磁铁矿或端面吸附的Fe(II)、Cr(III)没有形成结晶形态好的产物,所以图谱上只能观察微弱的衍射峰[21].由于层间域中发生离子交换,Cr(III)大部分进入层间域,而且Cr(III)和Fe(III)可以形成羟基聚合物,但有序性降低,从而使得(001)特征衍射峰有所宽化.相比Na-Mt,其他峰值则几乎不变,仅(005)峰消失,其可以归因于天然蒙脱石中杂质矿物相被有机酸还原溶解[22].

图10酸解析A-Fe(II)-Mt及反应产物的上清液中Cr(Ⅵ)与总Cr的质量浓度
Figure 10Cr(Ⅵ) and the total Cr content of the supernatant from acid desorption of antioxidant-Fe(II)-montmorillonite and the reduction product
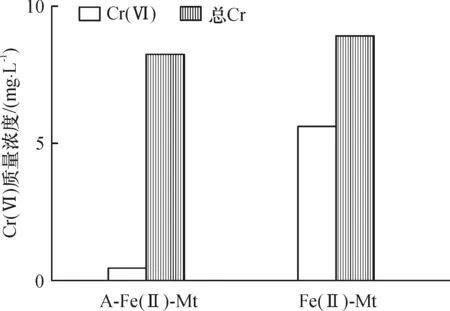
图11酸解析2种不同还原剂的上清液中Cr(VI)和总Cr的质量浓度
Figure 11Cr(Ⅵ) and the total Cr content of the supernatant from acid desorption of the two different removing agents
从A-Fe(II)-Mt和Fe(II)-Mt 2种还原剂解析出来Cr(VI)的含量差别较大(图11),后者吸附较多的Cr(VI),说明该样品以吸附Cr(VI)为主导去除方式,归因于该样品中Fe(II)较大程度转化为Fe(III),这与该样品表面颜色呈黄褐色的现象是一致的.A-Fe(II)-Mt对Cr(VI)的去除方式以还原为主,后进一步吸附固定Cr(III)[23],从而取得很好的去除效果.
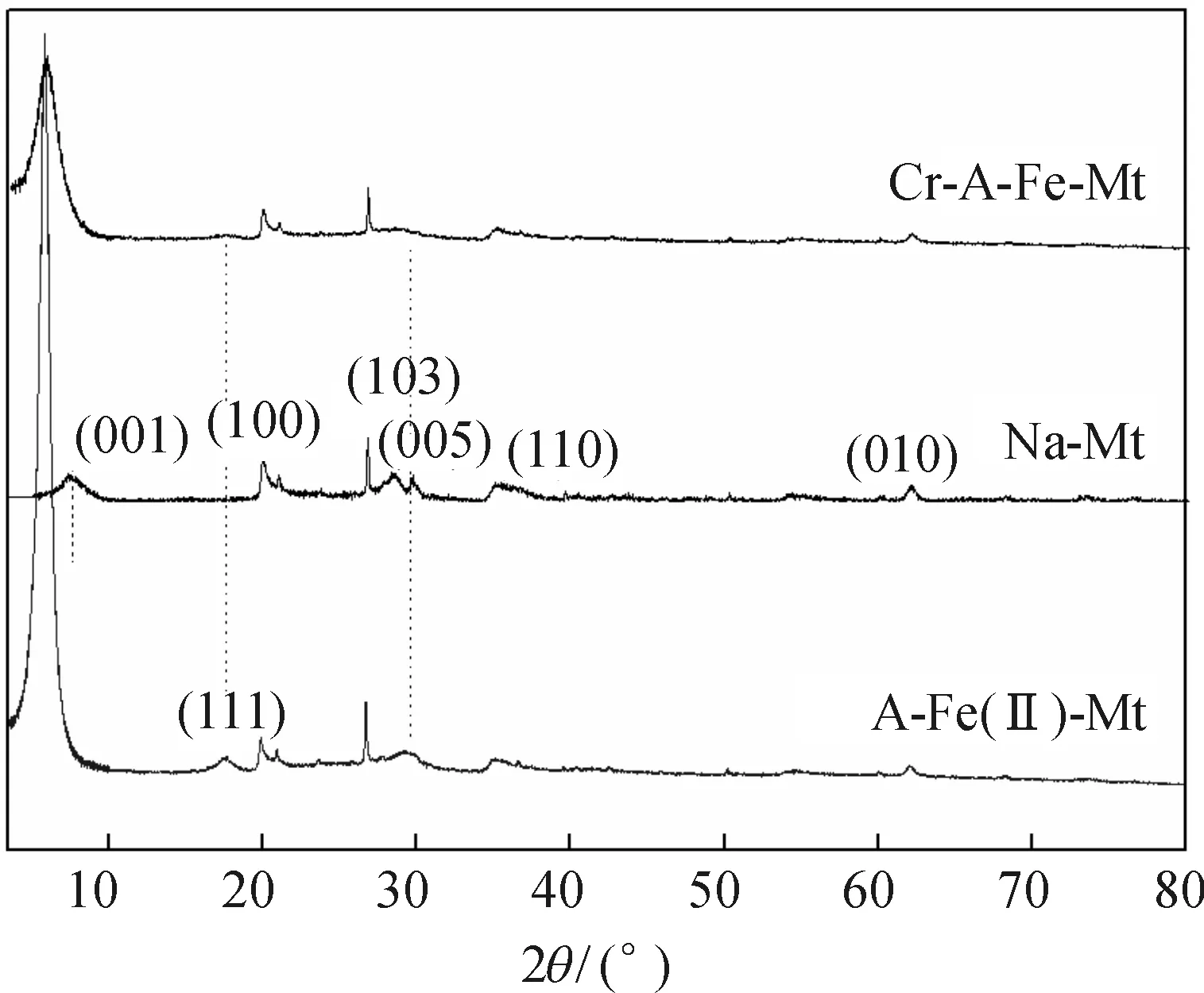
图12 A-Fe(II)-Mt还原去除Cr(VI)前后的XRD图谱对比
Figure 12Comparison of XRD patterns of before and after the reduction of antioxidant-Fe(II)-montmorillonite
2.5反应前后样品中元素变化
2.5.1反应前后样品中元素变化对比分析图13显示了反应前后2种样品的XPS全谱分析,相比反应前后样品的峰值变化结果显示:一是Fe(2P)峰强度有所减弱,形状有所改变,可能是样品反应前后Fe价态发生改变,结合能有所改变;二是反应后的2种样品对应出现了Cr(2P)峰,证明了反应之后的样品中有Cr元素被样品吸附固定.进一步对Cr 2p峰窄谱分析,探讨Cr元素在样品中出现的价态及结合能.
2.5.2Cr 2p 峰XPS分析Cr 2p 的高分辨 XPS 图谱表明(图14),Cr 2p 峰有2个分峰Cr 2p3/2和 Cr 2p1/2的吸收峰.Cr(III)的材料中,Cr 2p3/2的吸收峰位于577.0~588.0 eV,图中出现的 Cr 2p3/2吸收峰位于结合能~577 eV,所以对应的是Cr(III).Cr 2p1/2的吸收峰位于586.7 eV进一步证实了Cr(III)的存在.以上的结果证实 Cr(VI)离子确实被A-Fe(II)-Mt还原,还原的产物为Cr(III)化合物的形式吸附在蒙脱石中,这与解析的结果去除Cr(VI)的机理是一致的.
2.5.3Fe 2p 峰XPS分析研究表明Fe 2P1/2和Fe的2P3/2峰的位置取决于铁的离子状态.同时卫星峰也可以非常敏感判断Fe 2P1/ 2和Fe 2P3/2的氧化价态,这些方法已用于定性测定的离子铁的状态.
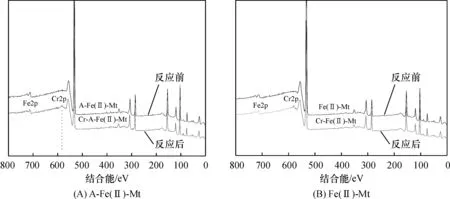
图13 2种样品反应前后的XPS全谱
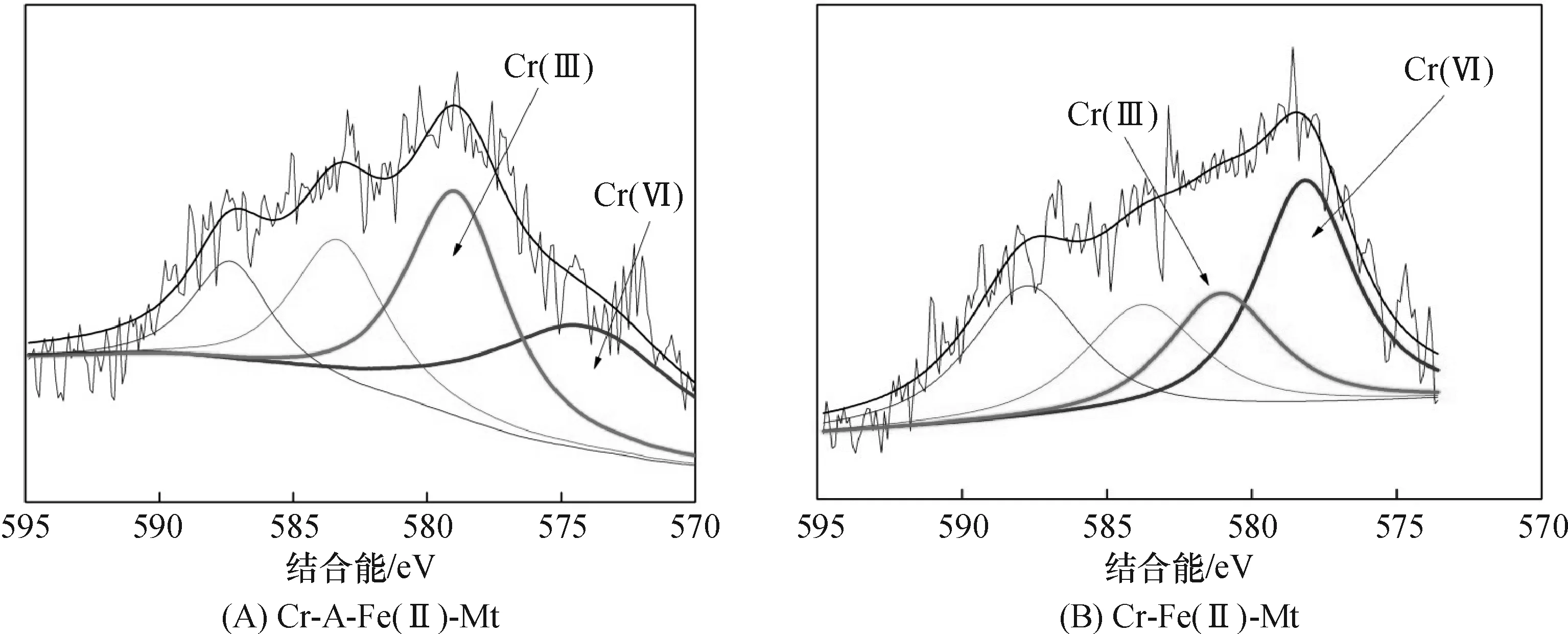
图14 2种样品反应后的Cr 2p峰图谱
图15、16分别为A-Fe(II)-Mt及Fe(II)-Mt样品反应前后的Fe 2p的高分辨 XPS图谱,图中结合能在712.1和723.4 eV位置为Fe(II)出现的信号峰,对应Fe(III)的信号峰出现在结合能为714和725.0 eV位置[24].A-Fe(II)-Mt反应前样品中,Fe 2p3/2处中部靠后峰宽较大(图15A),说明在Fe2p峰中Fe(II)的含量占主要成分,将Fe(II)和Fe(III) 2p峰分离,Fe(II)的峰值明显高于Fe(III)的峰,说明A-Fe(II)-Mt的原样品中亚铁占铁含量的主要成分,主要是抗坏血酸的还原作用保护了亚铁避免了在空气中的氧化,图中的存在少量Fe(III)峰也为A-Fe(II)-Mt样品中出现磁铁矿提供了依据.图15B显示,反应后Fe 2p3/2的峰总体要变小和变细,亚铁的峰变小,对应三价铁峰略微变高.对比图15A和图15B,说明亚铁发生还原反应并于表面生成三价铁,通过样品的反应前后Fe 2p峰的对比,可以证实A-Fe(II)-Mt的反应机理与解析实验描述相符.
图16A和B分别为Fe(II)-Mt样品反应前后的Fe 2p图谱,显示反应前后Fe 2p3/2处亚铁的峰减少,说明Fe(II)-Mt中参加反应的亚铁量很少[25].反应前后Fe(III)的峰强略增,说明在制样过程中Fe(II)-Mt已被氧化,而少量的亚铁成分对还原反应影响很小,所以在去除Cr(VI)反应中,主要的作用是Fe(III)的吸附作用,这与解析实验中Fe(II)-Mt样品解析出较多的Cr(VI)的结果相对应.
3 结论
研究制备了抗氧化型还原功能矿物材料A-Fe(II)-Mt. 通过与单独Fe(II)离子改性的蒙脱石Fe(II)-Mt对比,A-Fe(II)-Mt对Cr(VI)的去除效果更好,因为制备过程中加入的抗坏血酸能起很好的保护作用,使Fe(II)不容易被溶解氧所氧化;同时抗坏血酸与亚铁的配位作用也能增强亚铁的还原性能.对上述2种材料的去除性能研究中发现,在其他条件相同,pH范围为2~7时,去除效果均较佳,但A-Fe(II)-Mt的去除率更高,最大去除量可达34.9 mg/g,而Fe(II)-Mt的仅为26.8 mg/g.去除反应均符合假二级动力学方程.解析实验表明,Fe(II)-Mt以吸附Cr(VI)为主导去除方式,A-Fe(II)-Mt去除机制为:先还原后吸附并固定Cr(III).A-Fe(II)-Mt完全将Cr(VI)还原成低毒的Cr(III)并吸附固定,从而更加安全稳定将重金属铬污染物从水相还原并转移到固相中,达到无害化处置目的,表明其是一种环境友好的抗氧化型还原功能矿物材料.

图15 A-Fe(II)-Mt 样品反应前后的Fe 2p的XPS图谱
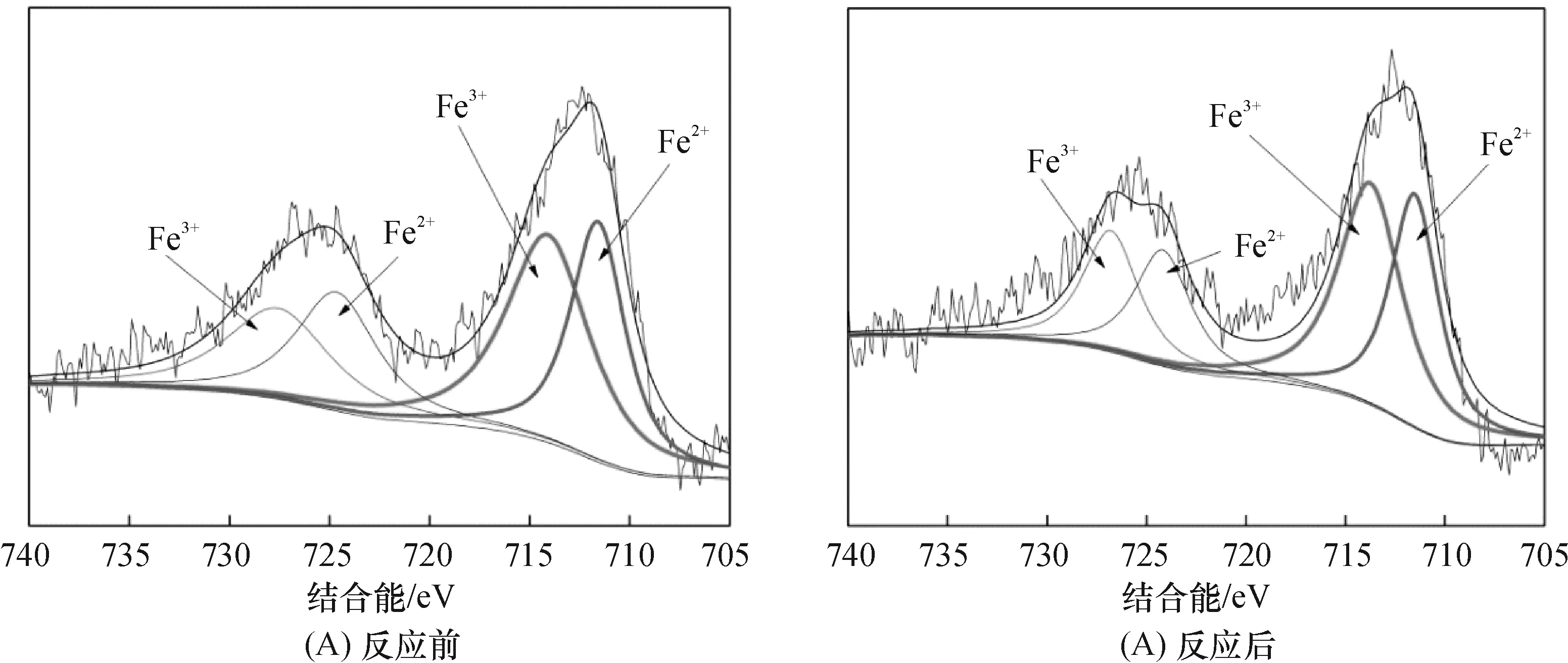
图16 Fe(II)-Mt样品反应前后的Fe 2p的XPS图谱
[1]石玉敏, 王彤. 铬渣解毒处理处置技术综述[J]. 化工环保, 2008, 28(6): 471-477.
Shi Y M, Wang T. Review of treatment and disposal technologies for chromium residue[J]. Environmental Protection of Chemical Industry, 2008,28(6):471-477.
[2]苏凯, 贺玉龙, 杨立中. 改性蒙脱石吸附降解硝酸根离子的研究[J]. 岩石矿物, 2013, 33(3): 7-12.
Su K, He Y L, Yang L Z. Study of using modified smectite to adsorb and degrade nitrate[J]. Journal of Mineral Petrol,2013,33(3):7-12.
[3]Manjanna J. Preparation of Fe(II)-montmorillonite by reduction of Fe(III)-montmorillonite with ascorbic acid[J]. Applied Clay Science, 2008, 42:32-38.
[4]吴德礼, 冯勇, 马鲁铭. 多羟基亚铁络合物还原转化活性黑5的实验[J]. 同济大学学报, 2011, 39(11):1658-1662.
Wu D L, Feng Y, Ma L M. Reductive transformation of reactive Black 5 by Ferrous Hydroxy Complex[J]. Journal of Tongji University,2011, 39(11):1658-1662.
[5]范远, 陈金思. 三氯化铁改性膨润土对铬(VI)的吸附性能研究[J]. 山东化工,2010, 39:8-11.
Fan Y, Chen J S. Investigation of adsorption performance to Cr(VI) by the modified bentonite of Ferric Chloride[J].Shandong Chemical Industry, 2010, 39:8-11.
[6]周跃花, 杜晓莉, 李学坤, 等. 有机-无机复合改性蒙脱石同时吸附水中苯酚和铬(Ⅵ)[J]. 环境化学, 2014, 33(4): 664-668.
Zhou Y H, Du X L, Li X K. Simultaneous sorption of aqueous phenol and Cr(VI) onto inorganic-organic modified montmorillonite[J]. Environmental Chemistry, 2014, 33(4): 664-668.
[7]尹丽京, 李益民, 张璐吉, 等. 羟基铝柱撑膨润土负载纳米铁还原Cr(VI)[J].环境科学, 2009, 30(4): 1056-1059.
Yin L J, Li Y M, Zhang L J. Reduction of chromium(VI) by nanoscale zero-valent iron supported on Al-pillared bentonite[J].Environmental Science, 2009, 30(4): 1056-1059.
[8]刘粤惠,刘平安. X射线衍射分析原理与应用[M].北京:化学工业出版社, 2003.
[9]Yuan P, Fan M, Yang D, et al. Montmorillonite-supported magnetite nanoparticles for the removal of hexavalent chromium[Cr (VI)] from aqueous solutions[J]. Journal of Hazardous Materials, 2009, 166(2): 821-829.
[10]徐建中, 邓海建, 张博, 等. L-抗坏血酸亚铁的合成及表征[J]. 化学工程师, 2008, 149(2):5-6.
Xu J Z,Deng H J, Zhang B. Synthesis and characterization of ferrous-L-ascorbate[J].Chemical Engineer, 2008, 149(2):5-6.
[11]李鹏波. 铁基柱撑蒙脱石的研究进展[J]. 现代矿业,2012,521(9):83-85.
[12]曲晓飞. 磁铁矿、菱铁矿和四方纤铁矿的合成及其生物矿化意义[D]. 合肥: 中国科技大学, 2011
[13]邹雪华, 陈天虎, 刘海波, 等. 热处理针铁矿的结构与色度演化[J]. 硅酸盐学报, 2013, 41(5): 670-673.
Zou X H,Chen T H, Liu H B. Structural and chromatic evolution of goethite by theramal treatment[J].Journal of the Chinese Ceramic Society, 2013, 41(5): 670-673.
[14]吴平霄. 粘土矿物材料与环境修复[M]. 北京: 化学工业出版社, 2004:8-37.
[15]王斌远, 陈忠林, 樊磊涛, 等. pH 值Fe(II)还原处理含铬废水的影响及动力学研究[J]. 黑龙江自然科学学报, 2014, 31(3): 356-360.
Wang B Y, Chen Z L, Fan L T. Effect of pH value on reduction treatment of chromium-containing wastewater by ferrous and kinetics study[J]. Journal of Natural Science of Heilongjiang University, 2014, 31(3): 356-360.
[16]He T, Chen C C, Traina S J. Inhibited Cr(VI) reduction by aqueous Fe(II) under hyperalkaline conditions[J]. Environmental Science and Technology, 2004, 38(21): 5535-5539.
[17]Buerge I J, Hug S J. Influence of mineral surfaces on chromium(VI) reduction by iron(II)[J]. Environmental Science and Technology, 1999, 33: 4285-4291.
[18]Buerge I J, Hug S J. Influence of organic ligands on chromium(VI) reduction by iron(II)[J]. Environmental Science and Technology, 1998, 32: 2092-2099.
[19]张晓玲, 张庆乐, 张丽青, 等. 膨润土负载羟基氧化铁对铬(VI)吸附的固体浓度效应[J]. 污染防治技术, 2013, 26(5): 29-32.
Zhang X L, Zhang Q L, Zhang L Q.Particle concentration effect of Cr(VI) adsorption by Bentonite load FeOOH[J].Pollution Control Technology, 2013, 26(5): 29-32.
[20]陈修栋, 初本莉, 何宏平. Fe-Cr 微波柱撑蒙脱土的制备及其对茜素红的吸附[J]. 广东化工, 2011, 39(24): 61-63.
Chen X D, Chu B L, He H P. The preparation of Fe-Cr microwave pillared montmorillonite and alizarin adsorption on Red[J]. Guangzhou Chemical Industry, 2011, 39(24): 61-63.
[21]丁伟, 程潇甫, 王伟杰, 等. Cr(III)-羧基配位状态稳定性的理论研究[J]. 化学研究与应用, 2012, 24(2):243-347.
Ding W, Cheng X F, Wang W J. Theoretical study on stability of coordination state of Cr(III) with carboxyl[J]. Chemical Research and Application, 2012, 24(2):243-347.
[22]李仲民, 童张法, 蒋月秀, 等. 羟基铁柱撑剂性能对柱撑蒙脱土层间距的影响[J]. 高校化学工程学报, 2007, 21(3): 544-546.
Li Z M, Tong Z F, Jiang Y X. Effects of the properties of hydroxyl-Fe pillared reagent on the basal spacing of pillared montmorillonite[J]. Journal of Chemical Engineering of Chinese Universities, 2007, 21(3): 544-546.
[23]Yuan P, Fan M, Yang D, et al. Montmorillonite-supported magnetite nanoparticles for the removal of hexavalent chromium[Cr(VI)] from aqueous solutions[J]. Journal of Hazardous Materials, 2009, 166: 821-829.
[24]Yamashita T, Hayes P. Analysis of XPS spectra of Fe2+and Fe3+ions in oxide materials[J]. Applied Surface Science, 2008,254:2441-2449.
[25]Wilson D, Langell M A. XPS analysis of oleylamine/oleic acid capped Fe3O4nanoparticles as a function of temperature[J]. Applied Surface Science, 2014,303:6-13.
【中文责编:成文英文责编:李海航】
Reactive Properties and Mechanism of Antioxidant-Fe(II)-Montmorillonite for the Removal of Cr(VI)
Du Wei, Wu Honghai*, Wei Xipeng, Guan Yufeng, He Guangping, Zhang Yanlin
(School of Chemistry and Environment, South China Normal University; Key Laboratory of Theoretical Chemistry of Environment, Ministry of Education, Guangzhou 510006, China)
An environmentally friendly reductive function mineral material, termed as antioxidant-Fe(II)-montmorillonite (A-Fe(II)-Mt), is prepared using stepwise addition of ferrous ion and ascorbic acid (vitamin C) with desired concentrations into the montmorillonite dispersion. An Fe-Mt is also prepared by adding ferrous ion alone. These two materials are investigated systematically to compare their ability of removing Cr(VI) from aqueous solutions. The experimental results show that the optimum pH condition for the Cr(VI) removal is in the range of 2.0~7.0 with the maximum Cr(VI) removals of 34.9 mg/g and 26.8 mg/g for A-Fe(II)-Mt and Fe(II)-Mt, respectively. The relevant reactions reach equilibrium within 90 min and can highly follow the pseudo-second-order kinetic model. The Cr(VI) removal process associated with A-Fe(II)-Mt may be concluded that hexavalent chromium anion is first adsorbed onto the material surfaces, followed by the Cr(VI) reduction to the low toxic species of Cr(III). After that, the Cr(III) ion is found to form chromic hydroxide, i.e. Cr(OH)3and/or to be adsorbed onto montmorillonite. The treatment approach for the Cr(VI) removal is efficient and safe to the chromic stabilization, and its application is wide promising.
ferrous; ascorbic acid; montmorillonite; removal Cr(VI); reduction
2015-02-12《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(41372050)
吴宏海,教授,Email:wkk302@163.com.
X52
A
1000-5463(2015)06-0063-09
