PKM2调控肿瘤细胞代谢的研究进展
2015-10-27许昆王子迎
许昆 王子迎
(安徽大学,合肥 230601)
PKM2调控肿瘤细胞代谢的研究进展
许昆 王子迎
(安徽大学,合肥 230601)
肿瘤细胞代谢的最重要特征是消耗大量的糖并产生乳酸。M2-型丙酮酸激酶 2(PKM2)在这种代谢表型中发挥决定性的作用,体内外实验均发现 PKM2 的过表达可明显增强 Warburg 效应,促进肿瘤生长。然而关于PKM2调节肿瘤细胞代谢的机制仍然不是很清楚。当前的研究也提出了一些新颖的PKM2调节肿瘤代谢的观点。在总结当前认识的同时,提出一些本领域的未来可能的研究方向,重点突出肿瘤细胞中关于PKM2活性和特异性的争议,并对PKM2潜在的治疗策略进行讨论。
PKM2;肿瘤细胞代谢;Warburg效应;糖酵解
1 PKM2:癌细胞代谢转换的标志
在糖酵解的最后一步,PK催化磷酸烯醇丙酮酸(PEP)为丙酮酸,同时产生一分子ATP[1]。在哺乳动物细胞共有4种PK亚型:PKM1、PKM2、PKL和 PKR[2]。PKLR和PKM两个基因负责编码这4种表型,并通过组织特异性启动子[3]和选择性剪切[4]来调控。在不同的组织中有不同的亚型,也行使着各自特异性功能。PKM1、PKM2 由PKM基因编码,是在转录过程中由前体 mRNA 经选择性剪切的产物。PKM基因包含12个外显子。PKM1 含有外显子(1-8,9,11-12)主要存在成熟组织如脑组织与骨骼肌,与 PEP 底物的亲和力最高,不能被磷酸化和被变构化调控;而PKM2 则含有外显子(1-8,10, 11-12)。其负责二聚体转化成四聚体的 C 端 56 个氨基酸与 PKM1存在差别,主要存在一些分化组织、具有核酸合成特性的细胞中,如胚胎细胞[5]。
最早关于肿瘤异常代谢的研究是开始于1920年,Warburg[6]提出肿瘤的能量代谢是利用糖酵解而不是效率更好的线粒体有氧代谢。这种肿瘤代谢模式的结果是消耗大量的糖并产生乳酸,这种现象被称为Warburg效应或者有氧糖酵解[7]。在过去的10年中,肿瘤易患体质的遗传学研究和对肿瘤基因组的高通量测序表明代谢酶的突变对肿瘤的发生起重要的作用[8]。紧接着利用生化方法对肿瘤有氧酵解的分子基础的研究揭示了大部分的肿瘤细胞均高表达PKM2,且与肿瘤组织来源无关[9]。这些结果很快使得PKM2作为肿瘤治疗的研究热点。
近几年对PKM2在肿瘤发生过程中的调节机制研究取得了实质性的进展,PKM2的功能是多样的,包括了合成代谢和对糖酵解的调节[10]。虽然对于PKM2功能、结构及代谢的研究内容已经相当丰富,但是在PKM2代谢调节及非糖酵解功能方面仍然有许多问题尚不清楚。本文总结了关于PKM2如何协调糖酵解及促进肿瘤形成方面的最新进展,以及PKM2怎样通过糖酵解功能和控制基因表达促使肿瘤发生。另外还将针对调节PKM2活性的潜在治疗策略进行讨论。
2 正常细胞和肿瘤细胞中PKM2的表达
作为调节糖酵解的关键酶,PK呈高度保守性。事实上,4种PK亚型序列非常相似。PKM1和PKM2均由PKM基因调控,PKM基因含有12个外显子,而PKM1和PKM2的区别在于M1含9号外显子,M2含10号外显子。PKM转录后的差异剪切受hnRNPA1,hnRNPA2及PTB(也称hnRNPAI)调控[11,12],它们通过控制9号外显子的剪切,促进PKM2的表达。原癌基因和转录子c-Myc可以上调这3种hnRNP,从而促进部分肿瘤中PKM2的表达[13]。胰岛素和转录因子SP1、SP3、HIF-1(hypoxia inducible factor 1)也可以诱导PKM基因的转录[14-16]。在肿瘤中最常见的失调级联信号通路之一,PI3KAKT-mTOR通路通过HIF-1诱导的转录激活和依赖于c-Myc的hnRNPs上调,增强PKM2的表达[17]。
有学者提出,在肿瘤细胞中,PKM2会逐步取代组织特异性PK亚型,直到最后成为主导亚型[18]。这种亚型转变暗示PKM2对肿瘤形成有着特别的功能。这一假说得到了研究支持,在转化细胞中用PKM1取代PKM2可以延迟移植瘤生长[19]。
最近,一个针对PKM1和PKM2的蛋白质组学分析在许多正常组织和癌症组织中开展。这项研究表明在许多正常组织中PKM2仍是主要的PKM亚型,且在癌症组织中PKM的两种亚型都有成比例的增长。然而,在初期肿瘤组织中检测到的PKM1蛋白可能来源于基质细胞。一方面,这项研究表明PKM2确实在肿瘤细胞中高表达;另一方面,结果也证明在成人肿瘤组织中PKM2并不是单独存在[20]。
PKM2有两种主要的状态,一种是有活性的四聚体形式,一种是活性较弱的二聚体形式[21]。研究发现二聚体状态特异性存在于肿瘤细胞内,并将此命名为Tumor-M2-PK[22]。这将有利于利用ELISA方法来检查癌症患者的血浆或和粪便中PKM2的二聚体形式。然而,到目前为止没有文献报道过只针对PKM2二聚体的抗体。相反,早期的关于PKM2活性的生化试验表明了PKM2单体(无活性)和四聚体(有活性)的存在,但是没有发现PKM2的二聚体形式,即使在肿瘤组织中[23]。因此,需要更多的生化和功能试验研究胞内是否存在PKM2的单体或者二聚体(或者两者共存)。一个最新的结构-功能分析表明有活性的四聚体实际上是两个二聚体形成的二聚体,尽管还没有报道,但是应该存在一种二聚体的过渡态。有意思的是,最近在细胞核内发现了PKM2的二聚体形式(基于尺寸排阻的色谱层析法),它具有蛋白激酶的活性且可以促进细胞增殖[24]。
总的来讲,尽管PKM2在许多肿瘤中高表达,但是它似乎并非肿瘤细胞中PK的唯一亚型,也并非肿瘤细胞特有亚型。此外,关于肿瘤细胞中PKM2的低聚物状态及对应的活性特点还有待进一步研究证实。
3 PKM2,复杂调控的模型
根据细胞的需求,细胞有多种调控PK的方式。PKM1是组成型活性四聚体,而其他亚型都能通过变构调节来进行高活性的四聚体与低活性的单体(或者之前提到的二聚体)之间的转换[25]。PKM2四聚体对PEP有着高度亲和性,促进丙酮酸和ATP产生;相反,其单体对PEP亲和性较低[26]。当PKM2处于低活性形态时,所有的糖代谢中间产物可以加速成为生物合成所需要的前体,如氨基酸、核苷酸和磷脂合成(图1)。因此,在PKM2占主导作用的肿瘤细胞内,PKM2高活性/低活性比值决定了葡萄糖是用来产生能量还是合成代谢的前体[27](图1)。
在20世纪60年代,人们发现糖酵解中间产物1,6-磷酸果糖(FBP)可能是PKM2的激活剂[28],后来证实FBP与PKM2可逆性结合,并促进PKM2四聚体结构的形成,因此单体与四聚体转换反映了葡萄糖可利用度的变化。在生理糖浓度时,PKM2大多处于高活性的四聚体形态,只有大约30%为单体;然而当细胞内FBP浓度降低时,如阻断糖摄取后,PKM2大多处于低活性的单体状态[29]。
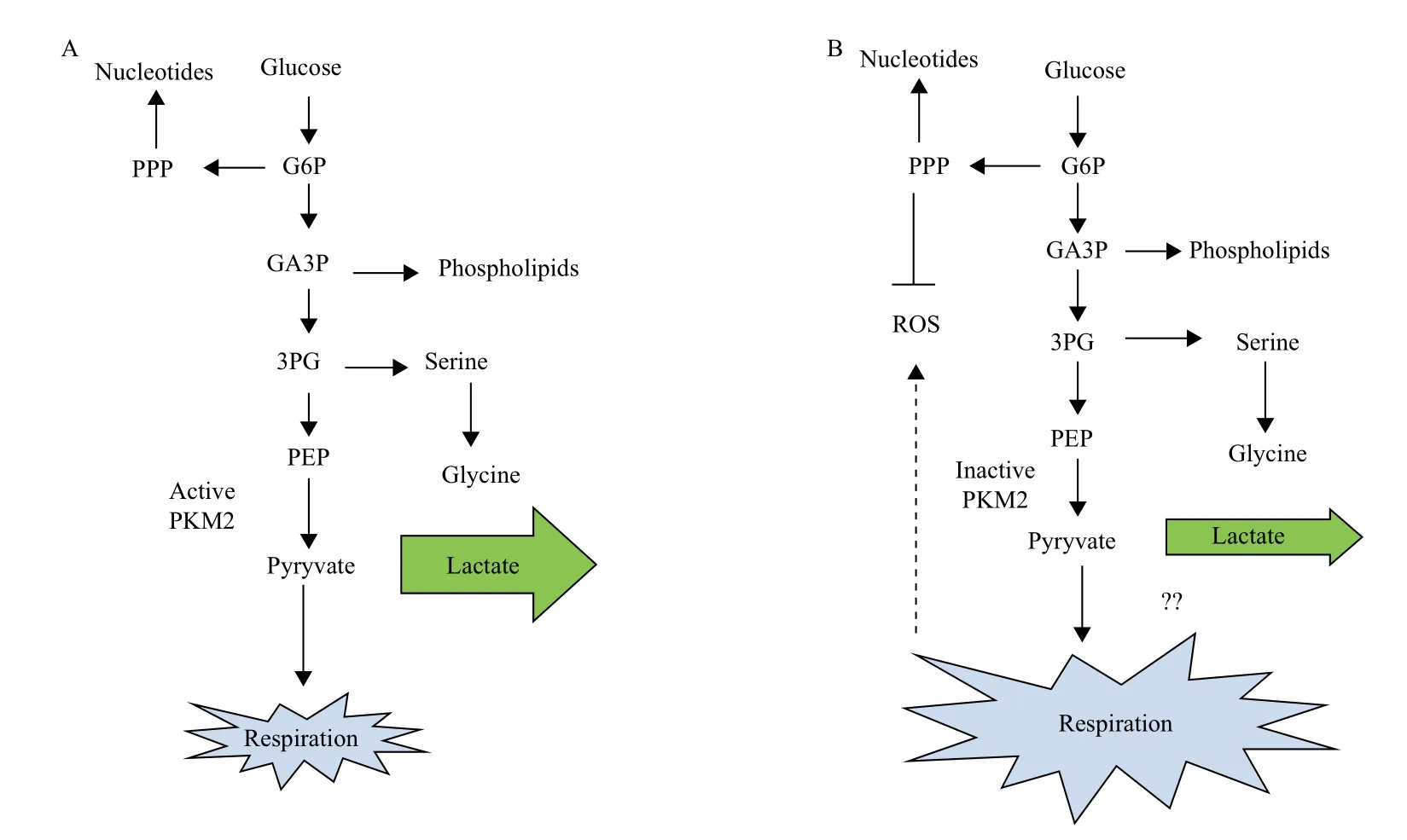
图1 PKM2亚型M2活性的变化对细胞代谢的影响
后来的体外实验证实许多复合物,如氨基酸类和脂肪酸类,都是PKM2的调控子;在PKM2的体外酶活实验中,许多包含一个OH的分子,如丝氨酸、磷脂酰丝氨酸、甲醇和乙醇,都可以上调PKM2的酶活性;而某些氨基酸,如丙氨酸、苯丙氨酸和色氨酸则会抑制PKM2的活性[30]。此外,在v-Src转化细胞中,PKM2的某个未确定的酪氨酸残基被直接磷酸化,降低了PKM2活性。
有活性的PKM2四聚体与其他糖酵解酶,如己糖激酶、磷酸甘油醛脱氢酶、烯醇化酶、磷酸甘油酸变位酶及乳酸脱氢酶形成复合物[31],磷酸化或者致癌事件会将PKM2从这些复合物上分离下来。糖酵解复合物的形成可以解释PKM2如何调控丙酮酸生产乳酸而不是被氧化磷酸化。
4 PKM2调控模式的新认识
近来许多的研究表明,PKM2通过与酪氨酸磷酸化多肽结合来抑制自身的活性,同时释放FBP[32]。由受体酪氨酸激酶引发的酪氨酸磷酸化事件在肿瘤中常见,可调控糖代谢。有趣的是,PKM2的Tyr105也可以被成纤维生长因子受体-1(FGF-1)直接磷酸化,阻止FBP的结合,抑制活性四聚体形成[33]。这种PKM2活性抑制的机制在许多人类癌细胞系中都有发现。在不同的人肿瘤细胞系都有都对PKM2抑制机制有所描述,尽管PKM2磷酸化/非磷酸化形式比值尚不完全清楚。据猜测磷酸化调控的PKM2活性抑制可利于生长因子信号级联促进糖酵解中间体参与生物合成[34]。
研究发现,酵母中低的PK活性会促进呼吸作用,却不会积累活性氧簇(ROS)。实际上,低水平的PK酶活会促进PEP的积累,进而反馈抑制上游糖酵解酶TPI,增强戊糖磷酸途径(PPP)的代谢流,增强细胞的抗氧化损伤能力(图1)。据报道证实,哺乳动物癌细胞内ROS水平的增加,会直接在Cys358位点氧化PKM2,抑制其活性。通过氧化抑制PKM2酶活有利于避免ROS损伤,因为碳元素都经由PPP途径代谢。这种机制可以帮助癌细胞控制ROS水平,在氧化应激下生存。
PKM2乙酰化是另一个翻译后修饰,针对营养环境,保持PKM2低活性并促进更多的糖酵解中间代谢产物用于生物合成[35]。高糖环境可提高乙酰辅酶A的稳态水平,引起P300/CBP关联因子(PCAF)介导的PKM2 K305乙酰化。然而依赖于养分环境的蛋白乙酰化并非PKM2所独用,其他的一系列代谢酶也有类似的修饰。这种新颖的PKM2抑制机制有两个作用[36]:一是降低PKM2对PEP的亲和性;二是通过分子伴侣依赖的自噬来调节PKM2的降解。用赖氨酸乙酰化模拟物谷氨酰胺取代PKM2的乙酰化受体(Lys305)后,体内外实验的结果都表明肿瘤细胞的增殖能力都得到了提高。考虑到高糖水平会导致PKM2的乙酰化(抑制作用)和FBP的产生(激活作用),于是研究Lys305乙酰化如何影响FBP结合将变得很重要。
总的来说,有许多机制抑制PKM2活性,而PKM2的抑制会促进细胞生物合成进程,这也许能解释为什么PKM2亚型能在肿瘤细胞中占据多数。PKM2能对养分和生长因子应答,针对肿瘤细胞不断变化的代谢需求迅速作出反应。
5 PKM2的核内非糖酵解功能
除了已经研究得很清楚的细胞质内功能,细胞核内也存在PKM2。PKM2的核移位依赖于其C端的核定位信号(NLS)[37]。有报道指出PKM2的核移位依赖于与SUMO泛素连接酶PIAS3的互作,后者可以促进PKM2的类泛素化和核移位[38]。据推测,PKM2的核内功能是多样的(图2)。核内PKM2对白细胞介素刺激后的细胞增殖,和凋亡刺激后的细胞坏死是必须的,然而,这些事件的机制都尚未清楚。其他研究提出PKM2可激活转录因子,如β-catenin、Oct-4、Stat3和HIF-1等相互作用,促进细胞生存和增殖[39]。
PKM2结合于EGFR信号激活的磷酸化β-catenin,能促进β-catenin介导的cyclin D1的转录,进而影响细胞周期;最近的研究表明,当细胞膜上的表皮生长因子受体(EGFR)被生长因子激活之后,PKM2蛋白会移动到细胞核中,磷酸化组蛋白H3,调控下游细胞周期相关基因的转录水平,从而影响细胞周期[40-42](图2)。
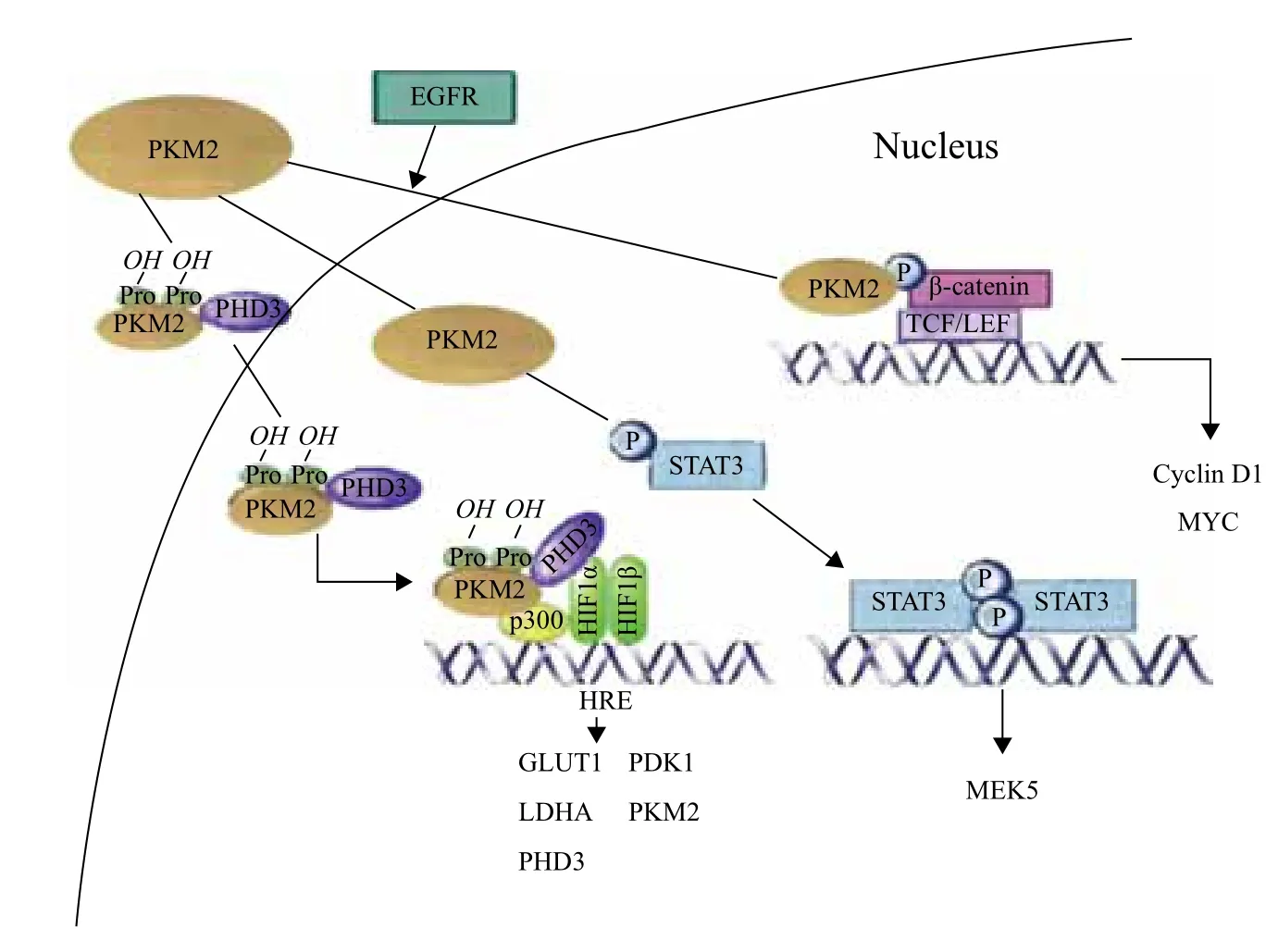
图2 PKM2对基因转录的影响[45]
在低氧条件下PKM2的表达可以被HIF-1激活[43]。然而,最近的研究指出癌细胞中也存在PKM2激活HIF-1的反馈调节机制。PHD3,一种HIF脯氨酰羟化酶,可以直接在Pro403和Pro308羟化细胞核内的PKM2,使得PKM2结合并激活HIF-1,从而引起编码葡萄糖转运蛋白和糖酵解酶的相关基因反式激活[44](图2)。
总之,PKM2的核内功能似乎与细胞增殖相关。这些功能独立于或者互补于PKM2的胞质内功能。与PKM2不同,PKM1的核内移位不会影响细胞的生长和生存。因此,PKM2的核内活性(非糖酵解酶活)才是癌细胞中PKM2高表达的原因。
6 针对PKM2活性调节的潜在治疗策略
PKM2是癌症治疗的重要靶标,所以针对PKM2活性的调节机制进行模拟物或者拮抗物相关的药物设计意义重大。一方面,PKM2在肿瘤细胞中高表达,因此抑制其活性会对肿瘤治疗有益;另一方面,癌细胞中的许多翻译后修饰机制会抑制PKM2活性,作为糖酵解中的重要的代谢酶,相对低的PKM2活性会促进癌细胞增殖所必需的中间代谢产物的积累。因此,设计药物使PKM2面对抑制信号时仍保持活性,这可能会抑制癌细胞扩增。
事实上,PKM2的激活剂和抑制剂都已经被尝试用于阻止癌细胞增殖[46]。起初,人们发现具有亚型特异性和高效力(体外)的PKM2抑制剂确实会阻碍肿瘤细胞的增殖。最近,据报道,一种具有已知抗癌作用的中国草本药物紫草素(shikonin)可以抑制PKM2活性,诱导细胞坏死[47]。
尽管抑制PKM2活性可以阻碍癌细胞增殖这一观点得到实验支持,但是也有研究表明,在体内试验中,用具有组成型活性的PKM1代替被严格调控的PKM2可以大大减缓癌细胞的增殖[48]。这些结果使得PKM2的激活成为一个令人关注的治疗策略,它可以使肿瘤细胞代谢正常化,糖代谢的中间产物用于产能而不是生物合成。不久,一些PKM2的特异性激活子,如FBP被报道出来。这些分子可以增强PKM2与PEP的亲和性。然而,除了用PKM1对PKM2进行遗传代替,还没有其他的证据表明PKM2的激活子对癌细胞有作用。因此,具体何种条件下激活或者抑制PKM2活性可以抑制肿瘤生长,可能是该领域目前最大的挑战。
此外,尽管PKM2入核后对转录因子的调节功能独立于其酶学催化活性,但我们仍需要探索PKM2的激活剂或者抑制剂是否影响PKM2调控的基因表达,这可能帮助人们从更深层次理解PKM2的激活剂或者抑制剂在肿瘤治疗中的功能机制。
7 总结
在过去的10年里,人们对肿瘤细胞中PKM2的功能和调控的认识有显著的提高。然而,即使人们在对PKM2的表达、定位、翻译后修饰和变构调节取得了实质性的进展,但仍有许多有待解决的问题,如PKM2究竟是否是肿瘤特异性亚型;能否为药物介入治疗提供足够指证;PKM2的核内功能对于细胞增殖和肿瘤发生有多大作用;在体内不同生理模式的PKM2是如何共同发挥调控作用的等。尽管关于PKM2有许多“已知的未知”和“未知的未知”,但是其在肿瘤细胞中相对独特的表达和调控方式决定了它一定是肿瘤治疗领域的令人关注的热点。
[1] Warburg O. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8(6):519-530.
[2] Koppenol WH, BoundsPL, DangCV. Otto Warburg’s contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer,2011, 11(5):325-337.
[3] Gupta V, Bamezai RN. Human pyruvate kinase M2:a multifunctional protein[J]. Protein Sci, 2010, 19(11):2031-2044.
[4] Altenberg B, Greulich KO. Genes of glycolysis are ubiquitously overexpressed in 24 cancer classes[J]. Genomics, 2004, 84:1014-1020.
[5] Baek SH. When signaling kinases meet histones and histone modifiers in the nucleus[J]. Mol Cell, 2011, 42:274-284.
[6] Warburg O. On the origin of cancer cells[J]. Science, 1956, 123:309-314.
[7] Muñoz-Pinedo C, El Mjiyad N, Ricci JE. Cancer metabolism:current perspectives and future dire-ctions[J]. Cell Death Dis,2012, 3:e248.
[8] Cairns RA, Harris IS, Mak TW. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11:85-95.
[9] Jacinto E, Loewith R, Schmidt A, et al. Mammalian TOR complex 2 controls the actin cytoskeleton and is rapamycin insensitive[J]. Nat Cell Biol, 2004, 6(11):1122-1128.
[10] Semenza GL. Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics[J]. Oncogene, 2010, 29:625-634.
[11] David CJ, Chen M, Assanah M, et al. HnRNP proteins controlled by c-Myc deregulate pyruvate kinase mRNA splicing in cancer[J]. Nature, 2010, 463:364-368.
[12] Clower CV, Chatterjee D, Wang Z, et al. The alternative splicing repressors hnRNP A1/A2 and PTB influence pyruvate kinase isoform expression and cell metabolism[J]. Proc Natl Acad Sci USA, 2010, 107:1894-1899.
[13]Chen M, David CJ, Manley JL. Concentration-dependent control of pyruvate kinase M mutually exclusive splicing by hnRNP proteins[J]. Nat Struct Mol Biol, 2012, 19:346-335.
[14]Luo W, Hu H, Chang R, et al. Pyruvate kinase M2 is a PHD3-stimulated coactivator for hypoxia-inducible factor 1[J]. Cell,2011, 145(5):732-744.
[15]Chaneton B, Gottlieb E. Rocking cell metabolism:revised functions of the key glycolytic regulator PKM2 in cancer[J]. Trends Biochem Sci, 2012, 37(8):309-316.
[16]Hitosugi T, Kang S, Vander Heiden MG, et al. Tyrosine phosphorylation inhibits PKM2 to promote the Warburg effect and tumor growth[J]. Sci Signal, 2009, 2(97):73-75.
[17]Anastasiou D, Poulogiannis G, Asara JM, et al. , Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses[J]. Science, 2011, 334(6060):1278-1283.
[18]Bluemlein K, Grüning NM, Feichtinger RG, et al. No evidence for a shift in pyruvate kinase PKM1 to PKM2 expression during tumorigenesi[J]. Oncotarget, 2011, 2:393-400.
[19]Chaneton B, Hillmann P, Zheng L, et al. Serine is a natural ligand and allosteric activator of pyruvate kinase M2[J]. Nature, 2012,491(7424):458-462.
[20]Keller KE, Tan IS, LeeYS. SAICAR stimulates pyruvate kinase isoform M2 and promotes cancer cell survival in glucose-limited conditions[J]. Science, 2012, 338(6110):1069-1072.
[21]Bensinger SJ, Christofk HR. New aspects of the Warburg effect in cancer cell biology[J]. Semin Cell Dev Biol, 2012, 23(4):352-361.
[22]Sun Y, Connors KE, Yang DQ. AICAR induces phosphorylation of AMPK in an ATM-dependent, LKB1-independent manner[J]. Mol Cell Biochem, 2007, 306(12):239-245.
[23]Faubert B, Boily G, Izreig S, et al. AMPK is a negative regulator of the Warburg effect and suppresses tumor growth in vivo[J]. Cell Metabolism, 2013, 17(1):113-124.
[24]Yoo YG, Hayashi M, Christensen J, Huang LE. An essential role of the HIF-1alpha-c-Myc axis in malignant progression[J]. Ann N Y Acad Sci, 2009, 1177:198-204.
[25]Lu Z. Nonmetabolic functions of pyruvate kinase isoform M2 in controlling cell cycle progression and tumorigenesis[J]. Chin J Cancer, 2012, 31(1):5-7.
[26]Steták A, Veress R, Ovádi J, et al. Nuclear translocation of the tumor marker pyruvate kinase M2 induces programmed cell death[J]. Cancer Res, 2007, 67(4):1602-1608.
[27] Dombrauckas JD, Santarsiero BD, Mesecar AD. Structural basis for tumor pyruvate kinase M2 allosteric regulation and catalysis[J]. Biochemistry, 2005, 44:9417-9429.
[28]Lv L, Li D, Zhao D, et al. Acetylation targets the M2 isoform of pyruvate kinase for degradation through chaperone-mediated autophagy and promotes tumor growth[J]. Mol Cell, 2011, 42(6):719-730.
[29]Anastasiou D, Poulogiannis G, Asara JM, et al. Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses[J]. Science, 2011, 334(6060):1278-1283.
[30]Weibo L, Gregg LS. Pyruvate kinase M2 regulates glucose metabolism by functioning as a coactivator for hypoxia-inducible factor 1 in cancer cells[J]. Oncotarget, 2011, 2(7):551-556.
[31]Lee J, Kim HK, Han YM, Kim J, et al. Pyruvate kinase isozyme type M2 . PKM2)interacts and cooperates with Oct-4 in regulating transcription[J]. Int J Biochem Cell Biol, 2008, 40(5):1043-1054.
[32]Gao X, Wang H, Yang JJ, et al. Pyruvate kinase M2 regulates gene transcription by acting as a protein kinase[J]. Mol Cell, 2012,45(5):598-609.
[33]Levine AJ, Puzio-Kuter AM. The control of the metabolic switch in cancer by oncogenes and tumor suppressor genes[J]. Science,2010, 330:1340-1344.
[34]Carroll RC, Ash JF, Vogt PK, Singer SJ. Reversion of transformed glycolysis to normal by inhibition of protein synthesis in rat kidney cells infected with temperature-sensitive mutant of Rous sarcoma virus[J]. Proc Natl Acad Sci USA, 1978, 75:5015-5019.
[35]Lunt SY, Vander Heiden MG. Aerobic glycolysis:meeting the metabolic requireements of cell proliferation[J]. Annu Rev CellDev Biol, 2011, 27:441-464.
[36]Hirschhaeuser F, Sattler UG, Mueller-Klieser W. Lactate:a metabolic key player in cancer[J]. Cancer Res, 2011, 71:6921-6925.
[37]Semenza GL. Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics[J]. Oncogene, 2010, 29:625-634.
[38]Semenza GL, Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J]. Mol Cell Biol, 1992, 12:5447-5454.
[39]Epstein AC, Gleadle JM, McNeill LA, et al. C. elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation[J]. Cell, 2001, 107:43-54.
[40] Yang W, Zheng Y, Xia Y, et al. ERK1/2-dependent phosphorylation and nuclear translocation of PKM2 promotes the Warburg effect[J]. Nat Cell Biol, 2012, 14(12):1295-1304.
[41]Yang W, Xia Y, Ji H, et al. Nuclear PKM2 regulates β-catenin transactivation upon EGFR activation[J]. Nature, 2011, 480(7375):118-122.
[42]Yang W, Xia Y, Hawke D, et al. PKM2 phosphorylates histone H3 and promotes gene transcription and tumorigenesis[J]. Cell,2012, 150(4):685-696.
[43]Semenza GL. HIF-1:upstream and downstream of cancer metabolism[J]. Curr Opin Genet Dev, 2010, 20(1):51-56.
[44]Semenza GL. HIF-1 mediates the Warburg effect in clear cell renal carcinoma[J]. J. Bioenerg Biomembr, 2007, 39:231-234.
[45]Tamada M, Suematsu M, Saya H. Pyruvate kinase M2:multiple faces for conferring benefits on cancer cells[J]. Clin Cancer Res,2012, 18(20):5554-5561.
[46]Spoden GA, Mazurek S, Morandell D, et al . Isotype-specific inhibitors of the glycolytic key regulator pyruvate kinase subtype M2 moderately decelerate tumor cell proliferation[J]. Int J Cancer, 2008, 123:312-321.
[47]Chen J, Xie J, Jiang Z, et al. Shikonin and its analogs inhibit cancer cell glycolysis by targeting tumor pyruvate kinase-M2[J]. Oncogene, 2011, 30:4297-4306.
[48]Christofk HR, Vander Heiden MG, Harris MH, et al. The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth[J]. Nature, 2008, 452:230-233.
(责任编辑 狄艳红)
Research Advances on Tumor Cell Metabolism Regulated by PKM2
Xu Kun Wang Ziying
(Anhui University,Hefei 230601)
Tumor cell metabolism is exemplified by high glucose consumption and lactate production. The M2 isoform of pyruvate kinase(PKM2)plays a vital role in this metabolic phenotype, experiments both in vitro and in vivo revealed that over-expression of PKM2 would increase the Warburg effect and promote the tumor growth. However, the mechanisms of how PKM2 regulates tumor cell metabolism are still not completely understood. Current researches have elucidated novel PKM2 regulatory mechanisms. In this review the current understanding is summarized and future directions in this field are explored, highlighting controversies regarding the activity and specificity of PKM2 in tumor. Finally, the potential therapeutic implications and strategies are discussed.
PKM2;tumor cell metabolism;Warburg effect;glycolysis
10.13560/j.cnki.biotech.bull.1985.2015.06.007
2014-10-10
许昆,男,硕士,研究方向:分子生物学、微生物学;E-mail:417387321@qq.com
王子迎,男,博士,教授,研究方向:分子生物学,植物保护;E-mail:1302360619@qq.com
