液态烷烃氧载体对粘红酵母发酵产番茄红素的影响
2015-10-26李娜娜吴晓英吴振强
李娜娜 吴晓英 吴振强
(华南理工大学生物科学与工程学院,广州 510006)
液态烷烃氧载体对粘红酵母发酵产番茄红素的影响
李娜娜 吴晓英 吴振强
(华南理工大学生物科学与工程学院,广州 510006)
研究正己烷、正十二烷、正十六烷3种液态烷烃作为氧载体对粘红酵母生长和番茄红素合成的影响,发现氧载体不仅使菌体生物量提高,同时使单位细胞的番茄红素产率增大,从而提高粘红酵母合成番茄红素的能力。3种液态烷烃中正十二烷作为氧载体效果较好,试验结果表明,在发酵第0 h时添加4%的正十二烷,细胞生物量达到16.49 g/L,番茄红素合成量达到42.32 mg/L分别比对照组提高了26.2%和50.17%。
粘红酵母;番茄红素;液态烷烃;氧载体;传递效率
番茄红素是一种具有11个共轭双键和两个非共轭双键的不饱和碳氢化合物,是许多类胡萝卜素生物合成的中间体,其经过环化后可形成其他种类的类胡萝卜素,如β-胡萝卜素、玉米黄素、虾青素等[1]。番茄红素具有很强的抗氧化作用,其对单线氧的清除能力是β-胡萝卜素的2倍,在类胡萝卜素中最强[2],同时番茄红素还具有对自由基的清除、抵挡UV导致的皮肤光伤害[3-5]、阻断形成亚硝胺、抑制肿瘤细胞增殖、诱导细胞分化、减少 DNA 损伤以及促进细胞间隙连接通讯等作用[6,7],故其在淬灭单线态氧、消除氧自由基、降低癌症发病率、增强人体免疫功能以及防治心血管疾病方面具有良好的应用前景[8-12]。
目前,生产天然类胡萝卜素的主要菌种为三孢布拉氏霉(Blakeslea trispora)和红酵母(Rhodotorular)。虽然与三孢布拉氏霉相比,红酵母的单位产量比较低,但由于其具有营养要求简单、生长周期短、易于放大培养、菌体营养丰富等许多优点,具有很高的实用价值。
粘红酵母发酵生产番茄红素是好氧发酵过程,溶氧水平会影响细胞类胡萝卜素的产率,为了保证发酵中氧的供应,通常是采用大通气量及高搅拌输出功率相结合的方法,造成动力成本上升,并因剪切力过大,泡沫增多,不易控制等从而不利于发酵生产。
近来年,新的强化传氧技术的发展方向之一就是向发酵液中引入一种新的液相,以减少气液传氧阻力,从而提高传氧效率[13]。这种液相一般具有比水更高的溶氧能力,且与发酵液互不相溶,称为氧载体。有文献报道[14]加入诸如煤油、正己烷、正十二烷等氧载体后,可提高同一反应系统的Kla(传氧系数)值30%-300%,或达到同一混合效果降低搅拌功率30%以上的优点。目前,国内用液态烷烃作为氧载体发酵粘红酵母产类胡萝卜素鲜有报道,本研究主要研究不同液态烷烃氧载体对粘红酵母液态发酵生产番茄红素的影响,旨在探讨氧载体在相应发酵体系中的作用。
1 材料与方法
1.1 材料
1.1.1 菌种 本实验室保藏的粘红酵母(Rhodotorula glutinis)2.27,-80℃冷冻保存。
1.1.2 主要仪器和试剂 番茄红素标准品(≥95%),上海融合科技发展有限公司;烟碱(95%),西安天则生物技术有限责任公司。
SHP-450D型生化培养箱,上海森信实验仪器有限公司;SKYB2112B型恒温摇床,广州科桥实验技术设备有限公司;LD5-2A低速离心机,背景医用离心机厂;2802S型紫外分光光度计,尤尼科(上海)仪器有限公司;Waters高效液相色谱仪1525、Waters紫外分光检测器2487。
1.1.3 培养基与培养方法 斜面活化培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母粉10 g/L,琼脂20 g/L,pH自然。
液体种子培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母粉10 g/L,pH自然。
液体发酵培养基:葡萄糖50 g/L,蛋白胨15 g/L,酵母粉10 g/L,核黄素0.5 mg/L,初始pH5。
种子斜面活化培养:挑取一环粘红酵母接入斜面活化培养基中,28℃培养48 h。
液体种子培养:从活化了的斜面种子中挑取两环黏红酵母接种于装有30 mL液体种子培养基的250 mL三角瓶内,28℃下200 r/min振荡培养24 h。
液体发酵培养:以5%的接种量,将液体种子接入到装有25 mL发酵培养基的250 mL三角瓶中,28℃下200 r/min振荡培养96 h。
1.2 方法
1.2.1 氧载体试验 选择正己烷、正十二烷、正十六烷作为待测氧载体,通过0.22 μm滤膜过滤除菌。筛选氧载体试验中,在接种的同时分别进行添加浓度同为2%(V/V)的正己烷、正十二烷、正十六烷,在发酵24 h添加环化酶抑制剂烟碱,继续发酵至96 h。考察具有不同LogP值的氧载体对粘红酵母产番茄红素的影响。所有试验均做3个平行。
1.2.2 生物量的测定 发酵结束后,取10 mL液体发酵液转入离心管中,以4 000 r/min离心10 min,弃去上清液,沉淀水洗离心两次,得到酵母泥,于60℃下过夜烘干,称干重量。
1.2.3 番茄红素的提取 发酵结束后,参照文献[15]采用热酸法破壁。
丙酮浸提:取发酵液10 mL转入离心管中,以4 000 r/min离心10 min,沉淀水洗后得到酵母泥;加入3 mol/L的HCl溶液5 mL,混合均匀后浸泡90 min,然后沸水浴6 min,迅速冷却,再4 000 r/min离心10 min,得沉淀水洗2次,离心后得到菌体残片;加入丙酮9 mL,混合均匀,浸提60 min,4 000 r/min下离心10 min,得到色素丙酮浸提液。
1.2.4 番茄红素含量测定方法 将色素提取液用0.22 μm的微孔滤膜过滤后,以高效液相色谱法(HPLC)测定提取液中番茄红素的含量。同时配制不同浓度的标准品溶液,在相同条件下测定,根据峰面积制备标准曲线定量。
Waters-1525高效液相色谱仪;色谱柱为:Agilent HCC18柱(5 μm,250 mm×4.6 mm);Binary高效泵;检测器为:Waters-2487,Double Absorbance Detector;数据分析软件:Breeze。
高效液相色谱条件:流动相为V(乙腈)∶V(甲醇)∶V(二氯甲烷)=21∶21∶8,检测波长为472 nm,流速为1.5 mL/min,柱温为28℃,进样量为10 μL。
2 结果
2.1 番茄红素标准曲线
准确称量2.0 mg的番茄红素标准品,用丙酮溶解,定容于10 mL的棕色容量瓶中,质量浓度为200 μg/mL。再分别稀释成150、100、50、25和12.5 μg/mL的质量浓度梯度,经0.22 μm滤膜过滤后HPLC检测,数据处理,得到峰面积与质量浓度的关系,如图1所示。
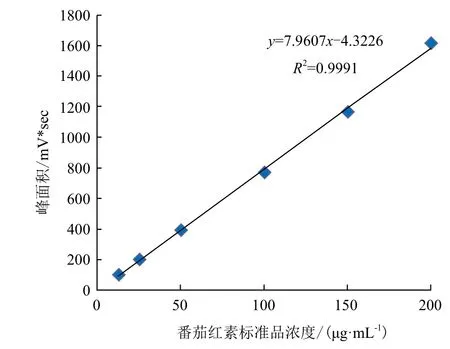
图1 番茄红素的标准曲线
2.2 对氧载体的筛选
有机溶剂对细胞生长的影响与其在辛醇-水系统中的分配系数LogP密切相关,即LogP越高,对细胞的刺激性或者毒性越小,生物相容性越好。Laane等[16]曾提出生物相容性较好的溶剂其LogP应该大于4。参照表1中的相关数据,本试验考察了正己烷、正十二烷、正十六烷作为氧载体对粘红酵母产番茄红素的影响,结果如表2所示。
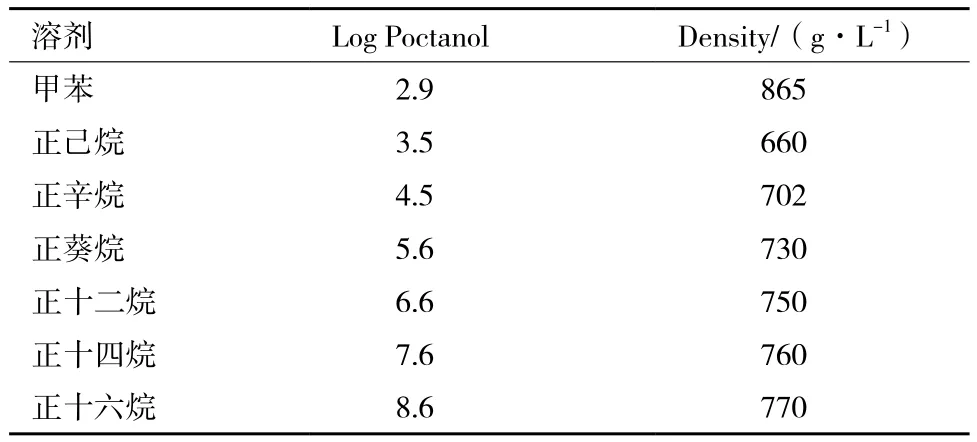
表1 有机溶剂的物理性质
本试验考察的3种液态烷烃氧载体中,正十六烷对细胞生长最有利,但正十二烷对粘红酵母合成番茄红素最有利(表2)。当正十二烷的添加体积分数为2%时,生物量和番茄红素产量达到16.6 g/L和46.9 mg/L,分别比对照组增长了25.37%和46.9%。正己烷对粘红酵母生长和番茄红素合成也都有一定的促进作用,但效果不显著。综合考虑,正十二烷是粘红酵母生长和番茄红素合成的最佳氧载体。
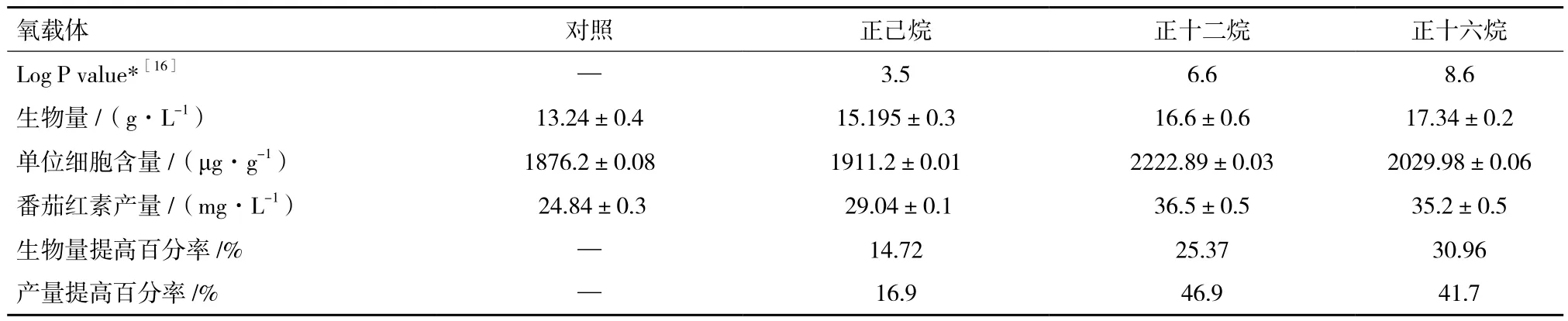
表2 不同有机溶剂作为氧载体对粘红酵母生长和番茄红素合成的影响
2.3 正十二烷不同添加浓度的影响
表2的结果已经证实正十二烷是粘红酵母生长和番茄红素合成的最佳氧载体,因此对其添加浓度和添加时间作了进一步优化考察。在发酵的初始,向发酵液中分别添加0%,1%、2%、4%、8%和12%不同浓度的正十二烷,发酵结束后使用高效液相色谱(HPLC)测定番茄红素含量以确定氧载体的最优加入时间。试验结果(图2)显示,添加正十二烷的试验组的生物量和番茄红素产量都高于未添加的对照组,随着正十二烷浓度的不断增大,粘红酵母的生物量和番茄红素产量均呈现先上升后下降的趋势,当正十二烷的浓度为2%时,生物量达到最大值16.9 g/L,比对照组增加29.4%,番茄红素产量则在正十二烷的添加浓度为4%时达到最大值42.32 mg/L,比对照组提高了50.17%。从发酵液的表观上可以看出,加入8%和12%的正十二烷时,摇瓶中存在显著的较大油滴易于浮于表面,而正十二烷的加入量为2%和4%的摇瓶中则分散乳化效果较好,从而更有利于油-水两相间的接触与物质传递。可见,正十二烷作为氧载体有利于菌体的生长,并能提高单位细胞番茄红素的合成能力,二者的共同作用使番茄红素的产量显著增加。究其原因可能是一方面液态烷烃起到了分散剂的作用,增加氧气界面的传递面积,从而利于粘红酵母细胞的生长,另一方面液态烷烃作为氧载体,可以刺激粘红酵母合成积累番茄红素。
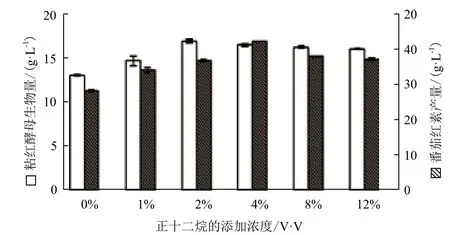
图2 不同浓度的正十二烷对粘红酵母的生长和产番茄红素的影响
2.4 4%的正十二烷不同添加时间对发酵的影响
使用氧载体的时间应该是发酵体系出现溶氧限制时,此时加入氧载体可以解决溶氧不足的限制,提高发酵生产能力。液体发酵粘红酵母生产番茄红素的过程中,分别在不同的时间点加入4% 的正十二烷,发酵结束后使用高效液相色谱(HPLC)测定番茄红素含量以确定氧载体的最优加入时间。试验结果(图3)显示,随着添加4%的正十二烷的时间的推移,粘红酵母的生物量和番茄红素产量都呈一个下降的趋势,在发酵开始添加4%的正十二烷的生物量为17.015 g/L,比在发酵84 h时添加4%的正十二烷的生物量13.17 g/L提高了29.1%,番茄红素的产量达到最大43 mg/L,比在84 h添加获得的番茄红素产量30.6 mg/L提高了40.52%。在发酵初期加入正十二烷作为氧载体对粘红酵母的生长效果明显,可能因为早期加入的正十二烷,可以及时缓解粘红酵母培养过程中氧气不足的问题。

图3 4%的正十二烷的不同添加时间对粘红酵母的生长和产番茄红素的影响
2.5 添加氧载体对粘红酵母发酵过程的影响
在液体发酵粘红酵母生产番茄红素的过程中的0 h时添加氧载体正十二烷4%,定时取样测量相关参数,试验组与对照组中粘红酵母的生物量、番茄红素产量、pH、残糖含量的变化结果如图4所示。
从图4中可以看出,添加氧载体有利于菌体生长(图4-A)并提高了单位细胞类胡萝卜素的合成能力(图4-E),两者的共同作用促使番茄红素产量显著增加(图4-B)。发酵液的pH的变化趋势基本一致,但添加氧载体的发酵液稍低于对照组试验(图4-C),这与刘元帅等[17]研究添加液态烷烃氧载体对法夫酵母发酵生产虾青素的影响中发现添加正十六烷的试验组的pH值稍微低于对照组的结果一致。基于试验结果推测这可能是由于正十二烷的添加,促进菌体的生长,从而加快对氮源的吸收利用。添加氧载体还增大了细胞对葡萄糖的利用率,葡萄糖消耗明显加快(图4-D),这可能也是氧载体促进细胞生长和番茄红素合成的一个重要原因。
3 讨论
氧载体双液相发酵,强化发酵过程中的氧传递,主要来自两个方面:一是氧在氧载体中的溶解度大大高于氧在水中的溶解度,如据Wang等[14]报道的有机溶剂正十二烷,氧载体的添加实际是增大了氧传递的总推动力(C*-C);另一方面是由于氧载体在培养基中的分散、乳化,增大了氧传递的相面积,从而大大提高了氧的体积传递系数,有利于氧传递[13]。因此可将这些有机溶剂作为氧载体加入发酵液以提高溶氧浓度,对于某些对氧浓度要求高的发酵过程,添加适宜浓度的有机溶剂可大幅度提高目的产物的合成水平[18]。
虽然国内外已有大量试验证明,向发酵液中添加液态烷烃作为氧载体确实能促进代谢产物的合成。Da Silva、 Mendes等[19,20]研究正十二烷对隐甲藻发酵产DHA产量的影响中,发现正十二烷作为一种便宜的有机溶剂被添加到发酵培养基中时,一方面可以作为氧载体来增强氧的传递;另一方面作为一种有机相,可以增加DHA产量和浓缩脂肪酸。Xu等[21]向培养基中添加氧载体正十二烷和正十六烷能提高三胞布拉氏霉菌合成番茄红素的能力。
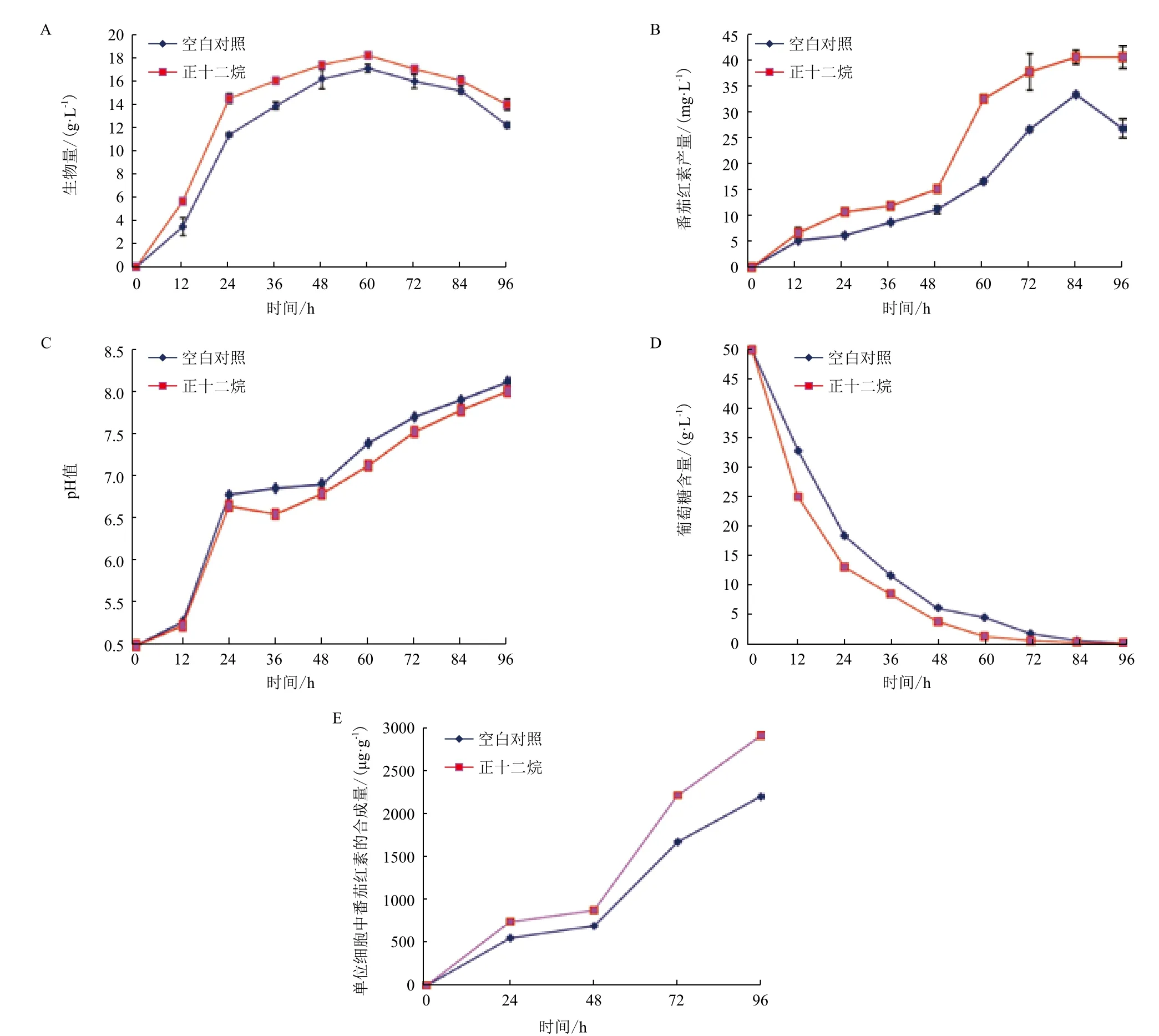
图4 添加氧载体(4%,正十二烷 )对细胞生长(A)、番茄红素合成(B)、pH值(C)、葡糖糖消耗的影响(D)和单位细胞番茄红素的合成量(E)
但目前为止国内对氧载体的研究较少,本研究利用正己烷、正十二烷、正十六烷3种液态烷烃作为氧载体,考察其对粘红酵母生长和番茄红素合成的影响,发现氧载体正十二烷是一种经济的提高粘红酵母生物量和番茄红素产量的有机溶剂。但不同氧载体对菌体生长促进程度和对粘红酵母合成积累番茄红素促进效果不同,一方面可以考虑把不同氧载体组合优化,考察其对粘红酵母产番茄红素的影响;另一方面利用表面活性剂可以改变发酵液流体特性和菌体通透性,构建氧载体偶联表面活性剂体系研究其对粘红酵母产番茄红素的影响。
4 结论
本研究首次将液态烷烃氧载体应用于粘红酵母产番茄红素的研究中,考察正己烷,正十二烷、正十六烷对粘红酵母合成积累番茄红素的影响,发现氧载体不仅使菌体生物量提高,同时使单位细胞的番茄红素产率增大,从而提高粘红酵母合成番茄红素的能力。结果表明,3种液态烷烃中正十二烷作为氧载体效果较好,在发酵第0 h时添加4%的正十二烷,细胞生物量达到16.49 g/L,番茄红素合成量达到42.32 mg/L分别比对照组提高了26.2%和50.17%。正十二烷价格低廉并且可重复利用,作为粘红酵母发酵产番茄红素的氧载体具有较高的工业应用价值和潜力。
[1]徐志强, 余晓斌, 郑亚平.类胡萝卜素代谢工程[J].天然产物研究与开发, 2003, 15(1):259-263.
[2]陈伟, 丁霄霖.番茄红素化学和生物学特性[J].粮食与油脂,2002(7):47-49.
[3]Gross MD, Snowdon DA. Plasma antioxidant concentration sina population of elderly women:Findings from the nunstudy [ J]. NutrRes, 1996, 16(11):1881-1890.
[4]Fazekas Z, Gao D, Saladi RN, et al. Protective effects of lycopene against ultraviolet B-induced photodamage [J]. Nutrition and Cancer, 2003, 47(2):181-187.
[5]Stahl W, Heinrich U, Aust O, et al. Lycopene-rich products and dietary photo protection [J]. Photo Chemical & Photo Biological Sciences, 2006, 5(2):238-242.
[6]Clinto SK. Lycopene:chemistry, biology, and implication for human health and disease [J]. Nutr Rev, 1998, 56(2):35-51.
[7]Bramley PM. Is lycopene beneficial to human health?[ J]. Phyto Chemistry, 2000, 54(3):233-236.
[8]Pohar KS, Gong MC, Bahnson R, et al. Tomatoes, lycopene and prostate cancer:a clinicians guide for counseling those at risk forprostate cancer [J]. World J Urol, 2003, 21(1):9-14.
[9]Schünemann HJ, McCann S, Grant BJB, et al. Lung function in relation to intake of carotenoids and other antioxidant vitamins in a population-based study[J]. American Journal of Epidemiology,2002, 155(5):463-471.
[10]Watzl B, Bub A, Briviba K, et al. Supplementation of a low carotenoid diet with tomato or carrot juice modulates immune functions in healthy men [J]. Ann Nutr Metab, 2003, 47(6):255-261.
[11]Rao AV. Lycopene, tomatoes, and the prevention of coronary heart disease [J]. Exp Biol Med, 2002, 227(10):908-913.
[12]Pohar KS, Gong MC, Bahnson R, et al. Tomatoes, lycopene and prostate cancer:a clinician’s guide for counseling those at risk for prostate cancer[J]. World Journal of Urology, 2003, 21(1):9-14.
[13]Rols JL, Goma G. Enhancement of oxygen transfer rates in fermentation using oxygen-vectors [J]. Biotechnology Advances,1989, 7(1):1-14.
[14] Wang JL. Enhancement of citric acid production by Aspergillusnigerusing n-dodecane as an oxygen-vector [J]. Process Biochemistry, 2000, 35(10):1079-1083.
[15]王振文, 赵亚军, 郝超焰.麦角固醇生物合成抑制剂发展历史及其对农业的贡献[J].农药, 1985, 18(2):38.
[16]Hejazi MA, De Lamarliere C, Rocha JMS, et al. Selective extraction of carotenoids from the microalga Dunaliella salina with retention of viability [J]. Biotechnol Bioeng, 2002, 79(1):29-36.
[17]刘元帅, 石国领, 吴建勇.添加液态烷烃氧载体对法夫酵母发酵生产虾青素的影响[J].食品与发酵工业, 2005, 31(6):43-46.
[18]Liu YS, Wu JY. Use of n-hexadecane as an oxygen vector to improve Phaffia rhodozyma growth and carotenoid production in shake-flask cultures[J]. J Appl Microbiol, 2006, 101(5):1033-1038.
[19]Da Silva TL, Mendes A, Mendes RL, et al. Effect of n-dodecane on Crypthecodinium cohnii fermentations and DHA production [J]. J Ind Microbiol Biotechnol, 2006, 33(6):408-416.
[20]Da Silva TL, Reis A. The use of multi-parameter flow cytometry to study the impact of n-dodecane additions to marine dinoflagellate microalga Crypthecodinium cohnii batch fermentations and DHA production [J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(8):875-887.
[21]Xu F, Yuan QP, Zhu Y. Improved production of lycopene and β-carotene by Blakeslea trispora with oxygen-vectors [J]. Process Biochemistry, 2007, 42(2):289-293.
(责任编辑 马鑫)
A Effect of Liquid Alkane Oxygen-vectors on Rhodotorula Fermentations and Lycopene Production
Li Nana Wu Xiaoying Wu Zhenqiang
(School of Bioscience&Bioengineering,South China University of Techology,Guangzhou 510006)
Addition of oxygen-vectors(n-hexane, n-dodecane, hexadecane)to fermentation medium was recognized as a method of enhancing oxygen transfer and promoting lycopene yield by Rhodotorula fermentation. n-dodecane as an oxygen-vector is the best in three kinds of liquid alkane. Experimental results show that the biomass of Rhodotorula attained 16.49 g/L and the yield of lycopene biosynthetic reached 42.32 mg/L by adding 4% n-dodecane in the 0 h, which was 26.2% and 50.17% higher than the control group, respectively.
Rhodotorula;lycopene;liquid alkane;oxygen-vectors;oxygen transfer
10.13560/j.cnki.biotech.bull.1985.2015.02.029
2014-08-19
李娜娜,女,硕士研究生,研究方向:生物活性物质的研究;E-mail:759365635@qq.com
吴晓英,女,副教授,硕士生导师,研究方向:生物制药与生物资源的综合利用;E-mail:xywu@scut. edu. cn
