牦牛绒DNA的提取及验证
2015-10-26肇慧君颜怀玉杨春光
王 玫 任 亮 孔 平 肇慧君 颜怀玉 杨春光
(辽宁出入境检验检疫局,辽宁大连 116001)
牦牛绒DNA的提取及验证
王 玫任 亮*孔 平肇慧君颜怀玉杨春光
(辽宁出入境检验检疫局,辽宁大连116001)
提取DNA是利用PCR技术检测纤维的关键技术难点。对牦牛绒DNA的提取方法进行了试验,通过PCR扩增的方法进行验证。结果表明:使用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0 试剂盒,将纤维样品尽量处理成粉末状,并在样品经裂解液处理后先离心除去其中尚未完全溶解的纤维,然后进行PCR扩增是比较有利的,完全能够得到满足PCR扩增要求的DNA样品。
牦牛绒DNA提取方法验证
牦牛是高寒地带的特有畜种,主要生活在海拔3000 m以上[l]。我国具有非常丰富的牦牛毛纤维资源[2]。牦牛绒主要作为纺织用高档纤维原料;牦牛毛作为毡制品、绳索等低附加值产品原料,以及用于制作假发制品等。随着生活水平的提高,人们对于天然真发制品的需求量越来越大,而有限的人发资源无法满足,牦牛毛正成为其重要的替代原料。常见的牦牛绒制品有纯绒产品,但混纺产品也占有一定比例。有些商家为了牟取利益,将混纺产品冠以“纯牦牛绒”的桂冠,使消费者上当。掺进了锦纶或粘胶纤维的产品,从外表光泽等方面很难辨别。利用PCR技术鉴别动物纤维是近年来的研究热点,而DNA的提取是利用PCR技术检测纤维的关键技术难点。
自1975年Bradfied等成功地从头发中提取DNA以来,发毛已成为法医学、遗传学常用的检测材料之一,它具有无创、取材痛苦性小、运输和储存方便、可重复性高等优点[3]。已报道的获可取DNA的样品包括毛发、粪便、尿液、脱落羽毛、含口腔脱落细胞的食物残渣、鳞片以及卵壳等[4]。毛发中的DNA主要集中在毛囊细胞中,毛干部分仅含有少量线粒体DNA[5]。在从动物体上采集或脱落的毛发中,绝大多数都带有完整的毛囊[6]。王庆林等研究表明从被毛毛囊细胞中提取DNA的最大缺点是获得的DNA量非常少,如操作不慎,就有可能提取不到DNA[7]。毛干相对于毛囊,其DNA含量更少,几乎所有成分都是角蛋白,但作为动物组织,毛干具有细胞结构,如果提取方法得当仍可以获得一定量的DNA[8]。吴云良通过对细胞的煮沸和冷却,使细胞破裂、蛋白质变性,从而获得用于PCR扩增的模板DNA的法为提取东北虎毛发中DNA[9]。徐怀亮等提出一种快捷、简便、经济、高效、安全的有效的提取藏酋猴毛干中DNA的方法-纳米磁珠法,并指出进行毛发取样时以5~10根较为合适[10]。目前,国内从动物毛皮中提取DNA的方法,主要采用经典的DNA提取技术:蛋白酶K法裂解结合酚-氯仿抽提[11];研究对象主要是一些珍稀动物如小熊猫[12]、鬣羚[13]、麝科动物[14]、扬子鳄[15]等的陈旧毛皮标本。虽然有关毛干DNA提取的报道已屡见不鲜,但由于毛干DNA含量低、髓质层与皮质层中含大量色素不易与DNA分离而抑制PCR扩增等问题[16,17],常造成DNA提取、纯化困难,导致分子生物学相关研究受到限制,影响下游工作。
关于牦牛绒DNA提取方面的报道较少,本文对牦牛绒DNA提取方法进行了实验与研究,采用PCR扩增的手段对方法的可靠性进行验证。
1 实验材料与仪器
1.1试剂
实验用水应符合GB/T 6682中一级水的规格,组织和毛发提取试剂盒TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0(TaKaRa Code.9765),Premix Ex Taq™(Probe qPCR)(TaKaRa Code.RR390A),100%乙醇,DNA Laddar Marker。
1.2仪器与设备
冰箱:4℃~20℃,天平:感量0.000 1g,分析研磨机,剪刀,恒温水浴锅,离心机(12 000 rpm),涡旋混合器,微量可调移液器:0.1~2.5 μl,1~10 μl,2~20 μl,10~100 μl,20~200 μl,100~1 000 μl,1.5ml离心管,超净工作台,PCR仪,实时荧光定量PCR仪,电泳装置,凝胶成像仪。
2 实验方法与步骤
2.1取样
从牦牛绒制品的不用部位取样,共取约1 g试样。
2.2制样
用剪刀将样品剪碎,经分析研磨机打散混匀,再用剪刀尽量剪碎至2 mm以下,再次用分析研磨机混匀。
2.3DNA的提取
从混匀的样品中称取约5 mg试样,放入2 ml离心管中,每个样平行提取2管,加入 180 μl的 缓冲液GL(Buffer GL)、20 μl的蛋白酶K(Proteinase K)和10 μl的 核糖核酸酶A(RNase A)于 56 ℃水浴至组织完全裂解2h。如残存纤维状组织无法完全裂解,裂解之后先 12 000 rpm离心 2 min,去除杂质之后再进行后续操作。向裂解液中加入200μl缓冲液GB(Buffer GB)和 200μl 100%乙醇,充分吸打混匀。将 Spin Column 安置于 Collection Tube上,溶液移至 Spin Column中,12 000 rpm离心 2 min,弃滤液。将 500μl的缓冲液WA(Buffer WA)加入至 加入至ColumnSpin Column中,12 000 rpm离心1 min,弃滤液。将 700μl的缓冲液WB(Buffer WB)加入至 加入至ColumnSpin Column中,12 000 rpm离心1 min,弃滤液。重复一次,将 700μl的 Buffer WB加入至 加入至ColumnSpin Column中,12,000 rpm离心1min,弃滤液。将 Spin Column安置于TubeCollection Tube上,12,000 rpm离心2min。将Spin Column安置于新的 1.5 ml的离心管上,在 Spin Column膜的中央处加入35μl的灭菌水,室温静置 5min。12 000 rpm离心 2 min洗脱 DNA。以上操作中的Buffer GL、Buffer WA、Buffer WB以及Spin column、Collection Tube均来自宝生物工程(大连)有限公司TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0试剂盒。
2.4引物探针信息
本文所用的引物和探针均由TakaRa宝生物工程(大连)有限公司合成,具体见表1。

表1 牦牛绒成分荧光定量PCR引物及探针
3 结果与分析
3.1DNA提取效果
DNA提取结束后对其进行了DNA电泳以确保其DNA的提出,具体结果见图1。由图1 可见,提取的DNA扩增条带清晰,提取效果良好。
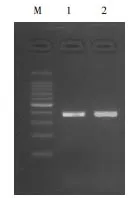
图1 提取牦牛绒DNA电泳图
3.2引物特异性验证
在优化好的PCR反应条件和反应体系下,以鸭绒、鹅绒、绵羊毛、兔毛、山羊绒、牦牛绒、羊驼毛的DNA为特异性试验对照进行PCR检测。电泳结果显示,仅有牦牛绒被扩增出条带,而阴性对照未扩增出条带,证明牦牛绒引物的特异性良好,将其应用于PCR方法,牦牛绒成分可以从其他纤维中有效地鉴别出来,具体结果见图2。
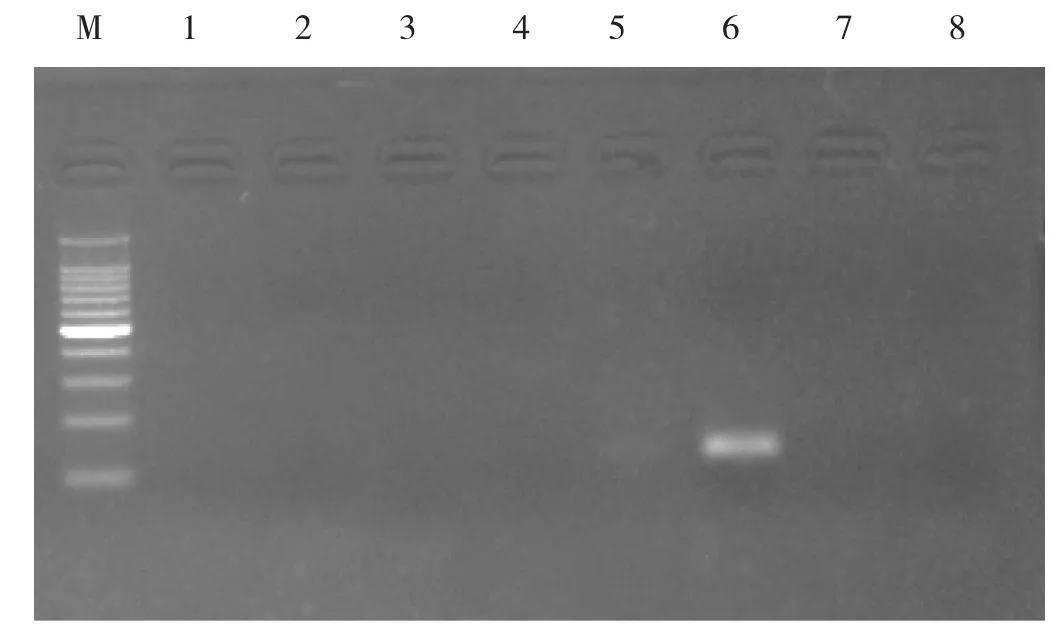
图2 PCR特异性检测结果
3.3检测体系及结果
3.3.1反应体系及反应条件
(1)PCR反应体系:
以提取的牦牛绒DNA为模板,每次反应均设阴性对照和阳性对照。实时荧光PCR反应体系25 μl,具体见表2。

表2 荧光定量PCR反应体系
(2)反应条件:
本试验建立的荧光定量PCR初步反应参数包括预变性、变性、退火延伸3步。实时荧光定量PCR初步反应参数见表3。

表3 荧光定量反应条件参数
ABI 7500 Fast Real Time System荧光定量PCR仪完全封闭操作,仪器可以直接读数,荧光定量PCR荧光信号在每一循环延伸步骤完成后收集,并立即显示出结果,可实时观察每一循环收集荧光信号的强度。
3.3.2检测结果
(1)Ct值及结果判定:
在优化好的荧光PCR反应条件和反应体系下,选择鸭绒、鹅绒、绵羊毛、兔毛、山羊绒、牦牛绒、羊驼毛的DNA为特异性试验的对照来进行荧光PCR检测。检测结果显示,仅牦牛绒Ct值为24.412,而其他样品及阴性对照无Ct值,结果及判定见表4。
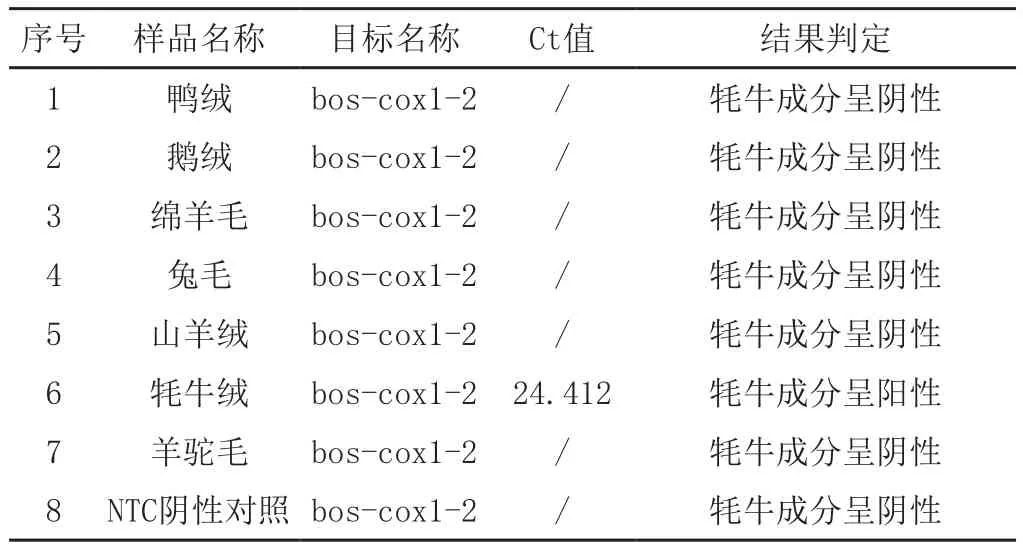
表4 Ct值及结果判定
(2)荧光PCR检测特异性试验结果:
在优化好的荧光PCR反应条件和反应体系下,选择鸭绒、鹅绒、绵羊毛、兔毛、山羊绒、牦牛绒、羊驼毛的DNA为特异性试验的对照来进行荧光PCR检测。检测结果显示,仅牦牛绒有扩增曲线,而其他对照以及空白对照均没有扩增曲线,表明本实验设计的特异性引物和探针与牦牛基因具有较高同源性,而与其他常见动物物种的基因并没有同源性,该检测方法具较强的特异性。具体结果见图3。
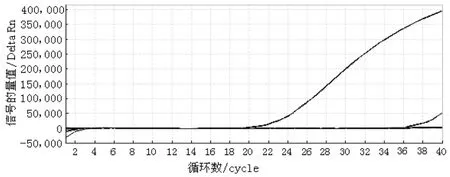
图3 牦牛绒DNA荧光PCR结果
4 结论
使用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0 试剂盒提取牦牛绒DNA,经检测验证,DNA扩增曲线良好,电泳条带清晰单一,空白对照是阴性结果,引物对在其他几种动物纤维体系内,包含鸭绒,鹅绒,绵羊毛,兔毛,山羊绒和羊驼毛,没有扩增。引物探针反应性能和特异性良好,该试剂盒提取牦牛绒纤维DNA可以用于牦牛绒检测。实验时将纤维样品尽量处理成粉末状,并在样品经裂解液处理后先离心除去其中尚未完全溶解的纤维,然后进行PCR扩增是比较有利的,完全能够得到满足PCR扩增要求的DNA样品。
[1] 蔡立.中国牦牛[M].北京:农业出版社,1992,l-5.
[2] 陆仲磷.中国牦牛科学技术发展回顾与展望[J].中国牛业科学,2007,33(4):3-133.
[3] Bradfield RB,Gray SO.Letter:simplified procedure for field preparation of hair DNAspecimens[J].Lancet,1975,1(7903 ):406-409.
[4] TaberletP,Vaits L P,LuikartG.Noninvasive genetic sampling:look before you leap[J].Trends in Ecology& Evolution,1999,14(8):323-327.
[5] 黄娅琳.一种简便的DNA提取方法在动物毛发检验中的应用[J].中国司法鉴定,2008(2):25-27.
[6] 赵春江,李宁.一种从毛发中提取DNA的简易方法[J].遗传2003,25(1):69-70.
[7] 王庆林,梁子安,郑应志,等.从南阳黄牛被毛毛囊中提取DNA方法初探[J].河南农业科学2005(7):95-96.
[8] 苏一,边连全,宣之兴.猪毛干部位基因组DNA的三种提取方法比较[J].湖北农业科学,2010,49(10):2337-2340.
[9] 吴云良,陈晶,陈清,等.提取东北虎毛发DNA两种方法的比较研究[J].中国畜牧兽医,2007,34(9):33-35.
[10] 徐怀亮,汪宴廷,姚永芳.藏酋猴毛干DNA的3种提取方法[J].东北林业大学学报第2010,38(2):58-61.
[11] 蔡大伟,于慧鑫,赵欣,等.一种简便高效的古代动物毛皮DNA提取方法[J].吉林大学学报(理学版)2010,48(4):689-693.
[12] 饶刚,李明,牛屹东,等.陈旧皮张中DNA提取的新方法[J].动物学杂志,2001,36(4):53-57.
[13] 崔雨新,王小明.鬣羚干皮标本中的DNA提取和PCR扩增[J].四川动物,2000,19(1):16-18.
[14] 李明,王小明,黄步军,等.麝科动物干皮标本中的DNA扩增[J].华东师范大学学报:自然科学版,1998(1):110-111.
[15] 史燕,吴孝兵,晏鹏,等.扬子鳄鞣制皮革和鳞片的DNA提取方法[J].动物学报,2004,50(2):297-301.
[16] UCHIHI R,TAMAKI K,KOJlMA T,eta1.Deoxyribonucleic-acid(DNA)typing of human-leukocyte antigen(hla)-dqal from singte hairs in japanese[J].Journal of Forensic Sciences,1992,37(3):853-859.
[17] NOZAWA H,YAMAMOTO T,UCHIHI R,eta1.Purification of nuclear DNA from single hair shafts for DNA analysis in forensic sciences[J].Legal Medicine(Tokyo,Japan),1999,1(2):61-67.
国家质检总局科技计划项目,(计划编号2013 IK 112)
王玫(1968-),女,研究员,主要从事轻纺产品检验技术研究。
任亮(1978-),男,工程师,主要从事轻纺产品检验工作。
