清开灵注射液质量标准与控制变化情况分析
2015-10-26李珂李书平徐晓淑
李珂,李书平,徐晓淑
(郑州工业应用技术学院,河南郑州451150)
清开灵注射液质量标准与控制变化情况分析
李珂,李书平,徐晓淑
(郑州工业应用技术学院,河南郑州451150)
目的分析清开灵注射液的质量标准管理现状,总结存在的问题并提出建议,为完善清开灵注射液质量标准提出合理化建议。方法采用比较研究法,以《中国药典》和近年的研究文献为依据,分析清开灵注射液质量标准与控制要点变化情况。结果清开灵注射液在鉴别项、检查项、含量测定项等方面出现了较明显的变化,2010年版《中国药典》中新增了指纹图谱。结论清开灵注射液质量标准在不断提高和完善,有利于清开灵注射液的现代化生产和质量控制。
清开灵注射液;质量标准;质量控制
1 产品特点与质量控制要点
1.1产品特点
成分较复杂:清开灵注射液由8味中药组方,具有清热解毒、化痰通络、醒神开窍等功效[3-5],详见表1。其临床主要用于治疗热病神昏、中风偏瘫、急慢性肝炎、上呼吸道感染、肺炎、脑梗死等[6]。组方中8味中药的不明成分较难检测且所占比例较大。
生产工艺复杂:清开灵注射液生产工艺复杂,其中胆酸和猪去氧胆酸2种有效成分以纯度较高的单体形式直接入药;黄芩以含量为90%以上的黄芩苷(复方中含量最高的成分)入药;珍珠母经过酸水解与水牛角碱水解后中和,以水解液的形式进入复方;经水提醇沉后的板蓝根、金银花和栀子以提取液形式入药[3-5]。清开灵注射液生产过程包括水解、中和等,也包括了中药注射剂生产过程中提取、精制、配液、灭菌、澄明度检查等环节。其中提取工艺为水提醇沉和直接醇提,醇提法易造成杂质残留和有效成分流失,且需大量消耗乙醇。提取液中的杂质如色素、淀粉、蛋白质及鞣质、黏液质较难分离,普通过滤介质不能完全截留,常导致出膏率高。分离工序主要采用重力沉降和筛网过滤,干燥工序主要采用浓缩干燥法,应用常压热风烘干[7]。
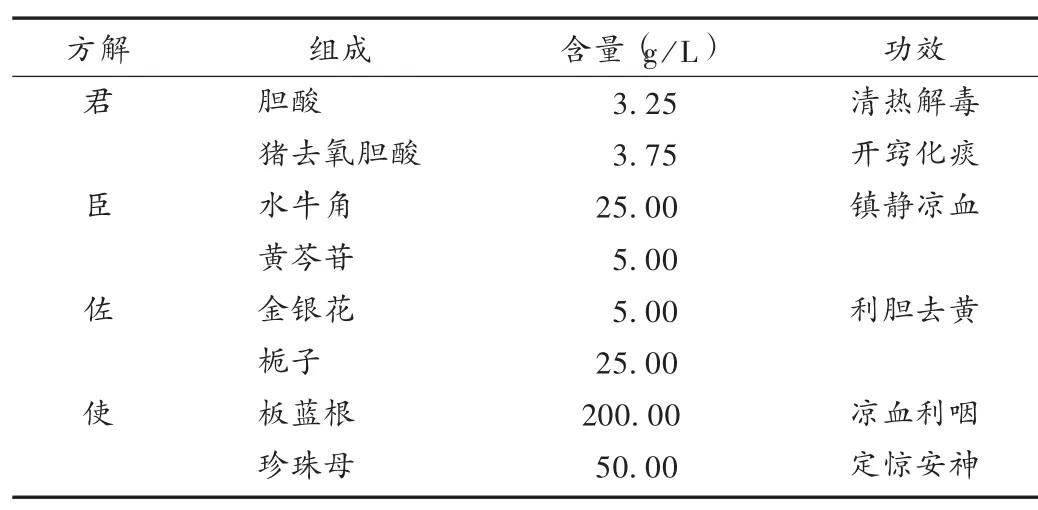
表1 清开灵注射液的组方
不良反应较多:清开灵注射液的不良反应具有突然性、偶发性和不确定性等特点[8],以各种过敏反应为主且主要发生在皮肤系统,多表现为皮疹、瘙痒、斑丘疹、荨麻疹等过敏反应[9]。其次是药物热、胃肠道不良反应、注射部位红肿等多种类型,重型多见于过敏性休克、严重呼吸系统、心血管系统、神经肌肉系统不良反应等。
1.2质量控制要点
主要成分鉴别:清开灵注射液的质量标准主要对栀子苷、黄芩苷、胆酸和猪去氧胆酸进行鉴别[3-5],以辨别真伪。
检查:清开灵注射液的检查项包括pH、重金属、热原、异常毒性、炽灼残渣检查等注射剂常规检查,以及山银花、有关物质、蛋白质、树脂检查和溶液颜色检查等专项检查[3-5]。其中,pH大小关系到有效成分含量的高低;重金属关系到清开灵注射液的稳定性、安全性;热原检查是针对清开灵注射液微生物污染而进行的,避免细菌引起热原反应;异常毒性检查是为控制注射剂生产期间带入的杂质;草酸盐检查主要是为了检查毒性,排除引发不良反应的因素;针对具有动力学与热力学的不稳定性蛋白质和树脂检查,目的是避免清开灵注射液混浊或产生沉淀;检查山银花是为了确认处方中所需的金银花,以免二者混用;检查溶液的颜色是为了检测其中的不溶物,进而把握药物的纯度;对有关物质检查可了解清开灵注射液生产工艺状况,发现不良反应发生原因;异常毒性是检查清开灵注射液生产过程中引入的异物或其他原因所引起的毒性反应;炽灼残渣检查是控制混入的各种无机杂质;过敏反应的检查和溶血与凝聚的检查是控制药品中影响到用药安全并对生物体产生特殊生理作用的一些杂质。
老年人一旦发生排尿性晕厥,家人应即刻采取一些急救措施:首先把患者抬到床上,去枕平卧,头部放低,并保持周围环境的安静,抬高下肢15分钟。然后立即用手指压迫病人的人中、内关、足三里等穴位,这对升压有一定的效果。解开衣领及腰带,如有恶心、呕吐,则宜将头偏向一侧,以免呕吐物吸入气管而引起窒息。当意识恢复后可慢慢扶其坐下,继而慢慢站起,要避免站立过快而再次晕厥。
含量测定:主要药效成分含量的高低是反映清开灵注射液药效强弱的指标;对有效成分进行定量分析,主要是为控制清开灵注射液的有效性。清开灵注射液的质量标准主要对珍珠和水牛角水解液中氨基酸的含氮量进行测定,以及对栀子、胆酸、猪去氧胆酸、黄芩苷等主要药物和目标成分进行含量测定[3-5]。
2 质量标准变化情况
2.1发展
清开灵注射液是由安宫牛黄方拆方研制而成(1974年),收载于《中药制剂汇编》,后收载于部颁标准中药成方制剂第十六册,至2005版药典收载,后相继收载于2010版药典增补本、2010版药典及2015年颁布的新版药典。
2.2主要变化点
清开灵注射液的质量标准变化主要体现在鉴别、检查和含量测定3个方面。其中2010版药典首次增加了指纹图谱检测。
2.3主要项目指标变化
其质量标准的总体变化较明显,其中鉴别、检查和含量测定项均有不同程度的增加和改变,以检查项变化最明显,由部颁标准的4项增至2010版药典的14项。
鉴别项:部颁标准中鉴别项2项[3],2005版药典增加1项,共3项[4],2010版药典鉴别项质量标准沿用2005版药典鉴别标准[5]。
含量测定项:部颁标准含量测定共2项[3],2005版药典在部颁标准含量测定项的基础上增加2项,共4项[4],2010版药典沿用2005版药典含量测定标准[5]。
检查项:部颁标准检查项共4项[3],2005版药典检查项在部颁标准检查项基础上新增加2项,共6项[4];2010版药典检查项在2005版药典的基础上增加8项,共14项,同时还增加了指纹图谱检测项[5]。见表2。
2.4变化内容
鉴别项:部颁标准中鉴别项下共有2项,为栀子苷和黄芩苷[3];2005版药典在部颁标准基础上新增了1项,对胆酸、猪去氧胆酸的鉴别[4];2010版药典同2005版药典[5]。

表2 清开灵注射液质量标准主要项目指标变化(项)
检查项:相较于清开灵注射液其他质量标准项目,检查项变化最明显。部颁标准中检查项有4项,pH、重金属、异常毒性和热原检查,均为注射剂常规检查项目[3];2005版药典增为6项,增加了草酸盐和有关物质的专项检查[4];2010版药典共14项,在2005版药典基础上增加了8项,包括对山银花、溶液的颜色、炽灼残渣、总固体、蛋白质、树脂、过敏反应、溶血与凝聚的检查[5]。此外,2005版药典、2010版药典对重金属的控制更严格,其限量较部颁标准更为降低[4-5]。见表3。

表3 清开灵注射液质量标准检查项的变化
含量测定项:部颁标准中含量测定2项,即含氮量和黄芩苷的含量测定[3];2005版药典中含量测定新增2项,即对胆酸、猪去氧胆酸和栀子的含量测定,测定项增至4项[4];2010版药典中含量测定项与方法沿用2005版药典含量测定项和方法[5]。2005版药典将黄芩苷的含量测定方法由部颁标准采用的分光光度法改为高效液相色谱(HPLC)法[4]。2010版药典沿用了2005版药典中HPLC法测定黄芩苷的含量[5]。
2.5指纹图谱
2010版药典新增指纹图谱[5]。指纹图谱是中药自身的“化学条码”,已成为国际公认的控制质量最有效的手段,目前,我国已规定中药注射剂必须使用指纹图谱进行检测。指纹图谱能全面地反映清开灵注射液中所含化学成分的种类与数量,进而作出总体判断和评价,提升清开灵注射液质量标准的关键指标。色谱法是目前研究中药化学指纹图谱的常用方法,清开灵注射液收录药典的时间并不长,但近年来的质量标准和控制要点的研究却很深入。
3 建议
中药注射剂的质量问题主要表现为所含杂质多、澄明度和稳定性不理想等[10]。对清开灵质量标准及控制要点进行研究,应明确药效成分,完善质量标准。研究清开灵注射液质量标准及其控制要点变化情况,才能对质量标准不断进行改进,真正达到合理、准确地控制质量,确保药品质量和人民群众的利益,有利于促进医药产业健康发展,提升我国药品监管水平,有助于打入国际医药主流市场,促进国际技术交流和推动进出口贸易的繁荣。
增加其他有效成分含量测定:2010版药典仅对含氮量、栀子、黄芩苷、胆酸和猪去氧胆酸进行了含量测定,还无法确保清开灵注射液的质量安全,应增加其他有效成分的含量测定,如增加主要糖类、酚酸类成分,板蓝根中的鸟苷、尿苷、腺苷和蛋白、多肽类成分,成品和水解液中的钙、绿原酸类化合物、鞣质、铅和镉。
运用新的质量控制技术和方法:目前的质量控制方法难以确保清开灵注射液的质量安全,限制了其发展。许多新技术如中药指纹图谱技术为质量标准的提高提供了新的技术平台,蒸发光散射检测器可用于对清开灵注射液中单糖及双糖类成分进行检测和含量测定,一标多测法进行含量测定准确全面,可采用这种方法测定蛋白质相对分子量,液相色谱-质谱联用(LC/MS)、气相色谱-质谱联用(GC/MS)联用的方法更高效,红外光谱法可用于鞣质的检测。
识别与控制生产过程中的风险点:建议以中药提取物投料以保证质量稳定均一,并明确药液浓缩的客观评价指标,设置醇沉工艺参数,增加钡残留的检测。
[1]刘白杨.中药注射剂企业的创新战略[D].北京:首都经济贸易大学,2014.
[2]赵筱萍,康立源,唐仁茂,等.基于整合药理学的中药注射剂质量风险管控策略及关键技术[J].中国中药杂志,2014,39(24):4689-4 692.
[3]WS3-B-3098-98.卫生部药品标准·中药成方制剂第十六册[S].
[4]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:610-612.
[5]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:1 110-1 111.
[6]叶圣春,陆彩虹.清开灵注射液致过敏性休克58例文献分析[J].中国药业,2008,17(11):50-51.
[7]王志国,王丹巧,魏峰.清开灵注射液不良反应分析[J].中国中医基础医学杂志,2010,16(1):82-84.
[8]李彩霞,王英姿,周海燕.生产工艺对清开灵注射液不良反应的影响[J].临床药物治疗杂志,2013,5(5):46-48.
[9]郝园,孔翔瑜,吴泰相.277篇1 486例清开灵注射液不良反应/不良事件系统评价[J].中国循证医学杂志,2010,10(2):162-175.
[10]张丽芝,翟光喜.中药注射剂的研究与应用[J].中国药业,2007,16(24):62-63.
R954;R286.0
A
1006-4931(2015)24-0011-03
李珂(1983-),女,河南南阳人,硕士研究生,讲师,研究方向为药物分析,(电子信箱)3238509157@qq.com。
2015-05-28;
2015-07-30)
