钝顶螺旋藻FtsZ蛋白结构分析及同源建模
2015-10-22沈清清田雪琪常征
沈清清,田雪琪,常征
(文山学院 环境与资源学院,云南 文山 663099)
钝顶螺旋藻FtsZ蛋白结构分析及同源建模
沈清清,田雪琪,常征
(文山学院 环境与资源学院,云南 文山 663099)
采用生物信息学的研究方法,应用一系列工具软件分析研究钝顶螺旋藻FtsZ蛋白,以认识钝顶螺旋藻FtsZ蛋白一级和二级结构,并为进一步研究该蛋白空间结构和功能机制奠定理论基础。获得钝顶螺旋藻FtsZ蛋白一级结构相关理化参数的详细数据,预测蛋白二级结构,对蛋白的3D结构进行了同源建模、质量评价分析。研究结果表明钝顶螺旋藻FtsZ蛋白是一种酸性蛋白,主要定位于细胞核区;蛋白二级结构主要由无规则卷曲和α-螺旋两种结构组成;同源建模后得到的3D模型在空间构象上有较高的合理性,其中模型A有100%氨基酸残基数落于Ramachandran图的允许区,该模型含有14个α-螺旋结构,5个βα-β单位,2个β-折叠结构,1个β-发夹结构,16个β-转角和1个γ-转角。
蛋白;原核生物;同源建模
钝顶螺旋藻(Αrthrospira platensis)是一种光合自养型蓝藻,富含维生素、蛋白质和多糖等生物活性物质,具有较高的经济价值。钝顶螺旋藻是由许多柱状单细胞构成的藻丝体,具有规则的螺旋状或波浪卷曲状的形态特征,但当环境条件或环境因子变化时,藻丝体的弯曲度、螺旋度和长度均有可能发生改变,甚至变成不可逆的直线形态,另外,有研究也证实钝顶螺旋藻的藻丝体能自发的发生形态变异[1-2]。许多科研人员对螺旋藻形态转变的机制进行了大量的假设和研究,但目前仍然没有获得肯定的答案。随着FtsZ、MreB 和 Cres等原核生物细胞骨架蛋白的发现[3-4],许多科研人员逐渐把目光转向了研究原核生物细胞骨架蛋白与螺旋藻藻丝体形态建成是否存在相关性,以期从这一角度挖掘出螺旋藻形态变异确切的答案。早在1980年,Lutkenhaus JF等[5]就已经发现细胞骨架蛋白FtsZ是调控原核生物细胞分裂的主要物质,与真核细胞微管蛋白具有许多类似的结构与功能。之后Mingorance J[6]和Owawa M[7]发现FtsZ能与GTP 结合装配成FtsZ 原丝,这种FtsZ 原丝是中空的,能定位于细胞分裂的位点,在细胞分裂时装配形成一个称为Z环的环状结构,细胞隔膜和新生壁的形成依赖于这一环状结构。目前在C.crescentus和E.coli两种原核生物中除了发现FtsZ环的存在与分裂位点新细胞壁的合成密切相关外,还与细胞两极附近侧壁合成有关,表明FtsZ在细胞壁的形态建成上起着非常重要的作用[8]。
2012年,邹路阳等[1]研究了不同形态钝顶螺旋藻藻丝体蛋白表达的情况,发现直线形和螺旋形藻丝体中原核骨架蛋白FtsZ的表达量相差较大,说明钝顶螺旋藻的形态建成与FtsZ密切相关。这一发现对研究钝顶螺旋藻形态变异的机制有着很大的促进作用,但目前有关钝顶螺旋藻中FtsZ蛋白详细的化学信息还未见报道,其晶体结构也尚未解析,生物大分子蛋白质的三级结构决定蛋白质的生物学功能[9],因此本研究旨在通过利用生物信息学的方法分析FtsZ蛋白的一、二级结构的理化性质,对其三级结构进行同源建模,为进一步研究FtsZ空间结构和功能机制奠定理论基础。
1 序列来源
供项目研究的分析序列来源于美国生物信息中心(NCBI)的 Protein数据库,序列信息:FtsZ (Αrthrospira platensis NIES-39),序列登录号:BAI93200.1。
2 方法
2.1FtsZ蛋白的一、二级结构分析
2.1.1一级结构分析
将钝顶螺旋藻FtsZ蛋白的氨基酸序列提交至瑞士ExPASy网站信息系统,利用该网站的工具ProtParam计算蛋白各方面的化学与物理参数值;利用亚细胞定位预测工具PSORT Prediction计算蛋白理论上的定位位点[10-11]。
2.1.2二级结构分析
将钝顶螺旋藻FtsZ蛋白序列发送至法国里昂生物化学与蛋白研究所(IBCP)提供的服务器NPS@,用在线工具 SOPMA预测蛋白的二级结构,分析蛋白的局部结构元件[11]。
2.2蛋白的同源建模及评估
在瑞士生物信息学研究所网页上运行在线工具SWISS-MODEL,利用同源建模法对提交的钝顶螺旋藻FtsZ蛋白氨基酸序列进行计算,从PDB蛋白库中选择具显著同源性的模板序列,构建出理想匹配值的3D模型,输出相关建模参数;利用PROCHECK结构分析与验证服务器对3D模型空间结构的可信度与合理性进行评估[10-11],输出Ramachandran图。
3 结果与分析
3.1FtsZ蛋白氨基酸组成及理化性质分析
钝顶螺旋藻FtsZ蛋白分子式C1941H3157N565O625S5,由426个氨基酸组成,分子量是44.57 kD,含20种常见氨基酸,其含量见表1,其中丙氨酸(Ala)含量最高,为11.0%,其次是甘氨酸(Gly),含量为10.8%。酸性氨基酸残基总数较碱性氨基酸总数多10,因此该蛋白属酸性蛋白。脂肪族氨基酸指数为92.09,理论等电点PI为4.94,原子总数是6293,其疏水性平均值(GRAVY)为-0.171,N末端氨基酸为蛋氨酸(Met),蛋白的半衰期估算值为30 h。PSORT Prediction预测工具对FtsZ蛋白的亚细胞定位位点进行了预测,计算出的结果表明细胞核区是FtsZ蛋白的主要定位区域,其概率比较大,值为60%。
3.2FtsZ蛋白二级结构预测与分析
利用在线工具SOPMA预测分析钝顶螺旋藻FtsZ蛋白的二级结构,结果如图1所示,FtsZ蛋白二级结构中含39.91%的无规则卷曲(Random coil)结构,由170个氨基酸组成,33.80%的α-螺旋(Alpha helix)结构,由144个氨基酸组成,17.84%的扩展长链(Extended strand)结构,由76个氨基酸组成,8.45%的β-转角结构,由36个氨基酸组成。以上数据表明无规则卷曲和α-螺旋是钝顶螺旋藻FtsZ蛋白的主要成分。

表1 氨基酸组成及含量
3.3FtsZ蛋白的三级结构分析及同源建模
运行在线工具SWISS-MODEL,从PDB蛋白库中筛选出具有显著同源性的3个模板序列,PDB id分别为2vam.1、4dxd.1和4m8i.1,FtsZ蛋白的氨基酸序列与这3个模板的序列同源性分别为61.08%、59.31%和59.31%,同源建模后获得的3D模型如图2所示,对这3个3D模型结构的合理性与质量进行PROCHECK评估,输出Ramachandran图(见图3),图3中显示模型A有100%的氨基酸残基落在允许区,其中96.1%落在最适区,3.9%落在附加区;模型B有98.8%的氨基酸残基落在允许区,其中92.6%落在最适区,6.2%落在附加区,剩余1.2%落在非允许区;模型C有99.6%的氨基酸残基落在允许区,其中92.3%落在最适区,7.3%落在附加区,0.4%落在非允许区。以上结果表明通过SWISSMODEL构建的3个模型在空间结构上符合立体化学规则,合理性较高,各氨基酸残基的落点满足二面角的分布要求,其中模型A最能反映出FtsZ蛋白真实的空间构象,该模型含有14个α-螺旋结构,5个βα-β单位,2个β-折叠结构,1个β-发夹结构,16个β-转角和1个γ-转角。
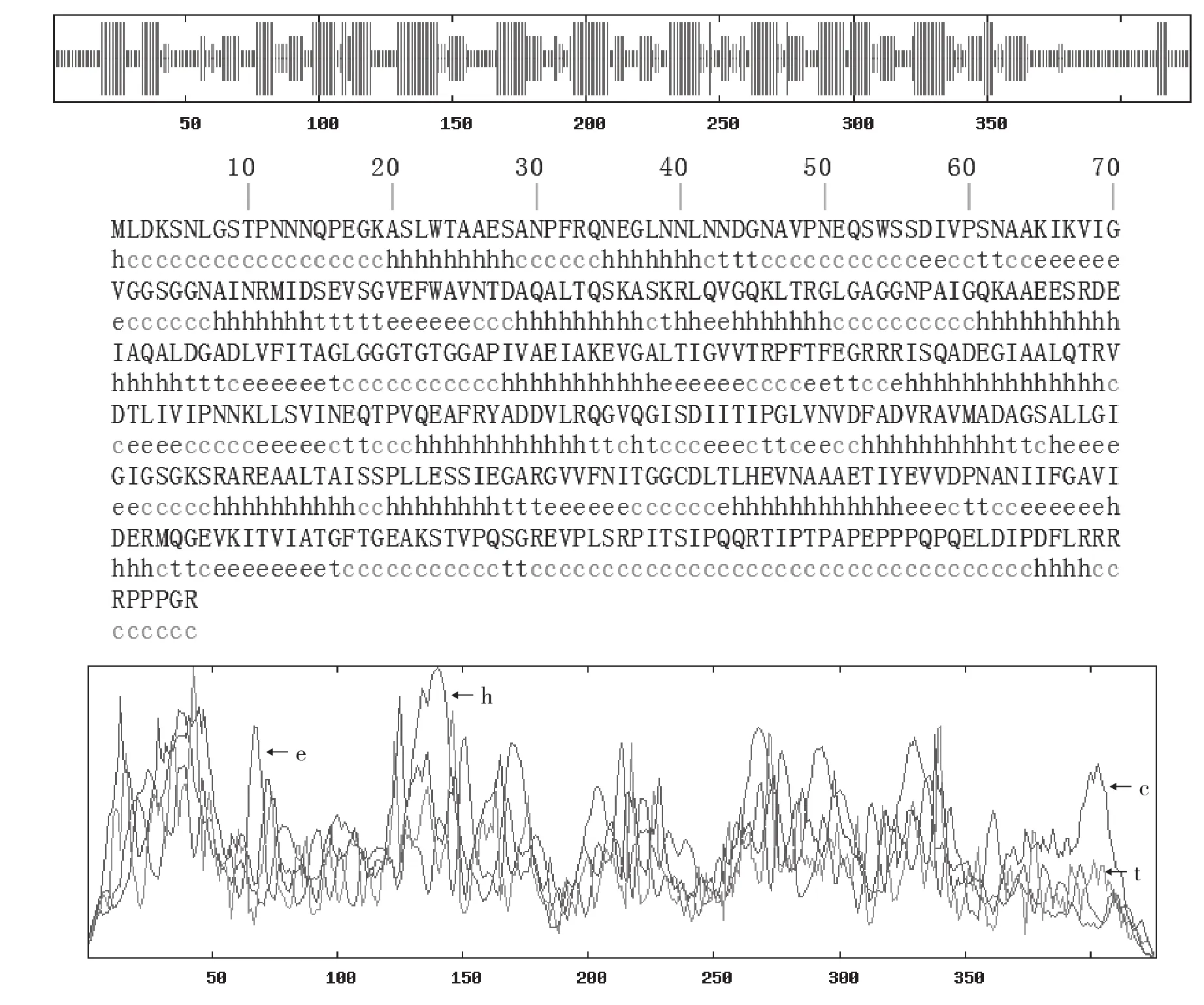
图1 FtsZ二级结构分析
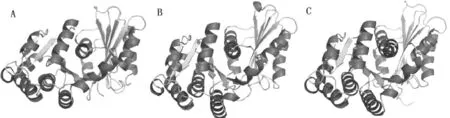
图2 蛋白同源建模后的模型
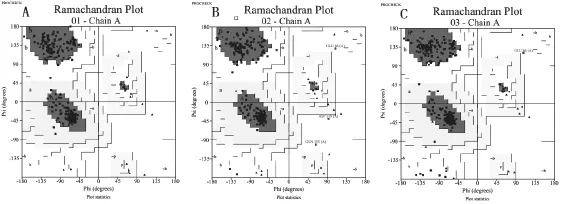
图3 蛋白氨基酸残基二面角分布图(Ramachandran图)
4 结论
1)钝顶螺旋藻FtsZ蛋白由426个氨基酸组成,含20种氨基酸,其中丙氨酸(Ala)含量最高为11.0%,为酸性蛋白。PSORT的分析表明FtsZ蛋白主要定位于钝顶螺旋藻的细胞核区,其概率值较高为60%。
2)钝顶螺旋藻FtsZ蛋白二级结构预测结果表明无规则卷曲和α-螺旋是其主要结构,其比例分别为39.91%和33.80%。
3)SWISS-MODEL系统为建模选择的3个模板与钝顶螺旋藻FtsZ蛋白序列同源性均较高,均在59%以上,因此构建出的3D模型PROCHECK评价结果均属高质量模型,其中模型A 有100%的氨基酸残基落在允许区,具有较高利用价值。
[1] 邹路阳,吴娟,曾群安,等. FtsZ在钝顶螺旋藻形态建成中的作用[J]. 水生生物学报, 2012(5):898-904.
[2] 林重阳.钝顶螺旋藻两种藻丝体的差异膜蛋白分析及肌动蛋白类似物的初步研究[D]. 厦门:厦门大学, 2009.
[3] 张斌,东秀珠. FtsZ蛋白同源性分析在乳酸菌系统学研究中的应用[J]. 微生物学报, 2005(5):661-664.
[4] 陈晓燕,汪志平,杨灵勇. 原核细胞骨架蛋白的结构与功能[J]. 细胞生物学杂志, 2006(5):699-703.
[5] Lutkenhaus JF,Wolf-Watz H,Donachie WD. Organization of genes in the ftsA-envA region of the Escherichia coli genetic map and identification of a new fts locus (ftsZ)[J]. J Bacteriol, 1980(2):615-620.
[6] Mingorance J,Tamames J,Vicente M. Geonmic channelingin bacterial cell division [J]. Journal Molecular Recogintion, 2004(5): 481-487.
[7] Owawa M,Anderson DE,Erichson HP. Reconstitution of contractile FtsZ rings in liposomes [J]. Science,2008(5877): 792-794.
[8] Cabeen MT,Jacobs-Wagner C. Skin and bones: the bacterial cytoskeleton,cell wall,and cell morphogenesis[J]. The Journal of Cell Biology,2007(3):381-387.
[9] Reisler E,Egelman EH. Actin Structure and Function:What We Still Do Not Understand[J]. Journal of Biological Chemistry,2007(50):36133-36137.
[10] 沈清清,刘芳,陈红惠. 维氏气单胞菌MreB蛋白的结构分析及其系统发育学意义[J]. 微生物学通报, 2015(2):272-279.
[11] 沈清清,刘芳,赵芳,等. MreB蛋白与actin蛋白的同源建模和进化关系研究[J]. 文山学院学报,2015(3):31-37.
Structural Analysis and Homology Modeling of FtsZ Protein in Arthrospira Platensis
SHEN Qingqing, TIAN Xueqi, CHANG Zheng
(School of Environment and Resources, Wenshan University, Wenshan Yunnan 663099, China)
To understand the fi rst and secondary structures of Arthrospira Platensis FtsZ protein, and establish the foundation for further investigating its three-dimensional structure and function mechanism, the paper adopts biological information approaches and series of soft wares to study it. Online soft wares are used to analyze the primary structure and physicochemical properties of the protein, and its secondary structure is predicted. A threedimensional structure is established and a quality evaluation has been done. The research results show that FtsZ protein of Arthrospira Platensis is an acidic protein composed of 426 amino acids, which is mainly located in the cell nucleus. Secondary structure of the protein mainly consists of random coil and α-helices structures. The model built by homology modeling presents a reasonable spatial structure. Besides, Model A is high-quality model with 100% residual base of amino acid set in the allowed regions. The results of homology modeling reveal that the tertiary structure of the protein contains 14 α-helical structures, 5 beta-alpha-beta units structures, 2 β-folded structures, 1 beta bulge structures, 16 β-turns and 1 γ-turns.
Protein; prokaryote; homology modeling
TQ936.2
A
1674 - 9200(2015)06 - 0035 - 04
(责任编辑 张铁)
2015 - 09 - 14
文山学院科研基金项目“真核与原核生物细胞骨架蛋白的同源建模比对分析及系统进化关系研究”(11WSY01)。
沈清清,文山学院环境与资源学院副教授,硕士。
