机械损伤对小鼠切牙成釉器细胞Notch表达的影响
2015-10-22尹秋蓉王胜朝
尹秋蓉,童 娟,罗 颖,王胜朝,胡 轶
(陕西西安710032:1.第四军医大学口腔医院预防科军事口腔医学国家重点实验室;2.第四军医大学病理学与病理生理学教研室)
机械损伤对小鼠切牙成釉器细胞Notch表达的影响
尹秋蓉1,童 娟1,罗 颖2,王胜朝1,胡 轶1
(陕西西安710032:1.第四军医大学口腔医院预防科军事口腔医学国家重点实验室;2.第四军医大学病理学与病理生理学教研室)
目的:研究机械损伤后小鼠切牙成釉器细胞中Notch信号的表达及变化。方法:通过磨除小鼠下颌切牙牙冠的1/2部分建立小鼠下颌切牙的机械损伤模型,并将其随机分为损伤后3、5、7d组,同时以不做切牙磨除处理的小鼠作为正常对照;用免疫组织化学染色方法观察各组成釉器细胞中Notch1、Notch2的表达变化情况。结果:对照组中,Notch1、Notch2仅在中间层和星网状层细胞中微弱表达;损伤后3d组,Notch1、Notch2在成釉细胞和中间层细胞均呈密集的阳性表达,在星网状层细胞有散在阳性表达;损伤后5d组,Notch1、Notch2在成釉细胞、中间层、星网状层细胞仍呈明显的阳性表达;损伤后7d组,Notch1、Notch2在各层细胞中的表达均较损伤后3、5d组有所减弱。结论:机械损伤可激活小鼠切牙成釉器细胞中Notch信号的表达,从而参与调控切牙的损伤修复。
Notch信号;成釉器细胞;切牙;机械损伤
[Chinese Journal of Conservativedentistry,2015,25(4):193]
小鼠切牙具有一生不断生长的特性,这种再生功能的维持依赖于其颈环干细胞的存在。进化保守的Notch信号具有维持干细胞生存和调控其增殖、分化的作用。研究发现,小鼠切牙颈环有Notch受体的表达[1];当小鼠切牙颈环的Notch信号被抑制后,颈环的生长也受到明显抑制,星网状层细胞凋亡明显增加,从而导致星网状细胞数量明显减少,提示Notch信号是小鼠切牙颈环上皮干细胞生存所必需的[2]。此外,在成釉细胞终末分化区,同样有Notch受体(Notch1、Notch2、Notch3)及其配体Serrate1的表达[1],提示Notch信号可能对成釉器不断形成牙釉质以维持小鼠切牙不断萌出的功能特性具有十分重要的作用。但是,Notch信号在小鼠切牙的损伤修复中是否也起作用,目前尚无相关研究资料证明。本实验通过建立小鼠切牙机械损伤模型,用免疫组化染色观察损伤修复中小鼠切牙成釉器细胞Notch信号的表达变化,并讨论其意义。
1 材料和方法
1.1主要材料和仪器
昆明小鼠(第四军医大学实验动物中心);Notch1、Notch2兔抗鼠多克隆抗体(071232、071233,Merck Millipore,德国);SP、DAB试剂盒(北京中杉金桥);普通光学显微镜(Olympus,日本)。
1.2方法
1.2.1小鼠切牙损伤模型的制备
取健康成年雌性昆明小鼠20只(体质量25~30 g),经10 g/L戊巴比妥钠腹腔注射麻醉并仰卧固定后,利用随机数字表将其随机分为1个对照组和3个实验组(n=5)。其中3个实验组用牙科高速手机和金刚砂车针磨除各小鼠下颌切牙的冠部1/2牙体组织后,分别置于常规环境下饲养3、5、7d;对照组各小鼠切牙不做任何处理,置于实验组相同环境下饲养。
1.2.2取材和组织切片制备
上述建模结束后,用40 g/L多聚甲醛液心内灌注处死各组小鼠,立即分离其下颌骨并于切牙区取材。分别将各标本浸泡于新鲜配制的40 g/L多聚甲醛液内,4℃下固定48 h后,100 g/L EDTA 4℃下脱钙4周;梯度乙醇脱水、二甲苯透明、石蜡包埋后,沿标本近远中向作4 μm厚的连续切片。
1.2.3免疫组化染色检测Notch1、Notch2的表达情况
各组石蜡切片经二甲苯、梯度乙醇脱蜡至水后,用30 mL/L过氧化氢室温下作用10 min以消除内源性过氧化物酶;PBS清洗5 min×3次,山羊血清封闭30 min;倾去血清,不洗,分别滴加Notch1、Notch2兔抗鼠多克隆抗体(以PBS代替一抗作为阴性对照),置于湿盒中4℃过夜。次日37℃复温1 h,PBS清洗5 min×3次,滴加生物素化的二抗工作液,37℃孵育40 min;PBS清洗5 min×3次,滴加辣根酶标记的链霉卵白素工作液,室温孵育15 min;PBS清洗5 min×3次,用DAB显色试剂盒显色(显微镜下控制显色程度);PBS终止显色后,ddH2O反复冲洗,苏木精轻度衬染5 s;温水冲洗返蓝、盐酸分化1~2 s、10 g/L氨水还原3 s后,梯度乙醇脱水、二甲苯透明、中性树胶封片,显微镜下观察并拍照。Notch1、Notch2染色阳性结果以细胞质中出现棕黄色颗粒为准,并以颜色深浅为判定标准:无黄色为阴性表达;浅黄色为弱阳性表达;棕黄色为阳性表达。
2 结果
2.1Notch1在各组成釉器细胞中的表达
对照组(图1a、e):Notch1在成釉细胞中不表达,仅在中间层细胞和星网状层细胞中呈微弱表达;损伤后3d组(图1b、f):Notch1在成釉细胞和中间层细胞中均呈明显的阳性表达,在星网状层细胞中亦有散在的阳性表达;损伤后5d组(图1c、g):Notch1在成釉细胞、中间层细胞、星网状层细胞中仍呈阳性表达;损伤后7d组(图1d、h):Notch1在成釉细胞、中间层细胞、星网状层细胞中的表达均较损伤后3、5d组有所减弱。
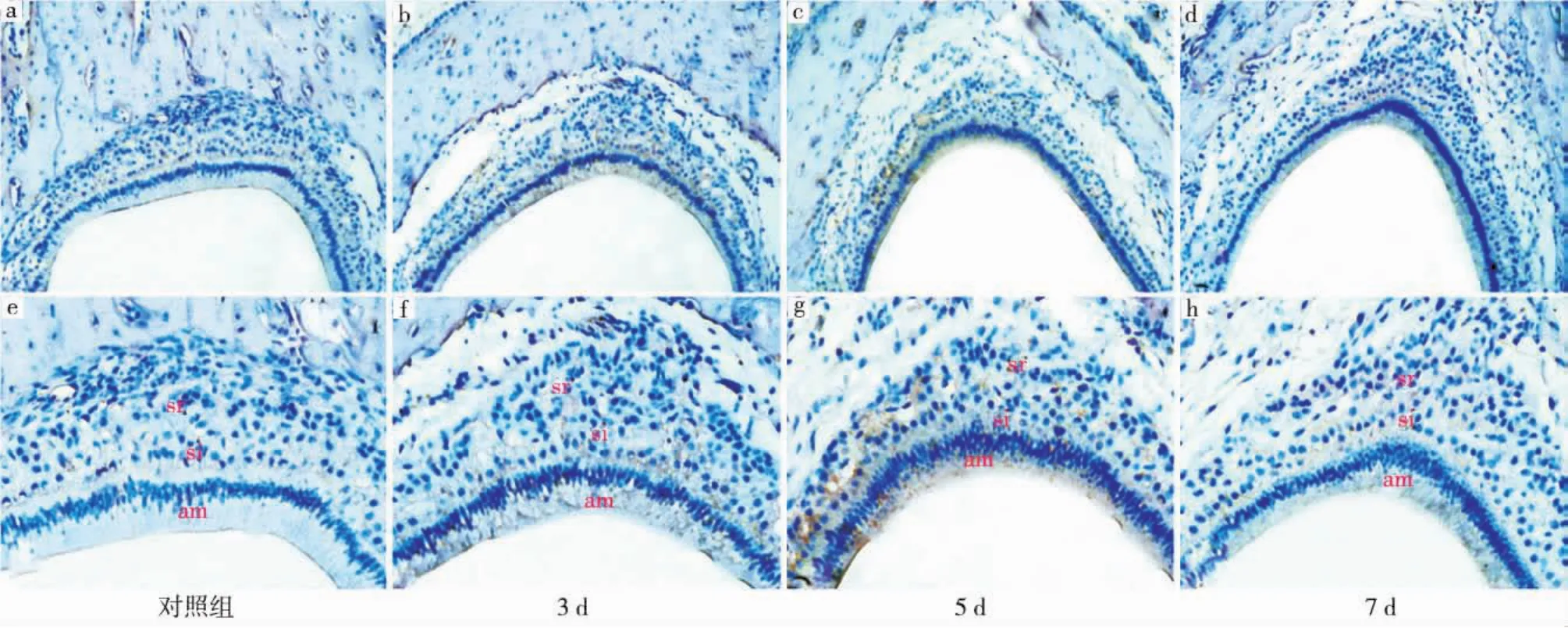
图1 Notch1在各组成釉器细胞中的表达情况
2.2Notch2在各组成釉器细胞中的表达
Notch2在各组中的表达呈现出与Notch1类似的动态变化。对照组(图2a、e):Notch2在成釉细胞中不表达,仅在中间层细胞和星网状层细胞中呈微弱表达;损伤后3d组(图2b、f):Notch2在成釉细胞、中间层细胞及与其邻近的星网状层细胞中均呈密集的阳性表达,在稍远处的星网状层细胞中呈散在阳性表达;损伤后5d组(图2c、g):Notch2在成釉细胞、中间层细胞和星网状层细胞中仍呈阳性表达;损伤后7d组(图2d、h):Notch2在各层细胞中的表达均较损伤后3、5d组有所减弱。
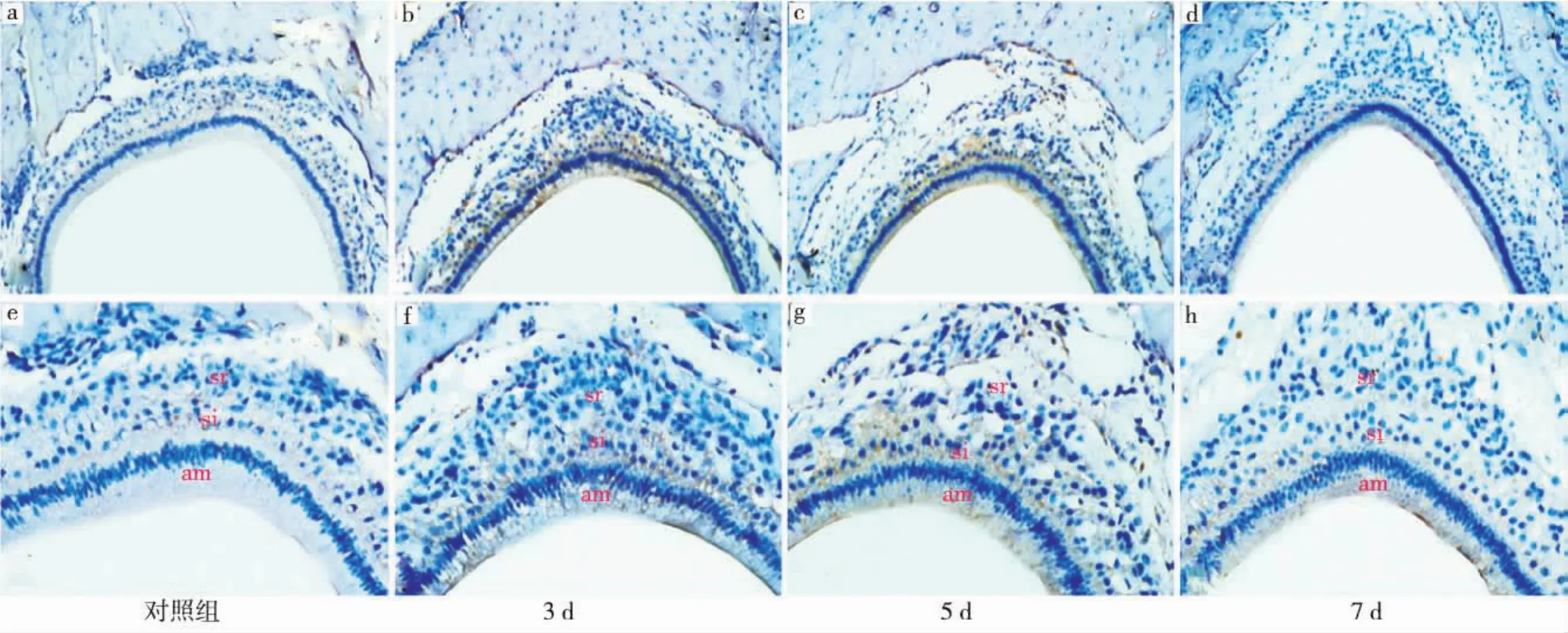
图2 Notch2在各组成釉器细胞中的表达情况
3 讨论
成熟组织的再生依赖于干细胞的存在。小鼠的切牙之所以能在其一生中不断地萌出,就是由于其牙根顶部存在具有增殖和分化潜能的间充质干细胞和上皮干细胞,其中上皮干细胞分别位于唇、舌侧颈环处,而间充质干细胞则位于二者之间。舌侧颈环较小,不能分化形成成釉细胞,因而不能形成牙釉质。唇侧颈环较大,由位于中央的星网状层细胞和中间层细胞以及周围的内、外釉上皮细胞组成[3];其中的上皮干细胞位于星网状细胞层并能不断地向内釉上皮层迁移并形成短暂增殖的细胞;后者可逐步向前成釉细胞、分泌前的成釉细胞转化,最后形成分泌期成釉细胞并沿着切牙唇面由根部向牙尖顶部移动;然后再通过分泌牙釉质基质并矿化形成牙釉质[4-5]。小鼠切牙上皮干细胞的生存、增殖和分化过程受上皮、间充质相互作用的调控,这当中牵涉许多促进和抑制信号间的微妙平衡。例如,FGF、BMP4、Activin和BCL11B信号均参与调控上皮干细胞的增殖和分化,并进而调控切牙的大小和唇舌侧的不对称度;而Sprouty、Follistatin则对以上信号通路具有反向抑制作用,也参与调节牙釉质的形成[3,6-9]。
有研究表明,Notch信号具有调控多种组织干细胞和祖细胞(如骨髓、肠上皮和各种神经组织等)的生存、增殖、分化作用[2]。牙齿发育过程涉及多种Notch受体和配体的表达,其中Notch1、Notch2表达于星网状层细胞[1,10];并认为Notch信号通路具有决定小鼠切牙颈环星网状层细胞命运的作用[2,11-12]。有研究发现,从颈环上皮干细胞增殖分化进入成釉细胞终末分化区域的星网状层细胞、中间层细胞和成釉细胞中也有Notch信号的表达[1]。为进一步研究Notch信号在成年小鼠唇侧成釉器中的表达及意义,本实验通过制备成年小鼠切牙机械损伤模型,并观察其切牙唇侧成釉器细胞中Notch信号的表达变化,进而探讨Notch信号在小鼠切牙损伤修复中的作用。
本实验选取唇侧处于分泌期的成釉器进行免疫组化染色发现,Notch受体Notch1、Notch2在正常小鼠切牙的成釉细胞中不表达,仅在中间层和星网状层细胞中呈微弱表达,与Harada等[1]的报道基本一致。Harada等发现,在成釉细胞终末分化区域,Notch1表达于中间层细胞,Notch2主要表达于星网状层细胞,Serrate1密集表达于终末分化的成釉细胞;提示,Notch信号具有维持成釉细胞终末分化状态的作用。本实验中还发现,在机械损伤后3d和5d时,Notch1、Notch2不仅在成釉细胞中呈阳性表达,两者在中间层和星网状层细胞中的表达也有所增强,其中以Notch2的表达增强更明显。在损伤后7d时,Notch1、Notch2的表达均逐渐减弱,表现为:在成釉细胞中呈弱阳性表达或不表达,在中间层和星网状层细胞中呈弱阳性表达。以上结果说明,机械损伤可引起小鼠切牙成釉器细胞中Notch信号的表达增强并呈现动态变化,表现为先上升(在损伤后3~5d表达较强),然后逐渐下降(在7d时趋向恢复到损伤前水平)的趋势;并且在终末分化的成釉细胞中也出现了Notch受体的表达。
小鼠切牙不同于磨牙和人类切牙,其牙釉质只在唇侧形成,而舌侧无牙釉质覆盖;这种结构的不对称性使得小鼠切牙极易被磨耗,从而在一生不断萌出的情况下依然能维持在一个固定的长度[6]。据文献报道,将小鼠下颌切牙牙冠截断之后,其生长速度会加快,并在1个月内恢复到原有长度[13]。本实验中也发现,损伤后小鼠切牙大概以每天0.5 mm的速度生长,并且在损伤后7d时,其暴露于口腔的牙冠长度基本达到未磨除前的长度。小鼠切牙的再生与唇侧釉质的不断新生密切相关,釉质的形成又依赖于颈环上皮干细胞的不断增殖分化从而形成成釉细胞。研究表明,成年干细胞的分裂增殖周期常相对较长且慢,它们在面对特异性的环境刺激信号时能够做出反应,或产生新的干细胞,或进入特异性的分化程序。当新生组织被损伤破坏时,干细胞呈现出活跃的分化状态,子代细胞进一步增殖分化出大量的干细胞以补充损失,进而加快组织的损伤修复[14-15]。由此看来,损伤导致切牙的生长速度加快,并在损伤后7d就能基本恢复到原有长度;说明损伤后切牙颈环的干细胞可能处于活跃的增殖分化状态,从而使新生成釉细胞的速度加快,数量增加,进而加速釉质的形成,促进损伤修复。同时,损伤导致成釉器中的成釉细胞、中间层和星网状层细胞中Notch信号的表达先上调后下降,并且在7d时趋向恢复到正常水平,而此时的切牙也基本恢复到正常长度,二者之间存在一定的同步性。预计,当牙齿的损伤修复完成时,Notch信号的表达也将恢复到正常水平。因此我们推测,在牙齿损伤修复的过程中,成釉器中Notch信号的表达上调可能参与成釉器细胞功能的调控,进而可能与加快成釉细胞分泌牙釉质基质,促进损伤修复有关,但需要进一步的研究。
综上所述,成年小鼠切牙成釉器中Notch信号的表达对于维持其不断生长的能力至关重要,而机械损伤后成釉器中Notch信号的激活和表达上调可能对于调控成釉器细胞的功能、进而促进釉质基质分泌,加快损伤修复具有重要作用。Notch信号表达随时间的动态变化从分子水平上体现了损伤修复的动态过程,Notch信号对小鼠切牙的损伤修复可能具有调节作用。
[1]Harada H,Kettunen P,Jung HS,et al.Localization of putative stem cells indental epithelium and their association with Notch and FGF signaling[J].J Cell Biol,1999,147(1):105-120.
[2]Felszeghy S,Suomalainen M,Thesleff I.Notch signalling is required for the survival of epithelial stem cells in the continuously growing mouse incisor[J].Differentiation,2010,80(4-5):241-248.
[3]Tummers M,Thesleff I.The importance of signal pathway modulation in all aspects of toothdevelopment[J].J Exp Zool B Moldev Evol,2009,312B(4):309-319.
[4]Ryan MC,Lee K,Miyashita Y,et al.Targeteddisruption of the LAMA3 gene in mice reveals abnormalities in survival and late stagedifferentiation of epithelial cells[J].J Cell Biol,1999,145(6):1309-1323.
[5]Tummers M,Thesleff I.Root or crown:adevelopmental choice orchestrated by thedifferential regulation of the epithelial stem cell niche in the tooth of two rodent species[J].Development,2003,130(6):1049-1057.[6]Klein OD,LyonsdB,Balooch G,et al.An FGF signaling loop sustains the generation ofdifferentiated progeny from stem cells in mouse incisors[J].Development,2008,135(2):377-385.
[7]Kyrylkova K,Kyryachenko S,Biehs B,et al.BCL11B regulates epithelial proliferation and asymmetricdevelopment of the mouse mandibular incisor[J].PLoS One,2012,7(5):e37670.
[8]Wang XP,Suomalainen M,Jorgez CJ,et al.Follistatin regulates enamel patterning in mouse incisors by asymmetrically inhibiting BMP signaling and ameloblastdifferentiation[J].Dev Cell,2004,7(5):719-730.
[9]Wang XP,Suomalainen M,Felszeghy S,et al.An integrated gene regulatory network controls stem cell proliferation in teeth[J].PLoS Biol,2007,5(6):e159.
[10]Cai X,Gong P,Huang Y,et al.Notch signalling pathway in toothdevelopment and adultdental cells[J].Cell Prolif,2011, 44(6):495-507.
[11]Harada H,Ichimori Y,Yokohama-Tamaki T,et al.Stratum intermedium lineagediverges from ameloblast lineage via Notch signaling[J].Biochem Biophys Res Commun,2006,340(2):611-616.
[12]Mitsiadis TA,Lardelli M,Lendahl U,et al.Expression of Notch 1,2 and 3 is regulated by epithelial-mesenchymal interactions and retinoic acid in thedeveloping mouse tooth and associated withdetermination of ameloblast cell fate[J].J Cell Biol,1995,130(2):407-418.
[13]Harada H,Mitsuyasu T,Toyono T,et al.Epithelial stem cells in teeth[J].Odontology,2002,90(1):1-6.
[14]Fuchs E,Segre JA.Stem cells:a new lease on life[J].Cell,2000,100(1):143-155.
[15]Jones PH,Harper S,Watt FM.Stem cell patterning and fate in human epidermis[J].Cell,1995,80(1):83-93.
Effect of mechanical injury on the expression of Notch signaling in enamel organ cells of mouse incisor
YIN Qiu-rong*,TONG Juan,LUO Ying,WANG Sheng-chao,HU Yi
(*State Key Laboratory of Military Stomatology,Department of Preventivedentistry School of Stomatology,The Fourth Military Medical University,Xi'an 710032,China)
AIM:To investigate the expression and role of Notch signaling in enamel organ of mouse incisor after mechanical injury.METHODS:The animal model of mechanical injury was established by grinding off 1/2 crown of mouse mandibular incisor.The animals were sacrificed at 3,5d and 7d respectively(n=5)after injury,the expression of Notch1 and Notch2 in cells of enamel organ was observed by immunohistochemical staining.Animals without crown grinding served as the controls(n=5).RESULTS:In control group,Notch1 and Notch2 were weakly expressed in stratum intermedium and stellate reticulum cells.3days after injury,an intense expression of Notch1 and Notch2 was observed in ameloblasts and stratum intermedium cells,the expression in stellate reticulum cells was sporadic.5days after injury,Notch1 and Notch2 were still strongly expressed in ameloblasts,stratum intermedium and stellate reticulum cells.7days after injury,the expression of Notch1 and Notch2decreased in all cell layers.CONCLUSION:Notch signaling in enamel organ cells can be activated by mechanical injury,suggesting that Notch signaling may be involved in the repair of incisor injury.
notch signaling;enamel organ cells;incisor;mechanical injury
[文献标识码]A [文章编号]1005-2593(2015)04-0193-05
10.15956/j.cnki.chin.j.conserv.dent.2015.04.002
2014-11-28
国家自然科学基金(81170947)
尹秋蓉(1983-),女,汉族,四川广安人。硕士生(导师:王胜朝)
王胜朝,E-mail:wangshengchao@fmmu.edu.cn
