两种方法比较3种根管封闭剂体外抗菌效果的研究
2015-10-22曹海炜张玉琳梅笑寒孙汉堂
仇 珺,曹海炜,田 宇,肖 燕,张玉琳,辛 越,梅笑寒,孙汉堂,余 擎
(1.第四军医大学口腔医院牙体牙髓病科军事口腔医学国家重点实验室,陕西西安710032;2.甘肃省灵台县皇甫谧中医院口腔科,甘肃灵台744400;3.解放军203医院口腔科,黑龙江齐齐哈尔161000)
两种方法比较3种根管封闭剂体外抗菌效果的研究
仇 珺1,曹海炜2,田 宇1,肖 燕1,张玉琳1,辛 越3,梅笑寒1,孙汉堂1,余 擎1
(1.第四军医大学口腔医院牙体牙髓病科军事口腔医学国家重点实验室,陕西西安710032;2.甘肃省灵台县皇甫谧中医院口腔科,甘肃灵台744400;3.解放军203医院口腔科,黑龙江齐齐哈尔161000)
目的:比较3种根管封闭剂的抗菌效果。方法:直接接触(DCT)实验:将封闭剂AH-plus(A)、GuttaFlow(B)、iRoot SP(C)分别放入离心管中,分别于20 min和1、7、14、21d取出,与粪肠球菌混合1 h后,进行细菌计数。感染根管模型(IRCM)实验:将成功建立感染根管内粪肠球菌模型的100个离体单根管人牙,随机分为A、B、C 3个实验组和1个阳性对照组(n=25)。根管预备充填后,将所有样本置于厌氧环境中分别培养20 min和1、7、14、21d,每组于各时间点分别随机取出5个样本,收集充填材料和牙本质粉末进行细菌培养计数,并分别检测3种封闭剂的pH值。结果:在DCT中,A、C组与对照组相比,除20 min和1d时能有效杀灭细菌(P<0.05)外,其他时间点均无统计学差异(P>0.05);A、C组比较P>0.05;B组在各时间点均抗菌效果差(P>0.05)。在IRCM实验中,A、C组抗菌效果的时间较DCT延长,与对照组相比C组除了在21d抗菌性较差外,在其他各时间点均有较强的抗菌性(P<0.05);A组在20 min和1、7d时均有较强的抗菌性(P<0.05);而B组在各时间点抗菌效果均较差(P>0.05)。C组在各时间点pH值最高(P<0.05),A、B组pH值比较,P>0.05。结论:pH的高低与封闭剂的抗菌性无直接对应关系。AH-plus和iRoot SP抗菌效果优于GuttaFlow。
抗菌效果;根管封闭剂;直接接触实验(DCT);感染根管模型(IRCM);粪肠球菌
[Chinese Journal of Conservativedentistry,2015,25(4):238]
根管治疗的目的在于彻底清除感染物质与坏死组织,促进组织的修复与再生[1]。然而目前根管预备和消毒方法不能完全清除根管内的微生物,加之根管解剖的变异和复杂性,感染根管的细菌常存在于牙本质小管、根管侧枝等较隐匿的区域,造成根管内的再感染,最终导致根管治疗失败。因此,对于永久充填在根管内的封闭剂来说,不仅需要有良好的封闭性来封闭根管的冠方和根方,更关键的是要具有抗菌活性来杀灭根管内的残余细菌,提高根管治疗的成功率[2]。
目前,研究根管封闭剂抗菌实验的方法主要有3种。琼脂扩散试验(agardiffusion test,ADT)是最为普通也是最为常见的方法之一[3-4],由于其结果通常易受到其他因素干扰(如抗菌成分在培养基中的溶解性和扩散能力),不能客观准确反映各封闭剂的抗菌效果,所以近些年有学者不推荐采用此方法[5]。Weiss等[6]第一次将直接接触实验(direct contact test,DCT)运用到根管封闭剂和倒充填材料的抗菌试验中,由于DCT的各步骤能够做到定量标准化,重复操作性强,可严格控制混杂因素,因此完善了ADT的诸多缺陷,同样适用于不溶解的材料,常常被用于检测封闭剂的抗菌效果。离体牙感染根管模型(infected root canal model,IRCM)第一次是由Haapasalo等[7]提出,并常用于检测根管封闭剂的抗菌效果[8-10]。由于该模型模拟了细菌在根管内的生存状态和封闭剂在根管内发挥抗菌作用的过程,因此利用其检测封闭剂的抗菌效果,更贴近临床治疗的方式。
根管封闭剂在根管治疗中对密闭根管系统、杀灭包埋残余细菌、充填不规则区域等方面具有重要作用。临床上常用的根管封闭剂主要有氧化锌丁香油类、氢氧化钙类和树脂类等封闭剂。随着材料技术的发展,流动性、生物活性类封闭剂受到关注。硅树脂类封闭剂GuttaFlow是封闭剂和高比例微小牙胶颗粒的特异性结合,具有较强的流动性和黏结性,且固化后可轻度膨胀,利于致密充填[11-12]。iRoot SP是一种新型的生物陶瓷材料,其性能与无机三氧化聚合体(MTA)相似,具有良好的生物活性、生物相容性、封闭能力和抗菌性[13-14]。因此本实验采用两种常用检测封闭剂抗菌性的方法,比较临床中常用封闭剂AH-plus(环氧树脂类)、Gutta-Flow(硅树脂类)和iRoot SP(生物陶瓷类)对于粪肠球菌的抗菌效果,为临床应用提供实验依据。
1 材料和方法
1.1主要材料和器材
AH-plus封闭剂(Dentsply International Inc,PA,美国);GuttaFlow封闭剂(Coltene/Whaleden,德国);iRoot SP封闭剂(Innovative BioCeramix Inc,Vancouver,加拿大);24孔板(北京欣源佳和生物有限公司);厌氧培养箱(Hypoxystation H85,Don Whitley Scientific Limited,英国);pH测试仪(SB70P,VWR,美国);粪肠球菌(ATCC 4083,美国);BHI培养基、BHI琼脂培养皿(青岛海博生物技术有限公司);麦氏比浊仪(PhoenixSpecNephelometer,Bectondickinson&Company,美国);M-two镍钛机用机械(VDW,德国);5 g/L、52.5 g/L次氯酸钠液(KishidaChemical Co,日本);170 g/L EDTA(上海生工生物工程有限公司);慢速切锯(BUEHLER,美国);GG钻(Brasseler,美国);扫描电镜(S-4800,Hitachi,日本);冷冻干燥机(ES-2030)、离子溅射仪(Ion Sputter E-1045)(Hitachi,日本)。
1.2菌悬液的制备
取标准粪肠球菌(ATCC4083)作为实验目的菌株,常规复苏后接种于BHI琼脂培养皿中,37℃厌氧培养24 h后挑取单克隆,用BHI液体培养基制成悬液,并用波长为625 nm的麦氏比浊仪调整其浓度到106CFU/mL用于DCT实验,108CFU/mL用于IRCM实验。
1.3DCT实验
将AH-plus、GuttaFlow、iRoot SP封闭剂分别按说明书混合后,取等质量的样本(10±0.5)mg放入无菌的1 mL eppendorf离心管的底部,并使3种封闭剂的高度大致相等(5±1.5)mm,另选无封闭剂填入的离心管作为实验的阴性对照组;将所有样本放入孵箱保存(37℃,相对湿度>95%),于20 min和1、7、14、21d时分别取出所有样本,在离心管中加入10 μL菌悬液(106CFU/mL),阴性对照组加入10 μL无菌蒸馏水。随后在37℃厌氧条件下培养1 h,在离心管中再加入240 mL BHI液体培养基,用移液器轻轻混合约1 min后,将菌悬液按体积比为1∶10的比例分别进行梯度稀释,每个梯度各取50 μL涂于BHI琼脂培养皿,并置于37℃厌氧条件下静置培养24 h后,分别观察每个培养皿上菌落形成情况并进行细菌计数。计数结果取平均值后,乘以相应的稀释倍数得出每毫升CFU,制作CFU/mL(Y轴)与时间(X轴)的对数关系图。
1.4IRCM实验
1.4.1离体牙处理
收集单直根管人离体恒牙120个,清洁表面,5 g/L次氯酸钠液浸泡过夜后,流水冷却下用慢速切锯(700 r/min)从釉牙骨质界截取牙根,并使其长度为(11±0.5)mm。用#15 K锉疏通根管,M-two机用镍钛机械采用逐步后退法预备至#40/0.4锥度,工作长度为牙根长度减1 mm。预备过程中每换1支锉,均使用5 g/L次氯酸钠液冲洗根管。最后分别用52.5 g/L次氯酸钠液和170 g/L EDTA液(pH=7.2)冲洗根管各2 min。将上述处理的所有样本全部置于去离子水中进行高压灭菌后,随机抽取5个样本进行玷污层检测后弃之不用,其中3个进行扫描电镜观察,2个置于5 mL BHI液体培养基中37℃厌氧条件下静置培养24 h;确认根管壁玷污层去除干净且无细菌生长后随机抽取10个样本作为阴性对照组。
1.4.2粪肠球菌根管内接种和培养
将上述处理的105个牙根模型样本分别浸泡在盛有1 mL已配置好的菌悬液的离心管中(每管1个),37℃厌氧条件下静置孵育4周,每2d换1次新鲜菌液,孵育结束后随机抽取5个样本进行扫描电镜观察,确认根管感染模型建立成功后弃之不用,其余100个感染模型用于以下实验。
1.4.3根管充填
100个牙根感染模型用纸捻吸干后,随机分为实验组(A组:AH-plus;B组:GuttaFlow;C组:iRoot SP)和阳性对照组(n=25)。A组:用螺旋糊剂输送器将混合后的AH-plus糊剂均匀涂抹于根管壁,主尖蘸取适量AH-plus糊剂后插入根管,侧压充填器辅助充入副尖直至根管充填严密,于根管口下方约2 mm处烫除多余牙胶,磷酸锌水门汀封闭窝洞;B组:通过输送头将预成可注射的GuttaFlow糊剂充满根管的中上2/3,慢慢插入主牙胶尖并轻柔上下提插、顺时针旋转360°,重复10次后置入,在根管口下方约2 mm处烫除多余牙胶,垂直加压器加压,磷酸锌水门汀封闭窝洞;C组:通过输送头将预成可注射的iRoot SP充满根管的中上2/3,方法同B组。阳性对照组:25个感染根管不充填;阴性对照组:10个无菌根管不充填。全部样本在37℃厌氧条件下培养20 min和1、7、14、21d。
临床操作采用随机双盲法由两名经过标准一致性检验(Kappa值为0.83)的操作者共同完成。
1.4.4细菌计数
各组分别于37℃厌氧培养20 min和1、7、14、21d各时间点,每组随机取出5个样本做细菌计数。方法:切除根尖3 mm后,用#2 GG钻磨除根充材料,#3~#5 GG钻预备根管,收集磨除的根充材料和牙本质粉末到含有2 mL PBS溶液的离心管中,均匀混合30 s后,按照体积比为1∶10的比例分别进行梯度稀释,每个梯度各取50 μL涂于BHI琼脂培养皿,并置于37℃厌氧条件下静置培养24 h后,分别观察每个培养皿菌落形成情况并进行细菌计数。计数结果取平均值后,乘以相应的稀释倍数得出每毫升CFU,制作CFU/mL(Y轴)与时间(X轴)的对数关系图。
1.5 各封闭剂pH的测定
将等质量的AH-plus、GuttaFlow、iRoot SP封闭剂(5±0.5)mg均匀涂抹在24孔板中(96 mm2),并立即放入培养箱(37℃,相对湿度>95%)。分别于培养20 min和1、7、14、21d时取出,将3 mL无菌蒸馏水加入到涂抹封闭剂和空白孔中(对照组)。20 min后将pH测试仪探头浸入液面,待数值稳定后读数,各时间点每种封闭剂pH值检测3次取其平均数。
1.6统计学分析
2 结果
2.1DCT细菌计数
阴性对照组无细菌检出。GuttaFlow在充填后20 min和1、7、14、21d时均无明显抗菌效果(P>0.05);而AH-plus与iRoot SP在20 min和1d时有明显杀菌效果,且与阳性对照组有统计学差异(P<0.05),但两种封闭剂间抗菌效果无统计学差异(P>0.05)(图1)。
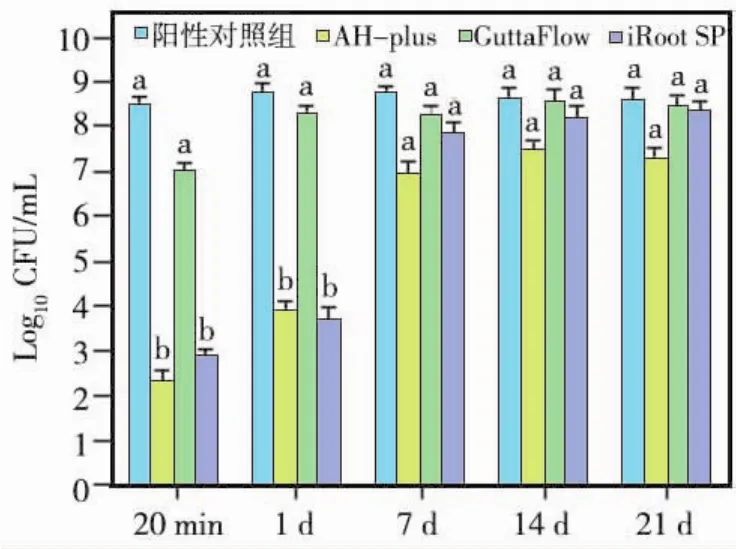
图1 各封闭剂不同时间点DCT细菌计数
2.2IRCM实验结果
2.2.1扫描电镜
机械预备后的根管经52.5 g/L次氯酸钠和170 g/L EDTA(pH=7.2)处理后,根管壁玷污层已被完全去除干净,且牙本质小管口全部开放(图2a、b)。
接种粪肠球菌并厌氧孵育4周后,其形态正常并以生物膜样结构附着在根管壁表面(图3a、b),可见粪肠球菌侵入牙本质小管深层(图3c、d),表明粪肠球菌感染根管模型建立成功。

图2 根管经52.5 g/L次氯酸钠和170 g/L EDTA处理后(SEM)

图3 接种粪肠球菌4周后,可见粪肠球菌黏附于根管壁表面并侵入到牙本质小管深层(SEM)
2.2.2细菌计数
阴性对照组无细菌检出。GuttaFlow在充填后20 min和1、7、14、21d时细菌数量与阳性对照组相比均无统计学差异(P>0.05);AH-plus在充填后20 min和1、14d时能有效杀灭细菌,与阳性对照组相比有统计学差异(P<0.05);iRoot SP除在21d无明显抗菌效果外,其他时间点均能有效杀灭细菌(P<0.05),但AH-plus与iRoot SP之间抗菌性无统计学差异(P>0.05)(图4)。
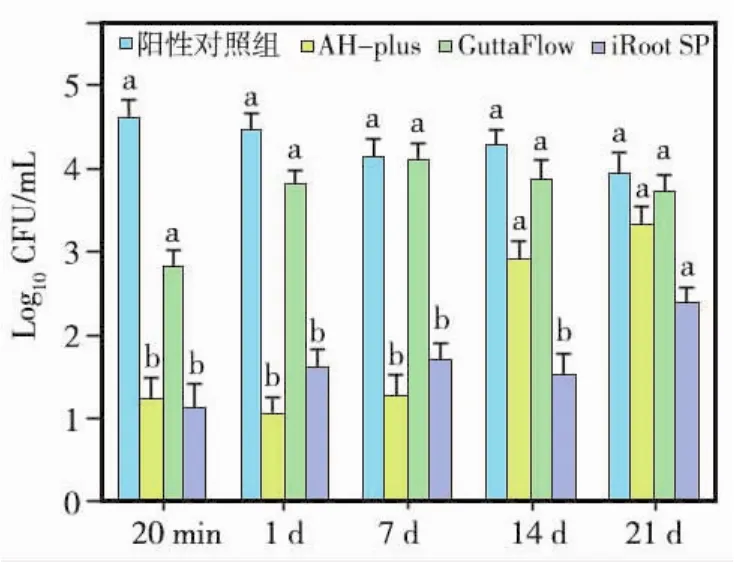
图4 各封闭剂不同时间点IRCM实验细菌计数结果
2.3pH结果
AH-plus的pH值在20 min时为7.83,当结固21d后pH值则降低为7.19;GuttaFlow的pH值随着时间延长基本保持不变(7.14~7.47),而iRoot SP的pH值最高(11.04~11.78)(图5)。
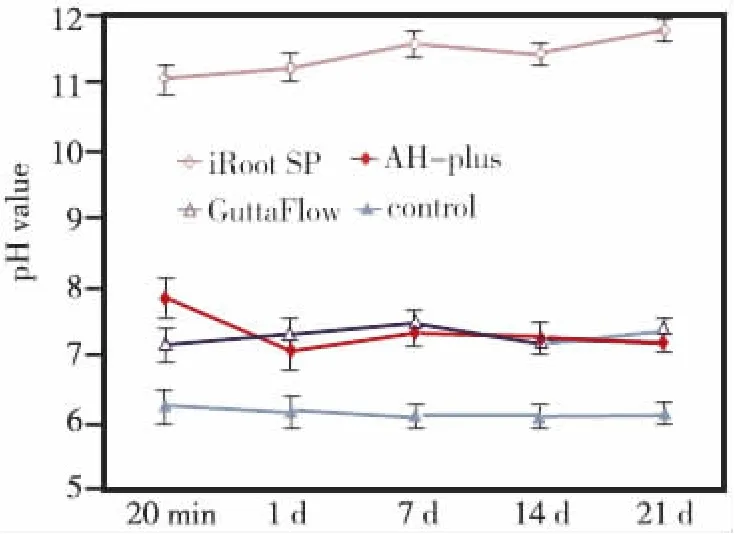
图5 各封闭剂不同时间点的pH值
3 讨论
理想的根管封闭剂应该具有良好的封闭性、组织相容性、形态稳定性和持久的抗菌性能[15-17]。目前,根管预备和化学消毒均不能完全清除根管内细菌,即封闭剂的抗菌作用可杀灭根管内的残余细菌,提高根管治疗的成功率。目前,尚无标准的实验方法用于检测封闭剂的抗菌效果,这就导致对各种封闭剂抗菌性的报道往往不一致。
DCT是常用于研究根管封闭剂抗菌性的定量可重复实验。其优点在于封闭剂直接与细菌接触,其抗菌效果不受溶解性和扩散性的影响,而且该方法可用于比较在混合凝固过程中,不同状态下封闭剂的抗菌效果[6,18]。但是在DCT中,不能模拟根管真实的解剖形态,且根管内细菌是以生物膜的形式存在,所以封闭剂的抗菌结果无法客观预测临床效果。近年,感染根管模型(IRCM)同样常用于封闭剂抗菌性的检测,有研究表明,培养3周后,粪肠球菌很容易深入到牙本质小管300~400 μm处,虽然延长时间可增加细菌入侵的深度,但是平均深度随时间的改变很小[7]。目前,有学者利用梯度离心法将细菌被动运送到牙本质小管内来检测封闭剂抗菌效果,此方法虽然可保证侵入细菌深度的均一性,但离心力是否对于细菌的生理状态和生物学行为产生影响,还需更多的实验证明[19-20]。
在本实验中,GuttaFlow在DCT和IRCM实验中对粪肠球菌无抗菌效果,与对照组相比无统计学差异(P>0.05)。GuttaFlow常温流动牙胶是一种新的根管充填材料,为封闭剂(主要成分为聚二甲基硅氧烷、硅树脂油、石蜡油、氧化锆、六氢氯铂酸、着色剂、纳米银等)和微球形牙胶颗粒(主要成分为牙胶颗粒、氧化锌、硫化钡等)混合而成。其流动性较好、无固化收缩、能够与根管壁很好的贴合,且操作过程中无需加热或加压,操作简便快捷[11-12]。本结果与Nawal等的报道相一致[21],说明GuttaFlow虽然和其前类产品RoekoSeal相比加入了纳米银等抗菌成分,但是对于粪肠球菌等抵抗力较强的细菌,其抗菌性仍然较弱。
AH-plus与iRoot SP在两种检测方法中均有一定的抗菌活性。在DCT中,两种封闭剂在7d时均无抗菌效果,而在IRCM实验中,AH-plus和iRoot SP的抗菌效果超过7d,iRoot SP的抗菌活性甚至达到14d,说明在IRCM方法中测得封闭剂的抗菌性均有所延长,原因可能有两种:①实验设计不同:在DCT中,混合的封闭剂放置一段时间后才和细菌接触,可能封闭剂的部分抗菌成分已丧失,而在IRCM实验中,封闭剂混合后立即与细菌接触,能使其抗菌成分发挥最大的抗菌效果;②微环境的不同:牙本质本身可促进生物陶瓷性封闭剂(如iRoot SP)发挥持久的抗菌性[22],可能是由于牙本质中的成分(如硅)参与了陶瓷材料生物矿化过程中抗菌的过程。Zehnder等[23]将生物陶瓷性封闭剂和牙本质粉末混合后,检测其与单独封闭剂的抗菌性,发现混合后封闭剂抗菌时间延长。
iRoot SP是一种新型的生物陶瓷性材料,其主要成分为硅酸钙、磷酸钙、氧化钙、氧化钽和填料组成,由于其良好的生物相容性、封闭性和抗菌性,近几年主要用做侧穿修补材料和根管封闭剂[13-14]。在IRCM实验中,其长时间的抗菌性主要是由于硅酸钙和磷酸钙与牙齿矿物质间发生生物矿化过程所致。有研究表明,iRoot SP中的硅酸钙与水分接触后可变为硅酸钙水凝胶和Ca(OH)2,部分Ca(OH)2同磷酸盐反应后可生成羟磷灰石和水,而水又参与到与硅酸钙反应的循环中,再次生成硅酸钙水凝胶和Ca(OH)2[24-25],在高pH值环境中,从牙本质中溶解后的游离硅离子直接杀伤细菌[23]。本实验中,iRoot SP的pH值均高于其他封闭剂,21d后可达11.78。有研究发现,当局部微环境pH值在10.5~11.0时,可抑制粪肠球菌的繁殖;当pH升高11.5时,粪肠球菌被杀死[26]。同时,iRoot SP是一种亲水性很强的材料,可渗透牙本质小管内发挥抗菌作用。因此,高pH值、活性离子的释放和强亲水性可能是iRoot SP能长时间杀灭粪肠球菌的主要原因。
AH-plus是临床常用的环氧树脂类封闭剂,其抗菌作用主要是在聚合过程中可释放甲醛和胺类等抗菌成分[27]。Pizzo等报道在DCT中,只有新鲜混合(20 min)的AH-plus具有抗菌效果,而混合后1、7d后则无明显抗菌效果[28],而在本研究的DCT中,混合后20 min和1d内的AH-plus均有明显的抗菌性(P<0.05)。其原因可能是两者细菌计数方法的不同,Pizzo等是利用分光光度计检测杀菌后菌液的OD值,但由于细菌被杀死后的尸体可能会影响到分光光度计的读数,从而造成OD值偏低,出现抗菌效果的假阴性。本实验DCT通过对剩余存活的细菌进行铺板计数,完善了其对于封闭剂抗菌性的分析评价。
综上所述,不同封闭剂所表现出的抗菌性是受多种因素影响的,如组成成分检测手段和检测时间等。因此在评价封闭剂的抗菌性能时,需采用多种方法进行比较才能得出科学的结论。而且在临床治疗中,封闭剂的抗菌效果和其他因素也密切相关,如封闭性、流动性和溶解性等,因此,要到达远期的抗菌效果,材料应用的创新至关重要。
[1]Sjogren U,Hagglund B,Sundqvist G,et al.Factors affecting the long-term results of endodontic treatment[J].J Endod,1990,16(10):498-504.
[2]Siqueira JF Jr.Aetiology of root canal treatment failure:why well-treated teeth can fail[J].Int Endod J.2001,34(1):1-10.
[3]Sipert CR,Hussne RP,Nishiyama CK,et al.In vitro antimicrobial activity of Fill Canal,Sealapex,Mineral Trioxide Aggregate,Portland cement and EndoRez[J].Int Endod J,2005,38(8):539-543.
[4]Cobankara FK,Altinoz HC,Ergani O,et al.In vitro antibacterial activities of root-canal sealers by using twodifferent methods[J].J Endod,2004,30(1):57-60.
[5]Wanted:a base of evidence.Editorial Board of the Journal of Endodontics[J].J Endod,2007,33(12):1401-1402.
[6]Weiss EI,Shalhav M,Fuss Z.Assessment of antibacterial activity of endodontic sealers by adirect contact test[J].Endoddent Traumatol,1996,12(4):179-184.
[7]Haapasalo M,Orstavikd.In vitro infection anddisinfection ofdentinal tubules[J].Jdent Res,1987,66(8):1375-1379.
[8]Heling I,Chandler NP.The antimicrobial effect withindentinal tubules of four root canal sealers[J].J Endod,1996,22(5):257-259.
[9]Saleh IM,Ruyter IE,Haapasalo M,et al.Survival of Enterococcus faecalis in infecteddentinal tubules after root canal filling withdifferent root canal sealers in vitro[J].Int Endod J,2004,37(3):193-198.
[10]Özcan E,Eldeniz AU,Arl H.Bacterial killing by several root filling materials and methods in an ex vivo infected root canal model[J].Int Endod J,2011,44(12):1102-1109.
[11]李艳,赵今.Guttflow常温流动牙胶根管充填系统的研究进展[J].牙体牙髓牙周病学杂志,2009,19(2):115-117.
[12]Zielinski TM,Baumgartner JC,Marshall JG.An evaluation of Guttaflow and gutta-percha in the filling of lateral grooves anddepressions[J].J Endod,2008,34(3):295-298.
[13]Hessd,Solomon E,Spears R,et al.Retreatability of a bioceramic root canal sealing material[J].J Endod,2011,37(11):1547-1549.
[14]Loushine BA,Bryan TE,Looney SW,et al.Setting properties and cytotoxicity evaluation of a premixed bioceramic root canal sealer[J].J Endod,2011,37(5):673-677.
[15]Grossman L.Antimicrobial effect of root canal cements[J].J Endod,1980,6(6):594-597.
[16]Geurtsen W,Leyhausen G.Biological aspects of root canal filling materials:histocompatibility,cytotoxicity,and mutagenicity[J].Clin Oral Investig,1997,1(1):5-11.
[17]Orstavikd.Antibacterial properties of endodontic materials[J]. Int Endod J,1988,21(2):161-169.
[18]Eldeniz AU,Hadimli HH,Ataoglu H,et al.Antibacterial effect of selected root end filling materials[J].J Endod,2006,32(4):345-349.
[19]Ma J,Wang Z,Shen Y,et al.A new noninvasive model to study the effectiveness ofdentindisinfection by using confocal laser scanning microscopy[J].J Endod,2011,37(10):1380-1385.
[20]Wang Z,Shen Y,Haapasalo M.Dentin extends the antibacterial effect of endodontic sealers against Enterococcus faecalis biofilms[J].J Endod,2014,40(4):505-508.
[21]Nawal R,Parande M,Sehgal R,et al.A comparative evaluation of antimicrobial efficacy and fiow properties for Epiphany,Guttafiow and AH-Plus seale[J].Int Endod J,2011,44(8):307-313.
[22]Zhang H,Pappen FG,Haapasalo M.Dentin enhances the antibacterial effect of mineral trioxide aggregate and bioaggregate[J].J Endod,2009,35(2):221-224.[23]Zehnder M,Waltimo T,Sener B,et al.Dentin enhances the effectiveness ofbioactive glass S53P4 against a strain of Enterococcus faecalis[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(4):530-535.
[24]Richardson IG.Model structures for C-(A)-S-H(I)[J]. Acta Crystallogr B Struct Sci Cryst Eng Mater,2014,70(6):903-923.
[25]Yang Q,Troczynski T,LiudM.Infiuence of apatite seeds on the synthesis of calcium phosphate cement[J].Biomaterials,2002,23(13):2751-2760.
[26]McHugh CP,Zhang P,Michalek S,et al.pH required to kill Enterococcus faecalis in vitro[J].J Endod,2004,30(4):218-219.
[27]Yasuda Y,Kamaguchi A,Saito T.In vitro evaluation of the antimicrobial activity of a new resin-based endodontic sealer against endodontic pathogens[J].J Oral Sci,2008,50(11):309-313.
[28]Pizzo G,Giammanco GM,Cumbo E,et al.In vitro antibacterial activity of endodontic sealers[J].Jdent,2006,34(1):35-40.
Comparasion of the antibacterial efficacy of 3 root canal sealers in vitro
QIU Jun*,CAO Hai-wei,TIAN Yu,XIAO Yan,ZHANG YU-lin,XIN Yue,MEI Xiao-han,SUN Han-tang,YU Qing
(*State Key Laboratory of Military Stomatology,Department of Operativedentistry and Endodontics,School of Stomatology,The Fourth Military Medical University,Xi'an 710032,China)
AIM:To compare the antimicrobial effect of AH-plus(A),GuttaFlow(B)and iRootSP(C)in vitro.METHODS:Direct contact test(DCT)and infected root canal model(IRCM)test were performed.IndCT,the sealers were respectively stored in the centrifuge tubes freshly mixed for 20 min,1,7,14 and 21d.At each time point,Enterococcus faecalis bacterial suspension was exposed to the sealers for 60 m.The CFU of the bacteria were counted.In infected root canal model(IRCM)test,the root canals of 100 single rooted human teeth were infected with Enterococcus faecalis and were filled with AH-plus,GuttaFlow,and iRoot SP respectively(n=25).25 non-filled root canals served as the controls.The filling materials anddentine powder were collected and cultured.The numbers ofbacteria after filling were counted.Data were analyzed by one-way ANOVA.The pH values on sealers atdifferent time points were also measured.RESULTS:IndCT,AH-plus and iRoot SP reduced CFUs at 20 min and 1d(P<0.05),but thedifference at other time points showed no statistical significance(P>0.05).GuttFlow showed no antibacterial efficacy at each time point(P>0.05).In IRCM test,AH-plus killed more bacteria than the control at 20 min,1d and 7d(P<0.05).iRoot SP killed more bacteria than control at 20 min,1d,7d and 14d(P<0.05).GuttFlow show no antibacterial efficacy at each time point(P>0.05).In pH test,iRootsp had the highest pH value atdifferent times(11.04-11.78).AH-plus had the similar pH value with GuttFlow.CONCLUSION:The pH value of the sealers can not explain their antibacterial effect.AH-plus and iRoot SP has antibacterial efficacy in virto.GuttaFlow is ineffective against Enterococcus faecalis.
antibacterial efficacy;root canal sealer;direct contact test(DCT);infected root canal model test(IRCM);Enterococcus faecalis
[文献标识码]A [文章编号]1005-2593(2015)04-0238-07
10.15956/j.cnki.chin.j.conserv.dent.2015.04.011
2014-12-19;
2015-03-19
仇 珺(1986-),男,汉族,甘肃兰州人。硕士生(导师:孙汉堂)曹海炜为共同第一作者
余 擎:E-mail,yuqing@fmmu.edu.cn
孙汉堂:E-mail,hantang@fmmu.edu.cn
