L—谷氨酸对白芨组培苗叶绿素含量·矿质元素吸收及生长的影响
2015-10-21江胜德郭兰王邝佳等
江胜德 郭兰 王邝佳等
摘要 [目的]研究L谷氨酸对白芨组培苗生长生理的影响。[方法]从叶绿素生物合成机理、矿质元素吸收机理出发,在MS培养基中添加不同浓度的L谷氨酸,测定不同处理的白芨组培苗叶绿素含量、矿质元素的含量及生物量。[结果]当谷氨酸浓度为200 mg/L时,白芨组培苗对矿质元素P、Mg的吸收量最大,同时生物量和叶片叶绿素含量达到最大。[结论]在培养基中添加L谷氨酸对白芨组培苗生长具有促进作用。
关键词 L谷氨酸;白芨组培苗;叶绿素;矿质元素;生长;影响
中图分类号 S567 文献标识码 A 文章编号 0517-6611(2015)20-143-03
Abstract [Objective] The research aimed to study the effects of Lglutamic acid on the growth physiology of tissue culture seedlings of Bletilla striata. [Method]Starting from the chlorophyll biosynthesis mechanisms and absorption mechanism of mineral elements,adding different concentrations of L glutamic acid in the MS medium,the chlorophyll content,mineral elements content and biomass of different treatments from tissue culture seedlings of Bletilla striata were measured.[Result]When the glutamate concentration of 200 mg/L,the absorptive amount of mineral elements P and Mg from tissue culture seedlings of Bletilla striata were maximum,the biomass and chlorophyll content reached the maximum at the same time.[Conclusion]Lglutamic acid was added in the culture medium,which had a promoting effect on the growth of tissue culture seedlings of Bletilla striata.
Key words Lglutamic acid;Tissue culture seedlings of Bletilla striata;Chlorophyll;Mineral elements;Growth;Effects
近年来,国内植物组培技术发展迅速。在植物组织培养过程中,植物体的生长方式主要分为靠培养基中的糖提供的碳源生长(异养)和靠自身光合作用进行自然生长(自养)2种。传统的组培方式必须在培养基中添加糖以提供碳源,但组培苗长期靠异养进行生长繁殖就会出现叶片小、气孔开闭功能差等影响组培苗的光合作用,最终导致植株失去自养的能力[1]。因此在组织培养中必须提高组培苗的自养能力,而提高自养能力就是要提高组培苗自身的光合作用,叶片中叶绿素的含量是决定组培苗进行光合作用的关键。提高叶绿素含量,有利于植物光合作用的进行,促进碳水化合物的积累,从而促进植物生长[2-4]。L谷氨酸是其他氨基酸的合成前体,也是合成蛋白质的重要物质,为植物的生长提供能量物质[5-6]。同时,L谷氨酸也是植物叶绿素合成的起始物质,提高植物体内L谷氨酸的含量有利于促进叶绿素的生物合成,从而提高植物光合作用能力[2,7]。另外,L谷氨酸的添加可以促使植物对P、Zn、Mg、Cu等矿质元素的吸收。
白芨(Bletilla striata(Thunb.)Reichb.f.)花色艷丽、花型优雅、叶态美观,其干燥的块茎主要做药用,具有消肿生肌、改善皮肤营养状况的功效,因此,白芨具有极高的观赏价值和药用价值[8-10]。由于野生白芨濒危,现在国内生产大多采用组织培养的方式进行快速繁殖以满足人们的需求,该研究从叶绿素生物合成机理出发,在MS培养基中添加不同浓度的L谷氨酸,研究L谷氨酸对白芨组培苗叶片叶绿素合成及矿质元素吸收的影响,以期优化白芨组培培养基,对白芨组培苗的生产及保护白芨种质资源具有重要的意义。
1 材料与方法
1.1 试验材料
采用兰科植物白芨为试验材料,在组培室内进行继代培养4~5代,选取大小一致的组培苗接种于接种瓶内培养。
1.2 试验方法
以L谷氨酸200、400、600、800 mg/L的浓度梯度分别添加到MS基本培养基中,并加入琼脂7 g/L、蔗糖30 g/L,且以未添加L谷氨酸为空白对照组(CK),构成5种培养基,每组10次重复,具体培养基分别为1(MS+0.2 mg/L NAA+2 mg/L 6BA+200 mg/L L谷氨酸)、2(MS+0.2 mg/L NAA+2 mg/L 6BA+400 mg/L L谷氨酸)、3(MS+0.2 mg/L NAA+2 mg/L 6BA+600 mg/L L谷氨酸)、4(MS+0.2 mg/L NAA+2 mg/L 6BA+800 mg/L L谷氨酸)、CK(MS+0.2 mg/L NAA+2 mg/L 6BA+0 mg/L L谷氨酸)。
1.3 培养条件
培养室内温度为恒温25 ℃,光照强度为2 000~3 000 lx,每天光照12 h,培养时间为60 d。
1.4 数据测定
1.4.1 组培苗叶片叶绿素含量的测定。利用便携式叶绿素仪SPAD502进行白芨组培苗叶片叶绿素含量的测定[11-15]。
1.4.2 组培苗矿质元素含量的测定。
将培养后称重组培苗在105 ℃杀青20 min后,然后85 ℃恒温烘干至恒重备用。每组分别取0.1~0.2 g烘干样品粉碎研磨,并利用H2SO4-H2O2消煮法进行消煮,消煮完成得到消煮液,利用钒钼黄比色法在分光光度计上测定P元素;利用火焰光度计法在火焰光度计上测定K元素;每组分别取0.25 g烘干样品装入瓷干锅中在马弗炉中进行灰化处理,灰化温度525 ℃,烧至灰分近于白色为止,大约1~2 h,灰化结束后,利用HCl溶解灰分,纯水定容至100 ml,冷却后过滤,滤液经稀释后利用原子吸收光谱仪测定Mg元素[16]。
1.4.3 组培苗生物量变化的测定。
将装有培养基的接种瓶灭菌冷却以后,用电子天平称重计数,在超净工作台上将白芨组培苗接种于接种瓶内,接种后同样称重计数,称重得出的质量差即组培苗的初始质量;在培养室内培养60 d后,将组培苗取出,用吸水纸将表面水分吸干后称重计数,即培养后组培苗质量,培养后组培苗质量与初始质量的差即组培苗的生物量变化。
2 结果与分析
2.1 L谷氨酸对白芨组培苗叶片叶绿素含量的影响 对添加L谷氨酸的白芨组培苗叶片叶绿素含量进行方差分析,通过F检验,叶绿素相伴概率P值为0.044,小于显著水平0.05,因此,谷氨酸的添加对白芨组培苗叶绿素含量的变化有显著性影响。除了600 mg/L处理叶绿素含量低于对照组(CK),其他处理均高于对照组(CK)叶绿素含量,且200 mg/L处理叶绿素含量最高。
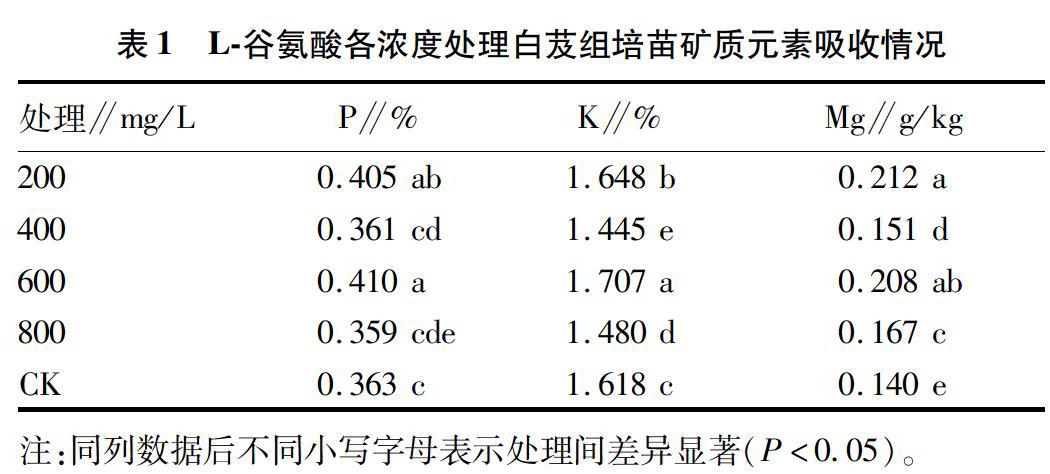
2.2 L谷氨酸对白芨组培苗吸收矿质元素(P、K、Mg)的影响
测定培养后白芨组培苗中P、K、Mg的含量,并对其进行方差分析,结果发现,P、Mg的相伴概率P值分别为0.042、0。K的相伴概率P值则为0.221,可见针对L谷氨酸的添加,对白芨组培苗吸收P、Mg有显著影响,但对K的吸收无显著影响。其中,对Mg的吸收,各处理组均与空白对照组(CK)差异显著,且400 mg/L处理与800 mg/L处理差异显著;而对P的吸收,仅200 mg/L处理和600 mg/L处理与空白对照组(CK)差异显著(表1)。
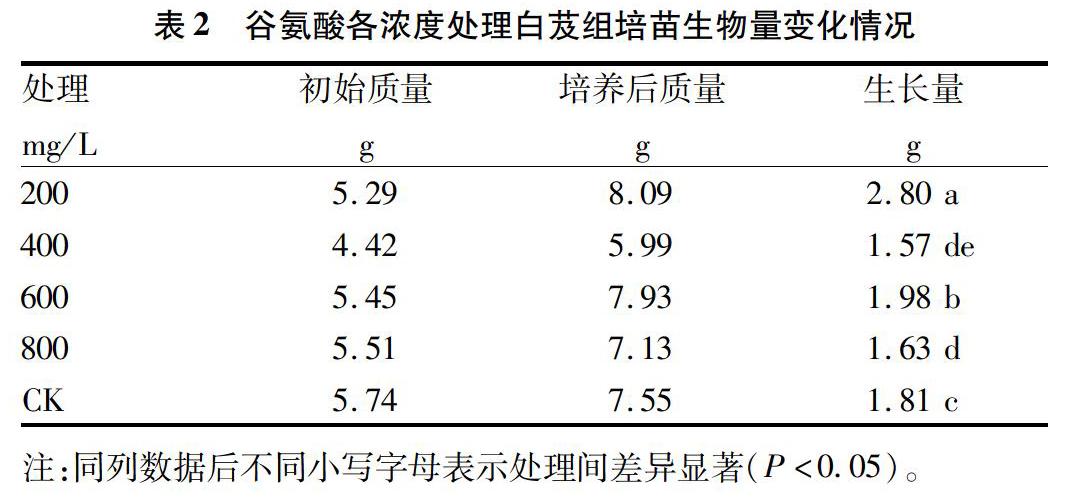
2.3 L谷氨酸对白芨组培苗生物量变化情况的影响
白芨组培苗接种后在培养室内培养60 d,取出称重计数并进行方差分析。F检验表明,其相伴概率P值接近0,表明培养基中L谷氨酸的浓度对白芨组培苗的生长有显著性影响。除400 mg/L处理与800 mg/L处理之间无显著差异以外,其余各组处理之间以及各处理与空白对照组(CK)之间均差异显著。此外,200 mg/L处理与600 mg/L处理白芨组培苗生物量变化较大,其中200 mg/L处理生物量变化最大,较空白对照组(CK)重0.99 g(表2)。
3 讨论
(1)叶绿素是植物进行光合作用的色素,在一定范围内叶绿素含量与光合速率呈正比关系,即随着叶绿素含量增加,光合速率随之增加,因此,植物叶片中叶绿素的含量直接影响植物进行光合作用的能力。在培养基中添加L谷氨酸可以促进白芨组培苗叶片叶绿素的合成。合成叶绿素的起始物质是L谷氨酸[1],白芨组培苗通过培养基将L谷氨酸吸收到体内,使合成叶绿素的原料增加,促进合成叶绿素的反应正向进行,进而提高白芨组培苗叶片内叶绿素的含量。很多学者的研究也证明L谷氨酸可以促进植物叶片叶绿素的合成这一观点[1,7],如李宗菊等在研究无糖组织培养的培养基中添加L谷氨酸,结果表明,当L谷氨酸浓度低于10 mg/L时,L谷氨酸的添加量与植物叶片叶绿素含量呈正比关系,即L谷氨酸浓度越大,植物叶绿素含量越高,净光合速率也随之升高;但当L谷氨酸浓度高于10 mg/L时,叶绿素的含量会随L谷氨酸浓度的升高而降低,当L谷氨酸浓度>500 mg/L时,表现出明显的抑制作用[1]。此次试验表明,当L谷氨酸浓度为200 mg/L时,白芨组培苗叶片叶绿素含量达最高,比空白对照组(CK)高4.966 mg/g,此次试验并未表现出在一定程度范围内,L谷氨酸的浓度与叶绿素含量呈正比关系,可能是由于不同植物对L谷氨酸吸收利用率不同。
(2)植物光合作用除受光照、温度等生态因子影响外,矿质元素的影响也是不容忽视的[17]。矿质元素是植物生理代谢的必需元素,对植物光合作用起至关重要作用。P元素对植物代谢活动起着重要作用,参与蛋白质、碳水化合物的形成与相互转化,且直接参与植物光合作用的同化和光合磷酸化[18];Mg元素是植物进行光合作用的必须元素之一,是植物叶绿素组成成分,其主要作用是维持叶绿体类囊体膜的结构稳定,保证对光能的有效吸收、传递和转化[19-23]。所以说,增加白芨组培苗对矿质元素P、Mg的吸收就可以提高白芨组培苗的光合作用,进而促进白芨组培苗快速生长发育。在培养基中添加L谷氨酸可以促进白芨组培苗对矿质元素的吸收[24],这是因为L谷氨酸分子结构中带有2个负电荷的R基氨基酸可以与P、Mg等金属阳离子络合。白芨组培苗在培养基中吸收营养的同时将L谷氨酸络合物一并吸收到体内,在组培苗体內经过生化反应,P、Mg等金属离子得以释放,进而参与到其他生化反应过程中去。此外,在培养基中添加不同浓度的L谷氨酸,组培苗吸收矿质元素的效果也不同。
(3)植物生物量的变化可以形象地反映出植物光合作用能力的强弱,在添加不同浓度L谷氨酸的培养基中培养白芨组培苗方式试验中发现,当L谷氨酸浓度为200 mg/L时,白芨组培苗的长势最好,茎粗壮、叶片浓绿有光泽,说明适当浓度的L谷氨酸可以促进白芨组培苗的生长发育,分析原因可能有以下几点:首先,L谷氨酸的添加增加了白芨组培苗对矿质元素的吸收,被吸收的矿质元素在植物体内经过一系列复杂的生化反应可以合成植物生长必须的有机物质,如磷会在植物体内合成为核酸、酶类、维生素以及多种重要化合物,磷直接参与碳水化合物、脂肪、蛋白质的形成和转;氮可以在植物体内合成蛋白质、叶绿素、激素等有机化合物,是生命的物质基础;镁是构成叶绿素的主要成分;其他未能转化成有机化合物的矿质元素在植物体内也以不同的方式协调各生理生化反应,提高植物本身生物机能,从而促进植物茁壮生长。另外,L谷氨酸的添加会促进白芨组培苗叶片叶绿素的含量,而叶绿素的含量直接决定植物光合作用的强弱,也就是说,L谷氨酸的添加会促进植物进行光合作用合成自身生长的必需有机物,同时L谷氨酸促进植物吸收的矿质元素也可以促进植物光合作用,植物的光合作用能力增强,进而会促进植物的生长发育。
4 结论
为了研究L谷氨酸对白芨组培苗生理的影响,该试验从白芨组培苗对叶片叶绿素的含量变化、矿质元素P、K、Mg的吸收情况以及白芨组培苗生物量的变化3个指标来研究L谷氨酸对白芨组培苗生理影响。结果表明,L谷氨酸对白芨组培苗生理机能有促进作用,且当L谷氨酸浓度为200 mg/L时,是白芨培养基的最佳浓度。因此,在培养基中添加适量的L谷氨酸可以增强白芨组培苗的自养能力,降低培养基中糖的添加量,从而实现白芨组培苗的减糖甚至无糖培养。
参考文献
[1] 李宗菊,桂明英.谷氨酸在无糖组织培养中的应用[J].西南农业学报,1999,12(3):45-49.
[2] 潘瑞炽.植物生理学[M].北京:高等教育出版社,1995.
[3] 郑朝峰.氮素形态对小麦叶片谷氨酰胺合成酶的影响[J].植物生理学通讯,1986(4):4647.
[4] 董运斋.大花蕙兰营养特性与施肥的研究[D].北京:北京林业大学,2005:11-13.
[5] 陈华萍,魏育明,郑有良.四川地方小麦品种蛋白质和氨基酸间相关研究[J].麦类作物学报,2005,25(5):113-116.
[6] 沈同,王镜岩.生物化学[M].北京:高等教育出版社,2002.
[7] 赵宇瑛,张再伟.叶面喷施谷氨酸对柑桔叶绿素含量的影响[J].湖北农业科学,2003(6):87-88.
[8] 陈心启,吉占和,罗毅波.中国野生兰科植物彩色图[M].北京:科学出版社,1999:107.
[9] 刘蓬芹,夏丽娅.中药白芨的现状研究概述[J].山东医药工业,2000,19(5):32.
[10] 中国药典委员会.中华人民共和国药典(一部)[S].北京: 人民卫生出版社,1995.
[11] LOH F,GRABOSKY J,BASSUK N.Use of the minolta SPAD502 to determine chlorophyll concentration in Ficus benjamina L. and Populus deltoids Marsh leaf tissue[J].Hort Science,2000,35(7):423-424.
[12] HAN H H,KIM Y K,LEE J Y.Correlation among the nitrogen,chlorophyll(SPAD Value) and photosynthetic reacitions on the leaves of one-yearold shoots by training angles in ‘Fuji apple trees[J].Hort Science,2004,39(4):762-763.
[13] BABAR M A,REYNOLDS M P,VAN GINKEL M,et al. Spectral reflectance to estimate genetic variation for inseason biomass,leaf chlorophyll and canopy temperature in wheat[J].Crop Sic,2006,46(3):10461057.
[14] LOH F C,GRABOSKY J C,BASSUK N L.Using the SPAD502 meter to assess chlorophyll and nitrogen content of Benjamin fig and cottonwood leaves[J].Hort Technology,2002,12(4):541-740.
[15] NEILSEN D,HOGUE E J,NEILSEN G H,et al.Using SPAD-502 values to assess the nitrogen status of apple trees[J].Hort Science,1995,30(3):508-512.
[16] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000.
[17] 余叔文,汤章城.植物生理与分子生物学[M].北京:科学出版社,1998:262.
[18] 吴楚,谢欲春,甘彩霞.磷胁迫对黄瓜幼苗生长·光合作用·生物量及其分配的影响[J].安徽农业科学,2005,33(10):1825-1827.
[19] HUBER S C,MAURY W.Effects of Magnesium on intact chloroplasts[J].Plant Physiol,1980,65:350-354.
[20] RAO I M,SHARP R E,BOYER J S.Leaf magnesium alters photosynthetic response to low water potentials in sunflower[J].Plant Plysiol,1991,95:1189-1196.
[21] HUER S C,MAURY W.Effects of Magnesium on intact chloroplasta[J].Plant Physiol,1978,62:321-325.
[22] 汪洪,褚天鐸.植物镁素营养的研究进展[J].植物学通报,1999,16(3):245-250.
[23] 王芳,刘鹏.土壤镁的植物效应的研究进展[J].江西林业科技,2003(1):34-37.
[24] 吴沿友,刘能俊,龙青.天麻矿物质吸收及其营养机理探讨[J].广西植物,1999,19(4):377-380.
