曼氏迭宫绦虫annexinB8的生物信息学分析和基因克隆
2015-10-21梁培1吕刚1周晓君2陈新新1陈小静1符瑞佳1
梁培1 吕刚1 周晓君2 陈新新1 陈小静1 符瑞佳1★
·论著·
曼氏迭宫绦虫annexinB8的生物信息学分析和基因克隆
梁培1 吕刚1 周晓君2 陈新新1 陈小静1 符瑞佳1★
目的通过生物信息学预测曼氏迭宫绦虫annexinB8(SmannexinB8)的生物学特征,及潜在功能和结构,并且进行基因克隆,为下一步SmannexinB8参与宿主免疫调节研究提供依据。方法通过NCBI的ORF finder工具对SmannexinB8的开放阅读框进行分析,利用ExPASy网站进行蛋白的物理化学参数、信号肽、跨膜螺旋、潜在分子生物学功能的预测,通过NCBI/BLAST对蛋白保守功能域进行检测。不同物种的annexin序列从NCBI网站获取,并利用Vector NTI suit 8.0和TreeView软件进行分析。利用SWISS-MODEL网站和SPDBV 4.10软件分析SmannexinB8蛋白的三维空间结构。此外,对SmannexinB8基因进行扩增,并克隆到原核表达载体pET-28a(+)。结果SmannexinB8是一个全长基因,编码347个氨基酸。蛋白由4个典型的annexin重复结构域组成,序列当中没有信号肽,是一个稳定的可溶性蛋白分子。三维空间立体结构分析结果显示SmannexinB8是一个保守的蛋白。SmannexinB8与多房棘球绦虫、口膜壳绦虫、细粒棘球绦虫、华支睾吸虫以及人类的annexin基因的同源性分别是68%,67%,65%,46%和40%。分子进化分析显示SmannexinB8与绦虫属的亲源性最近,而与其他物种,如吸虫、哺乳动物亲源性较远。结论SmannexinB8可能具有抑制磷脂酶A2的活性,促进细胞融合、参与调节免疫反应和离子通道形成的功能,可能在参与宿主免疫调节中起到关键性的作用。
曼氏迭宫绦虫;annexin B8;生物信息学分析;多功能
曼氏迭宫绦虫是迭宫绦虫属之一,其主要分布在中国、日本、韩国和泰国[1]。裂头蚴是曼氏迭宫绦虫的幼虫,能够导致严重的人兽共患寄生虫病和威胁公共健康。在中国,超过1 000人感染了裂头蚴,他们分别来自27个省、自治区和直辖市[2]。曼氏迭宫绦虫的终宿主是肉食哺乳动物,包括狗和猫,第一中间宿主是桡足动物,第二中间宿主是脊椎动物,如爬行动物、鸟类和哺乳动物[3]。尽管有关于人感染曼氏迭宫绦虫成虫的报道,但是人通常作为第二中间宿主[4]。人感染裂头蚴主要是通过喝了含有裂头蚴感染剑水蚤的生水或是食用感染有裂头蚴的生青蛙肉或蛇肉。另外一个不可忽视的感染途径是将含有裂头蚴的生青蛙肉或是蛇肉用于治疗皮肤溃疡或是眼部炎症[5,6]。裂头蚴进入人体之后,能够寄生在各种组织,例如眼睛、皮下组织、内脏器官和脑部。裂头蚴感染能够导致严重的眼部疾病、组织损伤和脑部功能紊乱。
annexin是依赖钙离子的磷脂结合蛋白,具有多种生物学功能,25年前就已被发现,第一个被分离和纯化是人annexinA7[7]。annexin分为A家族(在脊椎动物中)、B家族(无脊椎动物)、C家族(在真菌类和一些单细胞真核生物)、D类家族(在植物中)和家族E(在原生生物中)[8]。annexin独特的核心区域是4个相似的重复结构域,每个重复结构域由约70个氨基酸组成,并且含有一个结合钙离子特征性的“typeⅡ”或“typeⅢ”结构。annexin能够与各种参与细胞的结构组成、细胞信号转导和控制生长的细胞膜成分相互作用。annexin还能够作为非典型的钙离子通道。许多研究显示annexin在寄生虫中参与了寄生虫与宿主之间的相互作用,并参与宿主的免疫调节[9]。猪带绦虫囊尾蚴的annexinB1被证实在体外能够抑制磷脂酶A2的活性,并且是annexins中的一个分泌成分[10]。在华支睾吸虫中,annexinB30被证实是华支睾吸虫的分泌排泄抗原成分之一,能够在钙离子存在的情况下结合磷脂和人纤溶酶原[11]。牛裂体吸虫的annexin在体外具有溶解纤维蛋白和抗凝的特性,可能对寄生虫在血液中存活发挥重要作用[12]。曼氏裂体吸虫的annexin 2被认为是一个潜在的疫苗候选分子[13]。在麝猫后睾吸虫中,annexin定位在寄生虫的体表,并且可能在免疫反应调节中发挥了作用[14]。
在本次研究中,我们鉴定了来源于曼氏迭宫绦虫的SmannexinB8基因,并且进行了关于潜在生物化学特性的生物信息学分析。我们的结果表明SmannexinB8可能是一个分泌蛋白,能够抑制磷脂酶A2的活性,在寄生虫和宿主相互作用中发挥了非常重要的作用。
1 材料与方法
1.1SmannexinB8核酸序列分析
从狗肠中分离的成虫用来构建曼氏迭宫绦虫的cDNA文库,得到的EST标签由上海联众基因科技研究院完成测序,编码SmannexinB8的cDNA序列从该文库调取,其开放阅读框是通过利用(http:// www.expasy.org/)中的ORF finder tool进行查找。
1.2SmannexinB8氨基酸序列分析
SmannexinB8蛋白的物理化学参数是通过ExPASy ProtParam获取。并利用ExPASy网站进行该蛋白的信号肽和跨膜螺旋的预测。SmannexinB8的保守功能域是通过NCBI/BLAST Home进行检测。利用ExPASy PredictProtein进行SmannexinB8分子功能和生物学过程本体分析,预测该蛋白具有的潜在分子生物学功能。
1.3同源性和分子进化树分析
为了进行同源性和分子进化树分析,我们通过NCBI中获取了不同物种的annexin序列,利用生物信息学分析软件Vector NTI suit 8.0和TreeView进行结果分析。
1.4SmannexinB8结构模型构建
SmannexinB8三维空间是利用编码蛋白的氨基酸通过SWISS-MODEL进行预测和SPDBV 4.10进行结果分析。
1.5SmannexinB8基因克隆
SmannexinB8的开放阅读框以曼氏迭宫绦虫文库中的cDNA作为模板利用PCR的方法进行扩增,特异性的PCR引物是通过Primer Premier 5.0 and PCRDESIGN软件进行设计的,上游和下游引物分别是5′-TAAGAGCTCATGCTGCGTTACAG TCG-3′;5′-TTCTCGAGTTAGCACCCAATTAGG GC-3′。扩增的反应条件如下:94℃变性45 s,55℃退火45 s、72℃延伸1 min,共35循环,72℃稳定10 min。PCR产物纯化后,利用相同的限制性内切酶进行酶切并与预先酶切好的原核表达载体pET-28a(+)进行连接。重组的质粒通过DNA测序验证,然后转入到大肠埃希菌DH5α中。
2 结果
2.1核酸序列分析
ORF finder结果显示SmannexinB8核酸序列是全长序列,由1 044个碱基对组成,见图1。
图1 曼氏迭宫绦虫SmannexinB8的开放阅读框Figure 1The open reading frame of SmannexinB8
2.2编码氨基酸的特征
SmannexinB8蛋白由347个氨基酸组成,如图2所示。氨基酸组成部分主要为Leu,Ala,Glu和Asp,分别占了12.4%,10.4%,8.9%and 7.5%。预测该蛋白的理论分子量是38.7 kDa,理论pI值是4.95。该蛋白在哺乳动物中的半衰期是30 h,在酵母和大肠埃希杆菌中体内表达的半衰期分别大于20 h和10 h。该蛋白是一个稳定的蛋白,其不稳定系数是31.15。预测的C值、S值和Y值都低于0.5,这提示了该蛋白没有信号肽,如图3A所示。跨膜螺旋分析结果显示了该蛋白不是一个跨膜蛋白,可能是一个可溶性的蛋白分子,如图3B所示。

图2 曼氏迭宫绦虫SmannexinB8的氨基酸组成Figure 2Amino acid composition of SmannexinB8
2.3同源性和进化树分析
通过annexin的多序列比对,结果如图4显示,SmannexinB8编码氨基酸序列与多房棘球绦虫、口膜壳绦虫、细粒棘球绦虫、华支睾吸虫和人的annexin基因的同源性分别是68%,67%,65%,46%and 40%。该蛋白是由4个annexin重复结构域组成,同源功能域包含了一个特殊的typeⅢ(“GxGTDE”结构)钙离子结合位点,这个结构能够增强钙离子和磷脂之间的亲和力。此外,K/H/ RGD结构分别在重复结构域Ⅱ和Ⅲ中。IRI结构与人、猪带绦虫和粪类圆线虫中的重复结构域IV相互识别,IRI结构具有肌动蛋白结合功能,而在SmannexinB8中编码氨基酸发生了变化。
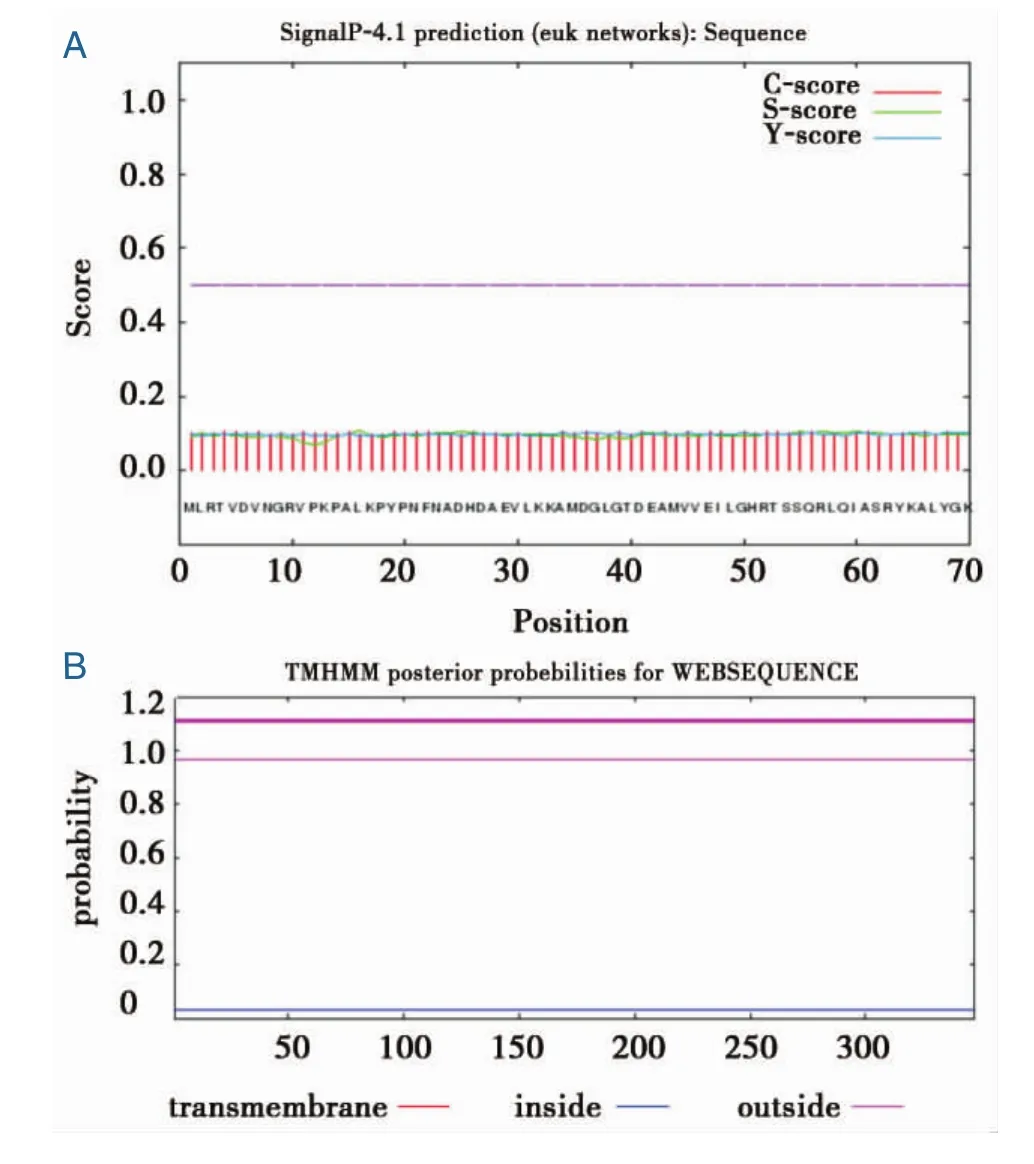
图3 曼氏迭宫绦虫Smannexin B8的功能区域分析Figure 3Analysis of Smannexin B8 functional domains
SmannexinB8的分子进化树结果显示SmannexinB8与绦虫属(多房棘球绦虫和口膜壳绦虫)亲源性更近,而与其他例如吸虫属和哺乳动物亲源性较远,见图5。
2.4SmannexinB8结构模型
SmannexinB8的保守功能区由4个annexin重复结构域组成(图6A)。该结构域的组成分别是26(aa)-88(aa)、100(aa)-171(aa)、204(aa)-268(aa)和280(aa)-344(aa)。通过SWISS-MODEL对SmannexinB8的三维空间结构进行预测,如图6B所示。其中,4个结构域分别由4种不同原子方式显示出来。
2.5分子功能和生物过程的本体论分析
分子功能分析显示SmannexinB8能够与钙离子依赖性磷脂、钙离子、磷脂酰丝氨酸和真核细胞表面等相结合,该蛋白还具有结构分子活性和抑制磷脂酶A2的功能。同时,SmannexinB8在抗凋亡、细胞形状调节、细胞增殖、信号转导、细胞内钙离子平衡、细胞之间黏附和炎症反应的生物过程中都发挥重要的作用。
2.6SmannexinB8基因的分子克隆
SmannexinB8全长基因经特异性引物进行PCR扩增后得到,然后克隆到原核表达载体pET-28a(+)中,重组质粒通过DNA测序和限制性内切酶Sac1和Xhol1酶切鉴定证实,双酶切得到的条带分别与PCR产物和pET-28a(+)质粒的条带相一致(图7)。
3 讨论
annexin是一个存在多种真核细胞中并参与钙离子和膜结合蛋白表达的家族[15]。该家族成员具有各种功能,如参与细胞的活动、钙离子信号转导和生长调节。在本实验研究中,SmannexinB8是第一次被鉴别和进行生物信息学分析。SmannexinB8的结构和潜在功能特征也进行了描述。在我们实验研究中,SmannexinB8的全长序列从曼氏迭宫绦虫的成虫cDNA文库中分离得到(图1),由347氨基酸组成。虽然annexins是胞内蛋白,不仅能定位在细胞质中,也能与细胞膜和细胞骨架蛋白结合[16]。尽管SmannexinB8缺乏分泌信号肽且不属于膜蛋白,但是许多研究证实该蛋白存在于细胞外[17-20]。在猪带绦虫中,annexinB1通过蛋白印迹分析在囊尾蚴的囊液中和囊尾蚴感染的猪血清中检测到[10]。这结果提示annexinB1属于annexin家族中的分泌蛋白。annexinB30也分别通过LC-MS/MS[21]和蛋白印迹实验证实是华支睾吸虫的分泌排泄抗原之一[11]。另外,进化树分析结果显示,SmannexinB8与多房棘球绦虫和华支睾吸虫亲源性也较近。综合以上结果,SmannexinB8可能是曼氏迭宫绦虫分泌排泄抗原成分之一。虫体释放的分泌排泄抗原能够导致病理变化和参与逃避宿主免疫清除和寄生虫吸收营养[22-23]。因此,SmannexinB8可能在寄生虫存活和寄生虫与宿主相互作用中是一个至关重要的分子。

图4 曼氏迭宫绦虫annexinB8与其他物种annexin的序列比对Figure 4Alignment of SmannexinB8 amino acid sequence with annexin from other species

图5 细粒棘球绦虫annexinB8的分子进化树Figure 5Molecular evolution tree of the SmannexinB8

图6 曼氏迭宫绦虫annexinB8典型的4个重复序列分析Figure 6Analysis of 4 repeats of SmannexinB8

图7 SmannexinB8基因的原核表达载体构建Figure 7Cloning of gene encoding Smannexin B8
annexin多序列比对结果显示SmannexinB8的编码氨基酸序列与人annexin序列相似性只有40%。由于SmannexinB8与人annexin的同源性相对较低,所以SmannexinB8有望成为控制人类裂头蚴病的有价值的疫苗开发靶点。该蛋白同源功能域中含有“GxGTDE”结构,说明SmannexinB8拥有特征性的typeⅢ的钙离子结合位点。该位点能够使其与钙离子和磷脂高亲和力结合[8,16]。由于结合钙离子的KGD结构位于repeatⅡ和repeatⅢ之间,SmannexinB8可能拥有在钙离子存在时结合磷脂的特性。此外,KGD结构在膜相互作用和受体靶标中的作用阐明了annexin的功能[24]。然而,与人annexin相比,IRI肌动蛋白结合结构被其他氨基酸代替。有些annexin在体外直接与聚合肌动蛋白相互作用,从而参与调节、稳定和介导细胞膜肌动蛋白[25]。事实上,也有报道提示了IRI结构存在与否都不影响annexin结合肌动蛋白[26]。此外,该蛋白的保守功能域和它的三维空间结构分析显示SmannexinB8保持它的结构完整性。生物过程和分子功能本体论分析提示SmannexinB8参与多种重要生物功能,例如钙离子依赖的磷脂相互作用、抗凋亡、细胞增生和炎症调节。SmannexinB8还参与细胞内钙离子平衡和抑制磷脂酶A2的活性,磷脂酶A2是脂质炎症调节中的限速步骤。而控制磷脂酶A2的活性是调节炎症过程的重要环节[27]。在猪带绦虫研究中发现,annexinB1通过抑制哺乳动物的磷脂酶A2来下调宿主的炎症反应[10]。此外,还有研究报道annexin也可能是通过释放IL-10介导炎症反应[28]。这些都提示了SmannexinB8可能通过抑制磷脂酶A2活性和介导IL-10释放来参与免疫反应。在生物学过程的本体论分析中,SmannexinB8在抗凋亡中发挥重要作用。凋亡是生理细胞死亡的过程,在这个过程当中,细胞可以在没有诱发免疫反应的情况下,从体内清除[27]。McKanna的研究发现在经历凋亡的乳腺导管的肺泡细胞中,annexin1的表达中显著增加[29]。许多的研究也证实了在一些细胞中,annexin1可能通过发挥钙离子流的作用来参与调节细胞的凋亡[30]。此外,SmannexinB8的理论分子量和pI值分别是38.7 kDa和4.95。该蛋白是属于稳定的蛋白,并且原核表达质粒已经构建成功。这些实验结果为进一步的实验研究奠定了扎实的基础。
[1]Anantaphruti MT,Nawa Y,Vanvanitchai Y.Human sparganosis in Thailand:an overview[J].Acta Trop,2011,118(3):171-176.
[2]Cui J,Li N,Wang ZQ,et al.Serodiagnosis of experimentalsparganuminfectionsofmiceandhuman sparganosis by ELISA using ES antigens of Spirometra mansoni spargana[J].Parasitol Res,2011,108(6):1551-1556.
[3]Hong ST,Kim KJ,Huh S,et al.The changes of histopathology and serum anti-sparganum IgG in experimental sparganosis of mice[J].Kisaengchunghak Chapchi,1989,27(4):261-269.
[4]Lee SH,Chai JY,Seo BS,et al.Two cases of human infection by adult of Spirometra erinacei[J].Kisaengchunghak Chapchi,1984,22(1):66-71.
[5]Fukushima T,Yamane Y.How does the sparganosis occur?[J].Parasitol Today,1999,15(3):124.
[6]Magnino S,Colin P,Dei-Cas E,et al.Biological risks associated with consumption of reptile products[J].Int J Food Microbiol,2009,134(3):163-175.
[7]Creutz CE,Pazoles CJ,Pollard HB.Identification and purification of an adrenal medullary protein(synexin) that causes calcium-dependent aggregation of isolated chromaffin granules[J].J Biol Chem,1978,253(8):2858-2866.
[8]Moss SE,Morgan RO.The annexins[J].Genome Biol,2004,5(4):219.
[9]Hofmann A,Osman A,Leow CY,et al.Parasite annexins—new molecules with potential for drug and vaccine development[J].Bioessays,2010,32(11):967-976.
[10]Gao YJ,Yan HL,Ding FX,et al.Annexin B1 at the host-parasite interface of the Taenia solium cysticercus:Secreted and associated with inflammatory reaction[J]. Acta Trop,2007,101(3):192-199.
[11]He L,Ren M,Chen X,et al.Biochemical and immunological characterization of annexin B30 from Clonorchis sinensis excretory/secretory products[J].Parasitol Res,2014,113(7):2743-2755.
[12]Torre-Escudero E,Manzano-Román R,Siles-Lucas M,et al.Molecular and functional characterization of a Schistosoma bovis annexin:fibrinolytic and anticoagulant activity[J].Vet Parasitol,2012,184(1):25-36.
[13]Tararam CA,Farias LP,Wilson RA,et al.Schistosoma mansoni Annexin 2:molecular characterization and immunolocalization[J].Exp Parasitol,2010,126(2):146-155.
[14]Yonglitthipagon P,Pairojkul C,Chamgramol Y,et al. Up-regulation of annexin A2 in cholangiocarcinoma caused by Opisthorchis viverrini and its implication as a prognostic marker[J].Int J Parasitol,2010,40(10):1203-1212.
[15]Hayes MJ,Moss SE.Annexins and disease[J].Biochem Biophys Res Commun,2004,322(4):1166-1170.
[16]Gerke V,Moss SE.Annexins:from structure to function[J].Physiol Rev,2002,82(2):331-371.
[17]Rocha V,Lozano JJ,Haindl AH.Evidence for differential localization of annexin VI during mammary secretory differentiation[J].Biochem Soc Trans,1990,18(6):1110-1113.
[18]Hajjar KA,Guevara CA,Lev E,et al.Interaction of the fibrinolytic receptor,annexin II,with the endothelial cell surface.Essential role of endonexin repeat 2[J].J Biol Chem,1996,271(35):21652-21659.
[19]Donnelly SR,Moss SE.Annexins in the secretory pathway[J].Cell Mol Life Sci,1997,53(6):533-538.
[20]Vergnolle N,Pagès P,Guimbaud R,et al.Annexin 1 is secreted in situ during ulcerative colitis in humans[J]. Inflamm Bowel Dis,2004,10(5):584-592.
[21]Zheng M,Hu K,Liu W,et al.Proteomic analysis of excretory secretory products from Clonorchis sinensis adult worms:molecular characterization and serological reactivity of a excretory-secretory antigen-fructose-1,6-bisphosphatase[J].Parasitol Res,2011,109(3):737-744.
[22]Liang P,Sun J,Huang Y,et al.Biochemical characterization and functional analysis of fructose-1,6-bisphosphatase from Clonorchis sinensis[J].Mol Biol Rep,2013,40(7):4371-4382.
[23]Devitofrancesco G,Granati A,Sperduto B.Danger from the smoke during manufacturing of silicon-iron[J].Med Lav,1971,62(4):181-184.
[24]Morgan RO,Martin-Almedina S,Iglesias JM,et al. Evolutionary perspective on annexin calcium-binding domains[J].Biochim Biophys Acta,2004,1742(1-3):133-140.
[25]Babiychuk VS,Draeger A,Babiychuk EB.Smooth muscle actomyosin promotes Ca2+-dependent interactions between annexin VI and detergent-insoluble glycosphingolipid-enriched membrane domains[J].Acta Biochim Pol,2000,47(3):579-589.
[26]Konopka-Postupolska D.Annexins:putative linkers in dynamic membrane-cytoskeleton interactions in plant cells[J].Protoplasma,2007,230(3-4):203-215.
[27]Parente L,Solito E.Annexin 1:more than an anti-phospholipase protein[J].Inflamm Res,2004,53(4):125-132.
[28]Ferlazzo V,D'Agostino P,Milano S,et al.Anti-inflammatory effects of annexin-1:stimulation of IL-10 release and inhibition of nitric oxide synthesis[J].Int Immunopharmacol,2003,3(10-11):1363-1369.
[29]McKanna JA.Lipocortin 1 in apoptosis:mammary regression[J].Anat Rec,1995,242(1):1-10.
[30]Wang HG,Pathan N,Ethell IM,et al.Ca2+-induced apoptosis through calcineurin dephosphorylation of BAD[J].Science,1999,284(5412):339-343.
Sequence bioinformatics analysis and gene cloning of annexinB8 from Spirometra mansoni
LIANG Pei1,LV Gang1,ZHOU Xiaojun2,CHEN Xinxin1,CHEN Xiaojing1,FU Ruijia1★
(1.Department of Pathogen Biology,Hainan Medical College,Haikou,Hainan,China,571199;2.Clinical Laboratory,Hainan Province People's Hospital,Haikou,Hainan,China,570311)
ObjectiveTo provide information and solid materials for further research on annexinB8 of Spirometra mansoni(SmannexinB8)which may participate in mediating host immune response.Methods The open reading frame of SmannexinB8 was found with ORF finder tool in NCBI website.ExPASy website was used to predict the physical and chemical parameters of protein,signal peptide,transmembrane helices and potential molecular and biological functions.The conserved domains of the protein were detected by NCBI/BLAST Home.In order to analyze the homology and phylogenetic tree,sequences of annexins from various species were obtained from NCBI website,and the results were analyzed by Vector NTI suit 8.0 and TreeView software.The three-dimensional structure of SmannexinB8 was predicted by SWISS-MODEL and was analyzed by SPDBV 4.10.Moreover,the gene was amplified and cloned into a prokaryotic expression vector pET-28a(+).ResultsSmannexinB8 was full-length gene and encoded 347 amino acid residues. The protein was composed of four annexin repeats without signal peptide and a stably soluble molecule.Itwas a conservative annexin in three-dimensional structure.SmannexinB8 was homologous to annexins from Echinococcus multilocularis,Hymenolepis microstoma,Echinococcus granulosus,Clonorchis sinensis and Homo sapiens with 68%,67%,65%,46%and 40%identities,respectively.SmannexinB8 clustered with the annexins from the tapeworm genus,but not with other species like trematode and mammal animals.Conclusions SmannexinB8 might have a multitude of functions:inhibition of phospholipase A2,promoting fusion,mediating immune response and formation of ion channel.SmannexinB8 might play a critical role in the host immune response.
Spirometra mansoni;AnnexinB8;Bioinformatics analysis;Multi-functions
国家自然科学基金课题(81260254);海南省自然科学基金课题(814289)
1.海南医学院病原生物学教研室,海南,海口571199 2.海南省人民医院检验科,海南,海口570311
符瑞佳,E-mail:18171809@qq.com
